早期连续性血液净化治疗在重度脓毒症合并急性肾损伤患者中的应用价值
郭磊
(信阳市中心医院 肾病内科,河南 信阳 464000)
严重感染引起的脓毒症通常伴有多器官功能障碍,且随着病菌毒素不断释放入血可导致全身感染[1-2]。脓毒症引起的肾供血不足是导致急性肾损伤(acute kidney injury,AKI)的主要原因之一。随病情发展,脓毒症合并急性肾损伤将出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),患者病死率较高[3]。脓毒症诱发的急性肾损伤其发病机制尚未完全清楚,临床缺乏针对性治疗措施[4],主要依靠连续性血液净化治疗(continuous blood purification,CBP)清除体内病菌内毒素,调节炎症因子及机体酸碱平衡,疗效显著。但有研究认为,CBP干预时机对患者预后存在不同影响,早期实施CBP可以尽快恢复内环境稳定,有助于降低并发症发生[5]。本研究选取信阳市中心医院收治的236例重度脓毒症合并急性肾损伤患者作为研究对象,探讨早期连续性血液净化治疗在重度脓毒症合并急性肾损伤患者中的应用价值。
1 资料与方法
1.1 一般资料选取2016年2月至2019年2月信阳市中心医院收治的236例重度脓毒症合并急性肾损伤患者作为研究对象,根据选取标准最终纳入108例患者,按照治疗方式分为A组(n=60)和B组(n=48)。A组男36例,女24例;年龄38~72岁,平均(42.32±11.51)岁;体质量指数(body mass index,BMI)24.26~26.25 kg·m-2,平均(26.13±2.62)kg·m-2;感染部位为腹腔感染25例,盆腔感染18例,肺部感染11例,泌尿系统感染4例,血行感染2例;合并症为高血压16例,糖尿病18例,高脂血症26例。B组男34例,女14例;年龄32~76岁,平均(46.16±12.19)岁;BMI 22.64~27.01 kg·m-2,平均(26.60±5.60)kg·m-2;感染部位为腹腔感染21例,盆腔感染13例,肺部感染8例,泌尿系统感染3例,血行感染3例;合并症为高血压19例,糖尿病15例,高脂血症22例。 两组性别、年龄、BMI、感染部位及合并症比较,差异无统计学意义(P>0.05),具有可比性。患者自愿参与本次临床试验研究并签署知情同意书。本研究经信阳市中心医院医学伦理委员会审批通过。
1.2 选取标准(1)纳入标准:①符合美国重症医学会与欧洲重症医学会联合发布的脓毒症诊断标准(2016版3.0)和国际改善全球肾脏病预后组织发布的急性肾损伤诊断标准(2012年)[6];②接受CBP治疗。(2)排除标准:①药物禁忌证;②存在理解能力障碍。
1.3 治疗方法患者接受个体化液体复苏、抗感染、血管活性药物、糖皮质激素、机械通气等器官功能支持治疗,同时采用意大利贝尔克公司的BLS814高通量血液净化器实施血液灌流治疗,选择颈内静脉或股静脉留置双腔血滤导管建立临时血管通路,首剂肝素0.5~0.8 mg·kg-1,调节血流量150~200 mL·min-1,灌注3 h后改用连续滤过模式,并将血流量增高至250 mL·min-1,肝素6~8 mg·h-1。A组患者在发病后12~24 h接受CBP治疗,B组患者则在发病后24~48 h接受CBP治疗,两组患者连续治疗4 d。
1.4 观察指标
1.4.1肾功能 治疗前、后采用放射免疫法检测患者血浆内皮素(endothelin,ET)、血清尿素氮(blood urea nitrogen,BUN)、肌酐(serum creatinine,Scr)等肾功能指标变化情况。
1.4.2免疫功能 采用美国贝克曼库尔特公司Epics SY流式细胞仪检测CD3+、CD4+及CD4+/ CD8+免疫功能指标变化情况。

2 结果
2.1 肾功能治疗前,两组ET、BUN、Scr水平比较,差异无统计学意义(P>0.05);治疗后,两组ET、BUN、Scr水平较治疗前降低,且A组低于B组,差异有统计学意义(P<0.05)。见表1。
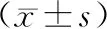
表1 两组ET、BUN及Scr水平比较
2.2 免疫功能治疗前,两组CD3+、CD4+及CD4+/ CD8+水平比较,差异无统计学意义(P>0.05);治疗后,两组CD3+、CD4+及CD4+/ CD8+水平升高,且A组高于B组,差异有统计学意义(P<0.05)。见表2。
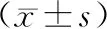
表2 两组患者CD3+、CD4+及CD4+/ CD8+水平比较
3 讨论
脓毒症是一种全身炎症反应综合征,由于患者体内一系列炎性细胞激活,释放多种炎症递质,形成瀑布样级联反应,打破机体炎症平衡,能够导致多器官功能障碍的发生,而肾是脓毒症损伤的主要靶器官之一[7]。其中约50%的AKI由脓毒症引起,脓毒症合并急性肾损伤患者病死率高达72%[8]。目前,脓毒症相关性肾损伤的病理生理机制尚不明确,越来越多的学者认为其可能与肿瘤坏死因子、氧化应激、炎症递质及内毒素导致的肾小管损伤有关。致病菌及毒素通过血液循环抑制机体免疫功能,同时导致大量T淋巴细胞凋亡,严重损伤免疫系统[9]。CBP是改善免疫抑制状态和炎症反应的有效措施,是脓毒症合并AKI治疗的重要辅助手段。但实际上对脓毒症合并AKI患者行CBP治疗的准确时间仍需进一步深入探讨。临床上脓毒症患者普遍存在脓毒症休克情况,另外液体复苏方案的选择等原因导致CBP延迟。研究发现,早期CBP治疗并不增加低血压事件风险[6]。有研究提出,脓毒症患者早期发生脓毒症休克不应成为CBP的禁忌证,通过对比CBP不同治疗时机发现,早期行CBP治疗的脓毒症合并AKI患者能够从中获益,早期治疗组患者ET、BUN及Scr肾功能指标水平低于对照组[9]。另外,重度脓毒症患者常出现免疫紊乱,导致淋巴细胞比例失衡[10]。本研究结果显示,治疗后A组患者CD3+、CD4+及CD4+/ CD8+水平高于B组,提示尽早实施CBP治疗有助于提高患者免疫功能。分析其原因可能为,尽早实施CBP治疗可以有效清除脓毒症患者体内炎症介质,抑制炎症反应,激活T淋巴细胞,调节免疫功能平衡。有研究认为,临床中在实施CBP治疗时机的选择上,对于急性生理与慢性生理评分≥20分的重度脓毒症合并急性肾损伤患者,可以通过全身炎症综合征评分判断病情,及早实施CBP治疗,以提高免疫功能,改善微循环状态,为重度脓毒症合并急性肾损伤患者赢得进一步治疗时间[11]。
综上,早期连续性血液净化治疗重度脓毒症合并急性肾损伤患者能够改善其肾功能,调节免疫功能。

