三维可视化联合术中超声联合超声乳化吸引在巨大肝血管瘤精准手术中的应用一例
庞润华 朱亚青 吴健 陈彬
病人,女性,46岁。因反复右上腹疼痛不适8个月余于2020年1月2日入院。血常规、血生化、凝血功能、感染八项、甲胎蛋白、癌胚抗原、糖类抗原19-9等肿瘤指标正常,否认肝炎等传染病史。腹部平扫+增强CT检查提示:肝右叶巨大稍低密度肿块影,边界清楚,密度均匀,大小约16.7 cm×11.2 cm×17.6 cm,增强期可见肿瘤边缘强化,静脉期消退不明显,诊断为肝右叶巨大血管瘤(图1)。术前三维重建可见肿瘤与肝中静脉、门静脉分支紧密粘连,明确肿瘤体积及术后残留体积(图2)。术前行肝储备功能检查,注射吲哚箐绿0.5 mg/kg,15分钟滞留率2.6%,术前肝功能Child-Pugh评分A级(图3)。排除手术禁忌证后行手术治疗。术中使用超声联合、超声吸引装置CUSA精准完整切除肿瘤,完整保留周围重要大血管(图4)。切除肿瘤标本肝包膜完整,切缘未见肿瘤残余。术后病理检查显提示肝海绵状血管瘤(图5)。手术顺利完成,手术时间210分钟,术中出血量约150 ml。术后未见并发症,术后5天出院。
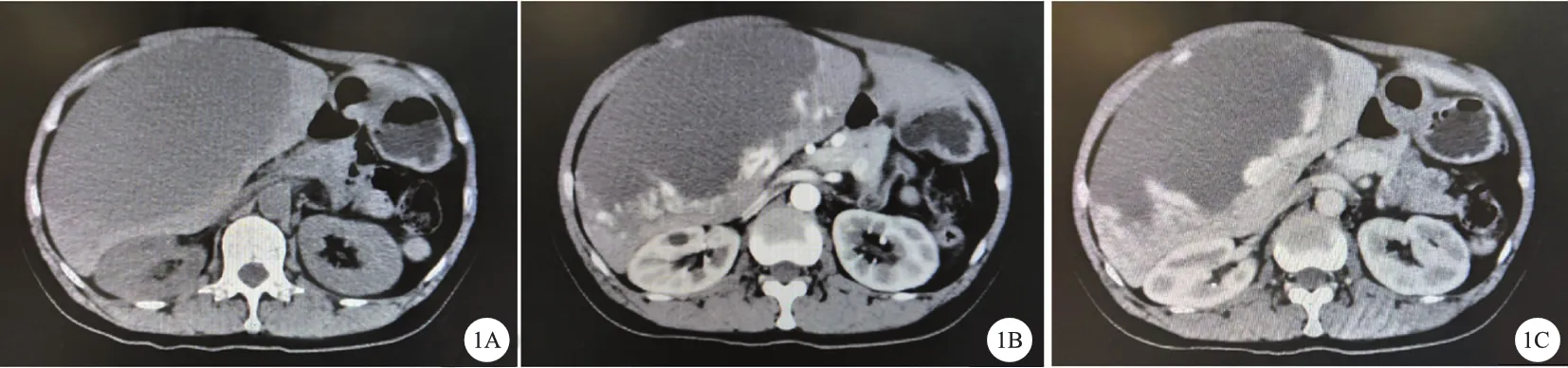
A:2020年1月腹部CT平扫可见肝右叶巨大低密度肿块影,边界清,密度均匀;B:动脉期可见肿瘤边缘不均匀强化;C:静脉期可见肿瘤边缘强化不消退,且向中心强化趋势

A:2020年1月三维重建可见肿瘤与肝内静脉血管紧密粘连,其中与肝中静脉粘连明显,术中分离、完整保留血管难度极大;B:三维重建可见肿瘤与肝内动脉血管紧密粘连,其中与门静脉右支粘连明显,术中分离、完整保留血管难度较大;C:根据病人的身高体重计算病人的肝脏体积、肿瘤体积及剩余肝体积,评估手术风险
讨论成人肝血管瘤是最常见的肝脏良性肿瘤,以肝海绵状血管瘤最为常见[1-2]。绝大部分肝血管瘤因无恶变倾向,可终身与瘤共存,但仍有部分病人因血管瘤进展,出现腹痛等症状并自发性破裂出血[3]。三维成像技术(three-dimensional visualization technology,3DVT)有助于手术的术前规划,术前可通过三维重建和影像资料精准定位肿瘤位置,以及肿瘤与周围组织的空间关系,计算肿瘤体积及剩余肝体积等[4-5]。吲哚箐绿清除试验可以敏感的测定肝储备功能,超声吸引装置CUSA可以在手术切除肝组织的过程中保护血管。
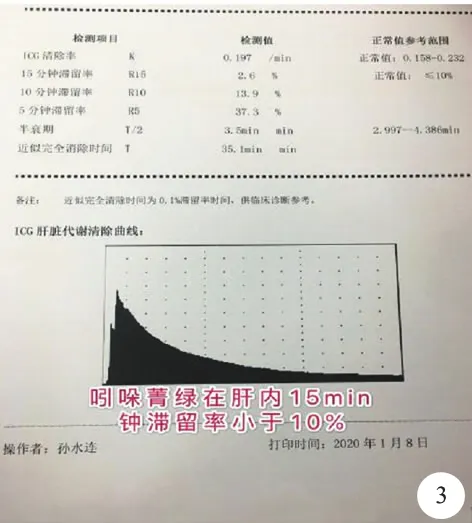
图3 2020年1月,吲哚箐绿清除试验肝脏代谢清除率检查提示15 分钟内吲哚箐绿滞留率<10%

A:2020年1月 ,术中使用CUSA仔细分离,争取最大保留血管,争取保留最大的剩余肝体积;B:经过术前的三维重建精准定位肿瘤与周围组织的关系,结合术中B超的动态监测,使用CUSA精细分离的过程中保护血管,摘除肿瘤后成功的完整保留了周围紧密粘连的重要大血管

A:精准完整切除标本,肿瘤表面肝包膜完整;B:可见弥漫扩张的血窦(HE,×200)
基于67万健康体检人群的统计分析结果表明,肝血管瘤的发病率约为1.5%,早期通常无症状,以单发病灶最为常见(61%),生长缓慢,病程较长,肝功能无明显异常[6-7]。若肿瘤直径>5 cm,可因对临近组织和脏器压迫产生临床症状。肝血管瘤的诊断目前主要依赖于影像学检查。联合使用多种检查手段,可提高肝血管瘤的诊断准确率。超声、CT和MRI检查肝血管瘤的准确率分别为61%、77%和92%[8-9]。以肿瘤直径5 cm作为分型分界点,肿瘤直径≥10.0 cm为巨大血管瘤[10]。巨大血管瘤有破裂出血的风险,是外科手术的绝对适应征[11]。根据2019版由国际肝胆胰协会中国分会肝血管专业委员会拟定的《肝血管瘤诊断和治疗多学科专家共识》[12],本例病人有手术治疗指征。肿瘤的直径和位置、肝组织切除量、术中出血量等是影响肝血管瘤术后并发症的危险因素,与病人的预后密切相关。对病人术前影像资料进行三维重建,在术前可以明确肿瘤与周围组织的空间结构关系,精准定位肿瘤的位置及肝脏体积,同时进行吲哚箐绿试验准确了解肝储备功能结果,提高了手术的成功率。
我们利用三维可视化技术,术中联合超声乳化吸引技术,精准、完整地手术切除巨大肝血管瘤。通过术前精准评估、术中准确定位肿瘤,增加手术中对肿瘤的触感和整体感知。本例病人为巨大肝血管瘤,腹腔镜牵引暴露较为困难,且视野角度受限。通过开腹的手术方式,采取了术中CUSA切除,完整保留了与肿瘤紧密粘连的重要大血管,最大程度的保留了正常剩余肝组织,术中出血少、肿瘤表面包膜完整,术后病人肝功能基本正常,手术安全、疗效满意。

