污染菌对血培养及血流感染三联检检测影响的评估研究
章婷,杜小文
(1.万年县中医院检验科;江西 万年 335500)
血培养是血流感染诊断的金标准,但采血过程易受到污染。一个由CAP 主导的影响重大的研究,发现来自美国640 家医院497134 例血培养标本污染率平均污染率为2.5%, 常见污染菌为凝固酶阴性葡萄球菌、 微球菌、α-溶血草绿色链球菌、痤疮丙酸杆菌、棒状杆菌以及芽孢杆菌[1,2]。
污染菌产生的假阳性导致临床面对报告单的迷茫,也由于无对应的症状和治疗容易引起患者的抱怨和投诉。血培养污染的原因主要有:采血人员无菌意识差;采血环境不达标,穿刺间空气消毒不合格;皮肤消毒不规范不彻底;培养瓶瓶塞穿刺区消毒不规范不彻底,且采血的皮肤消毒过程不可能做到无菌,因为约20%的细菌隐藏在汗液的毛孔、毛囊及表皮和真皮深层的其它结构中[3],目前的医疗环境, 这些问题是很难在短时间内得到改善的,而PG、LPS 和BG 检测是目前检测血流感染的新的血清学方法,通过这3 个标志物的检测可以区分革兰氏阳性细菌、革兰氏阴性细菌和真菌引起的血流感染,具有早期诊断以及连续检测等特点[4-6],但是采血过程引入的污染菌是否同样会对其造成干扰,尚无人研究。本研究通过制备模拟临床采血污染样本,进行血培养和血流感染三联检的检测及污染样本菌繁殖情况分析,对培养法和生化检测常见污染菌的干扰情况进行评估,为临床使用相关方法学检测应注意的事项提供参考。
1 对象与方法
1.1 菌株 共分为 3 类。Ⅰ.G+表皮葡萄球菌Staphylococcus epidermidis ATCC12228、 葡萄球菌人亚种Staphylococcus hominis ATPQ15020、藤黄微球菌Micrococcus luteusCMCC(B)28001、血链球菌Streptococcus sanguis ATCC10556、 痤疮丙酸杆菌Propionibacterium acnes ATCC6919、假白喉棒状杆菌Corynebacterium pseudodiphtheriticum ATCC10 700、 解淀粉芽孢杆菌 Bacillus amyloliquefaciensATJD161125 Ⅱ.G-鲍曼不动杆菌 Acinetobacter baumannii ATCC19606,洋葱伯克霍尔德菌Burkholderia cepacia ATCC25608, 嗜麦芽窄食单胞菌Stenotrophomonas maltophilia ATCC17666;Ⅲ.真 菌烟曲霉Aspergillus fumigatus CICC40167、宛氏拟青霉Paecilomyces variotii ATCC18502,所有标 2.试剂及仪器:生物安全柜 1300 SERIES A2,购自Thermo Scientific;CO2培养箱 HERACELL 150I,购自 Thermo Scientific;厌氧产气袋 AnaeroGen 2.5 L,购自Thermo Scientific,比浊仪 PLASTIC plus,购自生物梅里埃;血球计数板,采购自上海求精生化试剂仪器有限公司;0.9%氯化钠注射液购自山东齐都药业有限公司;手工血培养瓶、沙保罗琼脂平板、血琼脂平板,购自郑州安图生物工程股份有限公司;血流感染三联检革兰氏阳性细菌肽聚糖检测试剂盒(显色法)、革兰氏阴性细菌内毒素检测试剂盒(显色法)、真菌(1-3)-β-D-葡聚糖检测试剂盒(显色法)来自于郑州安图生物工程股份有限公司,检测仪器为全自动酶标分析仪, 购置自安图实验仪器(郑州)有限公司。
1.3 检测方法 ⑴菌液制备 提前将菌株活化,转接第二代备用。用接种环挑取菌落,用0.9%氯化钠注射液将G+菌和G-菌在比浊管中进行稀释,先用比浊仪制备成0.5 麦氏菌液(浓度按照108CFU/ml 进行计算), 再用0.9%氯化钠 注射液稀释到102CFU/ml(H)和 101CFU/ml(L)两个浓度(取 102CFU/ml 菌悬液100μl 涂血平板计数; 烟曲霉以及宛氏拟青霉制备成分生孢子悬浊液后用血球计数板进行计数, 用0.9%氯化钠注射液稀释到5*102CFU/ml(H)和 5*101CFU/ml(L)两个浓度,取 5*102CFU/ml 菌悬液100μl 涂平板菌落计数。⑵模拟血液污染菌样本制备 新鲜血液来自8 名志愿者, 近期均无发热等感染症状,近一周未服用抗菌药物。严格按照规范采血要求将血液抽取到肝素抗凝采血管中, 每管 5ml, 立即吸取 200μl 102CFU/ml、101CFU/ml 菌液分别加入到一管全血中, 接菌后轻微颠倒混匀8~10 次,每个菌高、低浓度各6 个平行,高浓度采血管编号H1~H6、 低浓度采血管编号L1~L6。⑶检测 取 H1、H2 采血管中样本分别加入两个血培养瓶中, 取H3、H4 采血管中样品离心后吸取上清立即进行进行PG、LPS、BG 的检测,剩余的样本颠倒混匀后与H5、H6 分成两组, 分别放置室温和2℃~8℃24h 后离心取上清再次进行 PG、LPS、BG 的检测,并涂板进行菌落计数,每个样本涂3 个平板。加低浓度菌液的血液样本按照高浓度样本进行相同处理。以不加菌的血液为阴性对照。除血液采集及离心外, 其余操作均在洁净条件下进行。⑷结果判读及统计 血培养和PG、LPS、BG 检测的操作和结果判读严格按照试剂和仪器说明书进行。血培养瓶分别对应放入普通培养箱及CO2培养箱中进行培养,5~8 天内观察培养结果;PG、LPS、BG 三项检测流程:全血样本 4000r/min 离心10min,取上清作为三项的检测样本,取三项待检样本按照产品试剂盒说明书操作进行实验并回算结果。分别对血培养结果、 平板菌落计数结果及PG、LPS、BG 检测结果进行统计。
2 结果
2.1 模拟样本含菌量制备得到的模拟血污染菌样本的含菌量高浓度约在5~40CFU 每份样本, 低浓度约在0~5CFU 每份样本,符合临床实际的污染菌数量[7](表 1)。
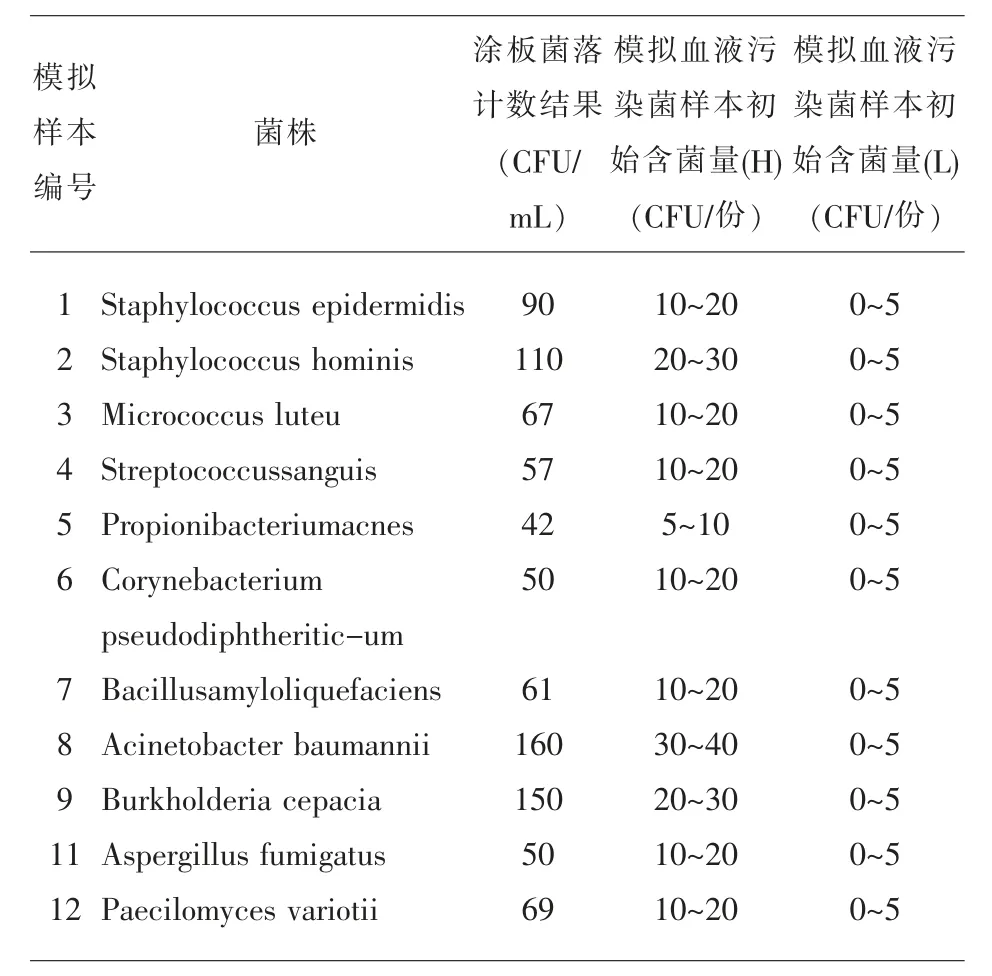
表1 样本制备前菌液涂板菌落计数结果
2.2 血培养及血流感染三联检检测结果分析 血培养模拟样本高浓度均检出阳性,低浓度除痤疮丙酸杆菌和假白喉棒状杆菌外也检出为阳性,而PG、LPS 和 BG 检测放置 0h、2~8℃24h 与室温 24h 样本均为阴性,且检测值均低于检出限,和阴性样本对照无差异。说明这些污染菌在常规污染量会造成血培养的假阳性,而对PG、LPS 和BG 检测无干扰。见表 2。
2.3 样本菌落计数 放置2~8℃和室温24h 后涂板计数,发现各菌株均未出现大量繁殖,由于计数时平板上菌落过少,计数结果不是一个特别精确的数值,但可以确定的是,每个样本中的菌落总数进本维持在原数量的0~10 倍范围内(表3)。而痤疮丙酸杆菌室温和2~8℃样本、 血链球菌2~8℃样本涂板未见菌生长,可能和血液在体外不能维持痤疮丙酸杆菌生长所需的严格厌氧环境相关, 血链球菌2~8℃不生长应为其不耐低温,导致菌死亡。这说明血液并不是一个适宜菌繁殖的环境,菌株在血液中并未出现明显的繁殖和代谢, 所以PG、LPS 和BG检测为阴性是一个正常的结果。
3 讨论
PG、LPS、BG 分别是 G+、G-和真菌细胞壁上的特异性多糖,其含量的增高同血流感染的发生呈高度相关。在体外诊断中,利用这三项标志物同鲎变形细胞产物或昆虫血淋巴中酶原级联体系的反应而检测这三种标志物在血液中的变化,也是血流感染和侵袭性真菌病诊断的一个重要的微生物学标准[8],其中LPS 和BG 检测近年来已发展成为临床用于血流感染较为广泛的指标。PG、LPS、BG 检测的样本是血清或血浆,检测时间一般相对于血培养较为滞后,多在采集后2~8 个小时内进行检测,这可能给样本中的污染菌一个繁殖的时间,而从反应的标志物来说,污染菌和目标菌并无差异,所以说我们研究污染菌对此方法学的干扰是十分必要的。

表2 血培养结果及PG、LPS、BG 检测结果
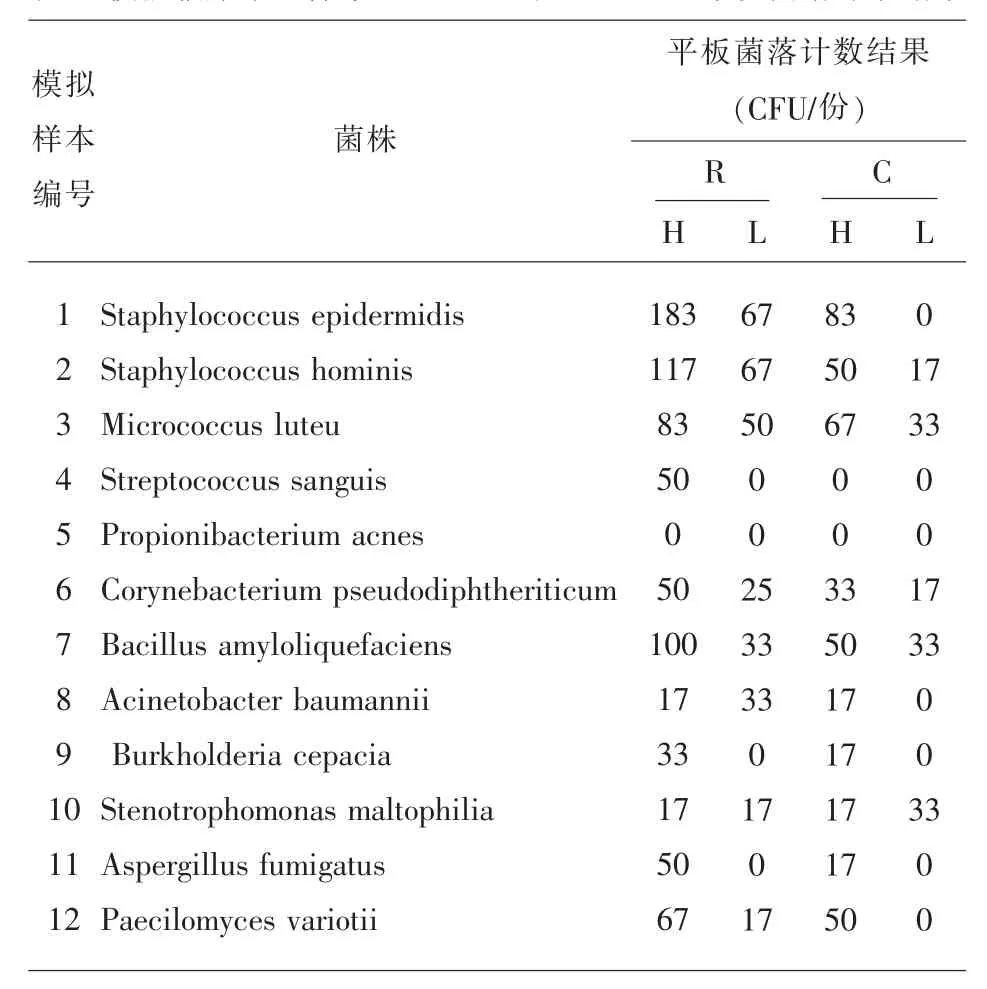
表3 模拟临床采血样本2-8℃24h 及室温24h 平板菌落计数结果
本研究通过制备模拟临床采血污染样本,并对血培养和血流感染三联检的检测结果进行比较,可以看出正常的采血污染确实会造成血培养的假阳性,但是却不会对PG、LPS 和BG 检测产生干扰。有文献显示,多种菌血培养的阳性结果意义很难界定,肠球菌、不动杆菌和其它非发酵革兰氏阴性杆菌在60%~70%的病例中是有意义的,但也有25%~30%意义是不明确的; 草绿色链球菌仅30%有意义;凝固酶阴性葡萄球菌更是挑战,尽管只有10%~15%有临床意义,但它检出相对多,通常比其它菌的三倍还要多[9]。而一项关于医院霉菌相与住院病人感染相关性的研究发现,青霉在环境尘粒样本中的分离概率是51.5%,在手术病人伤口分泌液分离菌株中占比40.4%[7]。临床真正的微生物血流感染,微生物在血液中是不断地生长和衰亡的循环过程,而当人体致病时,机体的免疫系统也处于一个失衡状态,代谢产生的肽聚糖、内毒素或葡聚糖速率超过了机体的清除速率[10],浓度随着疾病进程的不同时期变化,呈现一个先升高,到达高点,再下降最终彻底康复后回复平衡的状态,因此临床真正的血流感染肽聚糖、内毒素或葡聚糖检测结果为阳性,且检测值的高低和感染的程度相关,而血液离体后,体内的免疫细胞还会在一段时间内维持活性,污染菌入血后受人体血液系统的免疫系统影响,很快被吞噬杀死或者处于静态存活,不能持续繁殖,且菌量很低且不持续, 产生的特异性多糖片段被溶菌酶等进一步分解成无法识别的片段[11],因此不会造成血检三项检测干扰, 但这些污染菌如果进入血培养瓶,血培养瓶丰富的培养基质会让其迅速生长繁殖,血瓶的内部环境也会裂解一部分免疫细胞,灭活一部分免疫因子,因而血培养为阳性。因此,传统的血培养无法规避也无法区分污染菌, 而PG、LPS 和BG 检测可以很好的避免污染菌造成的干扰,提高血流感染检测的准确率。

