血清铁蛋白与男性2型糖尿病合并颈动脉硬化的相关性研究
孙丽娜 顾静
糖尿病大血管病变是2型糖尿病(T2DM)主要并发症,也T2DM患者致死致残的重要原因[1],其主要病理生理过程是动脉粥样硬化的形成。颈动脉被称为动脉粥样硬化的窗口,也是全身最早发生病变的血管,临床上可以用B超检测来评估病情的严重程度。铁是人体必需金属元素,但体内铁浓度过高可能促进自由基对组织的损伤而导致多器官病变[2]。本研究分析男性T2DM患者血清铁蛋白(serum ferritin,SF)水平与颈动脉硬化(carotid atherosclerosis,CAS)的相关性,探讨SF在T2DM血管病变发生发展中的作用,为糖尿病合并心脑血管病变的预防和干预提供潜在靶点。
1 资料与方法
1.1 一般资料 2019年1月至2019年12月于华东疗养院体检的728例男性T2DM患者。T2DM诊断符合1990年WHO糖尿病诊断标准。排除标准:近1年内接受激素、铁剂及输血等治疗;糖尿病合并恶性肿瘤;急性感染、血液系统疾病者。根据颈动脉彩超,颈动脉内膜中层厚度(IMT)<1.0 mm者分为非颈动脉粥样硬化组(NCAS组)222例;IMT≥1.0 mm或发生斑块者分为颈动脉粥样硬化组(CAS组)506例。
1.2 研究方法
1.2.1 一般情况 记录患者的年龄、性别、吸烟史、病程等。患者禁食10 h,次日空腹抽取静脉血,测定SF、血常规、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、肌酐(Scr)、尿酸(UA)、血尿素氮(BUN)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、超敏C反应蛋白(CRP)等。
1.2.2 IMT的测量 测定方法:患者取平卧位,超声医师沿血管走向纵切检查。颈动脉内膜中层厚度是指颈动脉内膜内表面到中层外表面之间的垂直距离。测定部位:在颈总动脉交叉处及前后1 cm处,测量3次,取其平均值。
1.3 统计学分析 采用SPSS 25.0软件进行统计学分析。定量资料中呈正态分布者以(±s)表示,两组间比较若符合正态分布,采用独立样本t检验;若不符合正态分布,则用Wilcoxon秩和检验。两组间计数资料比较采用χ2检验。血清SF水平与各指标的相关性采用Spearman相关分析。危险因素采用二分类Logistic多元回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较 两组相比,CAS组的年龄大,SF、HbA1c及CRP水平均增高,差异有统计学意义(P<0.05),其他指标包括FPG、TC、TG、HDL-C、LDL-C、UA、Scr、BUN、血小板等差异无统计学意义(P>0.05)。见表1。
表1 两组患者临床资料比较[(±s),n(%)]
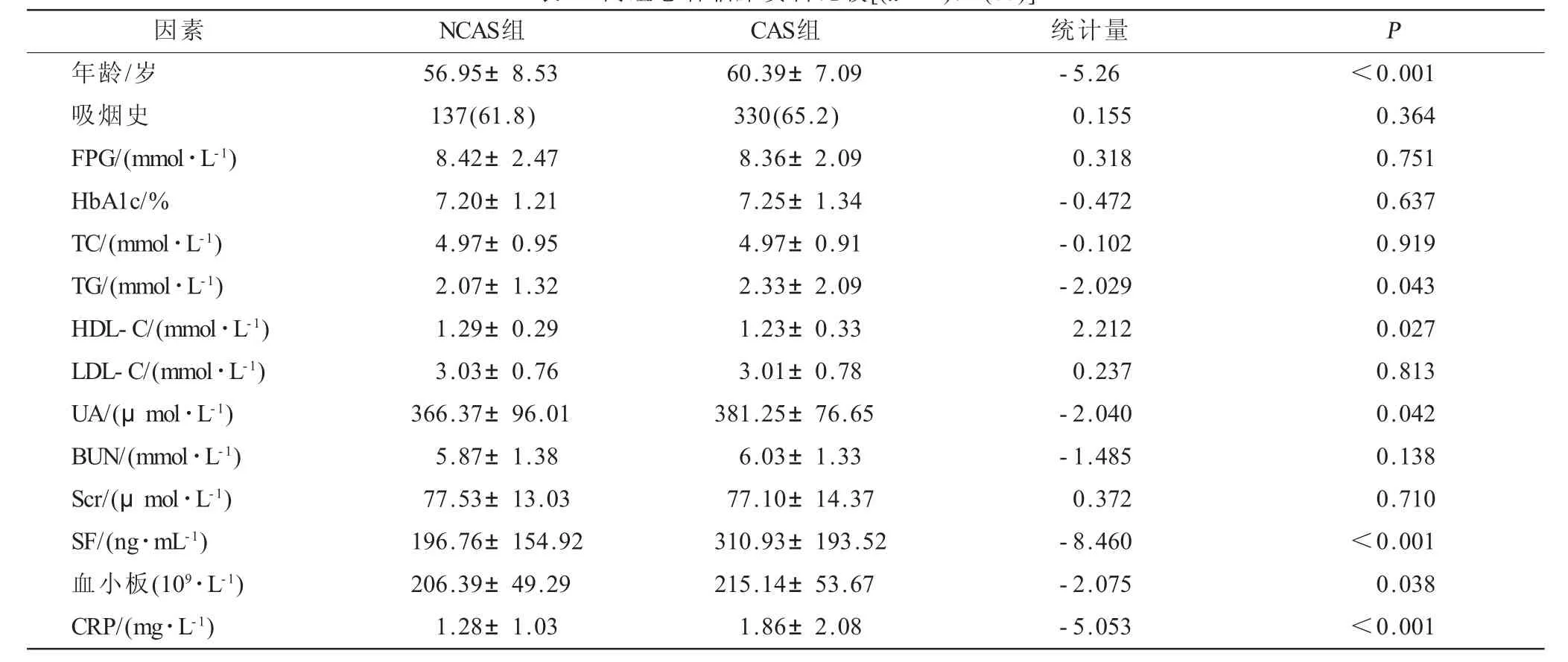
表1 两组患者临床资料比较[(±s),n(%)]
?
2.2 血清SF水平与各指标的关系Spearman相关分析显示,男性T2DM患者血清SF水平与FPG、UA、Scr、TG 呈 正 相 关(r值 分 别 为0.253、0.27、0.19、0.406,P<0.05或P<0.01),与HDL-C呈负相关(r值为-0.203,P<0.05),相关性分析见表2。
2.3 T2DM合并CAS的二分类Logistic分析 以是否合并CAS为因变量,将年龄、HbA1c、SF及CRP作为自变量进行二分类Logistic多元回归分析,结果显示,年龄、SF是T2DM合并CAS的独立危险因素(P<0.05),年龄越大、SF水平越高,合并CAS的风险越大,见表3。
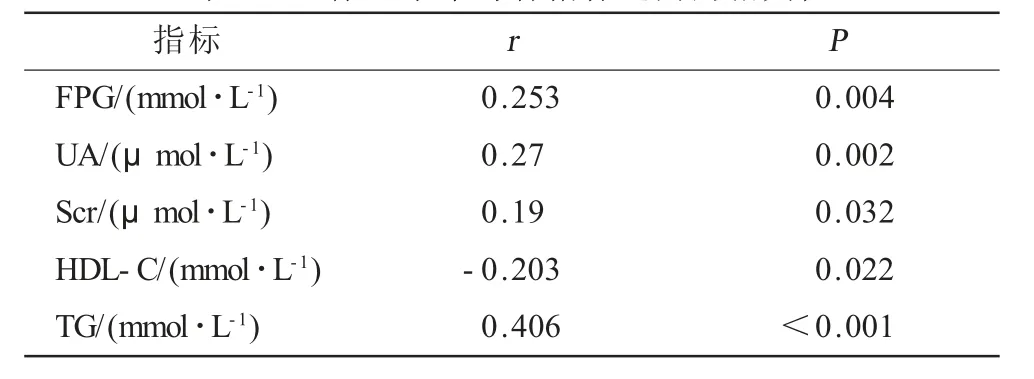
表2 血清SF水平与各指标之间的相关性

表3 T2DM合并CAS 的二分类Logistic分析
3 讨论
铁是人体必需的金属元素,临床中常用血清SF水平评估体内铁含量,作为人体铁超负荷或铁缺乏的指标。多项研究表明血清SF水平与高血压、冠心病、糖尿病、脂代谢紊乱、肥胖等都紧密相关,也是代谢综合征的危险因素[3-5]。而动脉粥样硬化是一种渐进性疾病,受累动脉病变从内膜开始,一般先有脂质和复合糖类积聚、出血及血栓形成,进而纤维组织增生及钙质沉着,并有动脉中层的逐渐蜕变和钙化。动脉粥样硬化的形成机制目前尚未清楚,主要有脂质浸润说、血小板聚集说、平滑肌细胞克隆说、损伤反应说、铁假说等[6-7]。在一项纳入了1 178例绝经后女性的研究中发现,血清SF水平与CAS密切相关,SF水平增高是CAS的危险因素[8]。Xu等[9]发现亚洲女性的SF水平升高与IMT和颈动脉斑块独立相关。张云红等[10]发现在老年高血压患者中,CAS的发生与SF水平呈正相关。本研究中CAS组患者SF水平显著高于NCAS组,推测血清SF水平上升可能与T2DM患者颈动脉粥样硬化的发生相关。有研究认为,铁通过氧化应激作用使脂蛋白氧化修饰,进而导致动脉粥样硬化[11]。铁沉积和铁诱导的氧化应激可能导致胰岛β细胞凋亡,导致胰岛素合成和分泌减少,引起血糖升高[12]。HbA1c、CRP水平升高,增加机体氧化应激,产生炎症介质,激活血管内皮生长因子(VEGF),释放自由基,引起血管组织损伤,从而发生外周血管粥样硬化[13-14]。有研究显示,血清SF能够激活血小板,促进血小板聚集,从而促进AS的发生发展[15]。进一步相关性分析显示,T2DM患者血清SF水平与FPG、UA、肌酐、TG呈正相关,与HDL-C呈负相关。Yu等[16]的研究发现高铁蛋白组患者的TG、TC、LDL-C显著升高。有研究提示铁储备过高可以影响胰岛素的合成和分泌引起糖代谢紊乱,从而影响患者的脂质代谢,导致TG、TC升高,HDL-C下降[17]。当降低膳食铁摄入,可降低患者胰岛素抵抗,使胰岛素敏感性增加[18]。提示T2DM患者血清SF水平升高可能通过糖脂代谢紊乱加速动脉硬化的发生发展。可能的机制是短期血糖水平升高可能会使动脉管壁中过氧化物增多,诱导铁代谢失调,加重体内氧化应激碎片及增加脂质过氧化。
Logistic回归分析显示,年龄、铁蛋白是T2DM合并CAS的独立危险因素。其可能的机制为:①铁通过产生ROS反应促进LDL过氧化[19],氧化应激的增加会降低一氧化氮的生物利用度从而诱导内皮功能障碍,进而增加血小板活性和白细胞黏附性,加速动脉硬化的形成[20]。②ROS增加了内皮细胞上LOX-1受体的表达,导致线粒体DNA损伤和自噬激活,加重炎症反应从而加速动脉硬化[21]。③脂肪细胞中沉积的铁可能增加脂解作用,并减少胰岛素刺激的葡萄糖转运,引起了脂肪细胞的胰岛素抵抗[22],后者通过促进炎症加速动脉粥样硬化[23]。④巨噬细胞铁代谢轴Hepcidin-Fpn1轴可能从炎症、感染、斑块内出血等方面影响动脉硬化的发生发展[24]。
4 结论
本文建立了T2DM患者合并CAS与铁代谢的关系,可为体内铁超负荷的T2DM患者提供早期干预与治疗的方向。但本文作为一项横断面研究不能推断出两者的因果关系,且其相关病因及机制较为复杂,因此,我们需要开展更多的临床试验和基础研究来进一步探究。

