炎症因子对肥胖大鼠肝脏组织胰岛素信号通路的影响研究
范向宁 刘 柯 朱久育 王 磊 赵清娟 刘 刚 黄艳丽




[关键词]炎症;肥胖;肝脏;胰岛素;胰岛素抵抗;大鼠
[中图分类号]R365.4 [文献标志码]A [文章编号]1008-6455(2021)12-0102-03
Effects of Inflammatory Factors on Insulin Signal Pathway in Liver Tissue
of Obese Rats
FAN Xiang-ning,LIU Ke,ZHU Jiu-yu,WANG Lei,ZHAO Qing-juan,LIU Gang,HUANG Yan-li
(Department of Stomatology,the Third Affiliated Hospital of Xinxiang Medical College,Xinxiang 453000,Henan,China)
Abstract: Objective The aim of this study was to study the effect of obesity on IR associated with signal pathways in liver. Methods Ten male SD rats were randomly divided in 2 groups: control group (Con) (fed with standard diet); high-fat diet group (HFD) (fed with high fat diet). The animal model was characterized in terms of body weight (BW) and Lee index. The mRNA levels of tumor necrosis factors ɑ (TNF-ɑ), interleukin-1beta (IL-1β), Toll-like receptor 2 (TLR2) and Toll-like receptor 4 (TLR4), insulin receptor, phosphatidylinositol 3-kinase (PI3K), protein kinase B (AKT) and glucose transporter type 4 (GLUT4) were measured by quantitative real-time polymerase chain reaction (RT-PCR). Results Compared with the control group, the TNF-α gene level in the liver tissue of the experimental group was significantly increased, and the difference was statistically significant (P<0.05). At the same time, the mRNA levels of IL-1β and TLR4 were significantly decreased (P<0.05). Compared with the control group, the expression of IR, PI3K, AKT and GLUT4 genes in the liver tissue of the experimental group was significantly reduced (P<0.05). Conclusions In obese rats, the insulin signal pathway was inhibited in liver tissue, which is associated with the onset or development of IR.
Key words: inflammation; obesity; liver; insulin; insulin resistance; rat
近年來,肥胖及肥胖相关的内分泌失调性疾病已经成为全球性问题[1]。肥胖可以导致免疫细胞浸入脂肪组织并分泌促炎因子,如肿瘤坏死因子-ɑ(Tumor necrosis factor-α,TNF-α)和白细胞介素(Interleukin,IL)[2]等,促进慢性炎症的发生发展。研究表明,TNF-ɑ可以损害胰岛素信号通路,在脂肪细胞和外周组织中诱导胰岛素抵抗,从而导致2型糖尿病的发生[3]。Toll样受体(Toll-like receptors,TLRs)是检测微生物成分和激活免疫反应的模式识别受体。Toll样受体2(Toll-like receptor2,TLR2)和Toll样受体4(Toll-like receptor4,TLR4)位于细胞膜表面,在免疫炎症和代谢性疾病的相互作用中发挥重要作用[4]。TLRs在炎症和胰岛素抵抗的发展中发挥重要作用[5]。本研究是探究炎症因子对肥胖大鼠肝脏组织的胰岛素信号通路的影响研究。
1 资料和方法
1.1 实验动物来源:PF级SD大鼠,雄性,8周龄,购自河南省动物实验中心(SCXK2007-0001),常规饲养于新乡医学院动物房,自由饮水和进食,饲养温度为20℃~24℃,昼夜节律同自然。
1.2 实验分组:适应性喂养1周后,将实验动物随机分为两组,对照组喂养标准饲料,实验组喂养高脂饲料,一共喂养9周,然后进行各相关指标检测。需要注意的是,每周都需要对大鼠进行体重(Body weight,BW)、体长(naso-anal length,NAL)测量。利用公式计算出Lee指数[6]。
1.3 ELISA检测:所有大鼠禁食过夜,4%水合氯醛腹腔注射使动物全麻,通过心脏穿刺的方法收集血样,使用鼠胰岛素试剂盒量化空腹胰岛素水平。血糖测量仪检测葡萄糖水平。用HOMA指数评价大鼠的胰岛素敏感性。公式如下:[HOMA-IR]=空腹血清葡萄糖(mg/dl×空腹血清胰岛素(μU/ml)/22.5。
1.4 相关基因的RT-PCR检测:Trizol提取组织总mRNA,参照First Strand cDNA Synthesis kit合成试剂盒说明书反转录合成cDNA模板(Thermo Fisher Scientific,Waltham,MA,USA)。RT-PCR所用引物由上海生物工程有限公司设计合成,引物序列见表1。反应条件:95℃5s,60℃30s,40个循环;溶解曲线为95℃15s,60℃1min,95℃15s。
1.5 统计学分析:所有样本的数量在3~5个,数值为(x¯±s),使用Graph Pad Primer 7.0软件来进行统计分析,数据分析使用t检验。当P<0.05时,认為差异有统计学意义。
2 结果
2.1 各组大鼠的体重及Lee指数:饲料喂养9周后,与对照组大鼠相比,实验组大鼠的体重及Lee指数明显升高,差异有统计学意义(P<0.05)。见表2。
2.2 空腹血糖、空腹胰岛素水平及HOMA-IR:禁食过夜后,血清检测结果显示:实验组大鼠的空腹血糖水平与对照组大鼠比较,差异无统计学意义(P>0.05);空腹胰岛素水平和HOMA-IR在实验组大鼠中的表达较对照组大鼠的表达水平明显升高,差异有统计学意义(P<0.05)。见表3。
2.3 肝脏组织中炎症因子的表达:为了检测大鼠肝组织的炎症反应,本实验检测了TNF-ɑ、IL-1β、TLR2、TLR4的mRNA水平的表达。与对照组相比,实验组大鼠肝脏组织中TNF-ɑ的mRNA水平显著升高(P=0.0047),差异有统计学意义(P<0.05)。同时,与对照组相比,IL-1β(P=0.0013)和TLR4(P=0.0161)的mRNA水平分别显著降低,差异有统计学意义(P<0.05)。见图1。
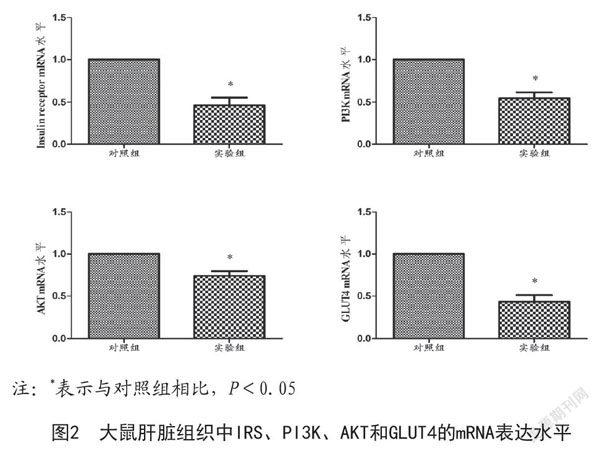
2.4 肝脏组织中胰岛素信号通路的表达:胰岛素信号通路先前已有描述[12]。胰岛素可以通过胰岛素受体(Insulin receptor,IR)依次激活胰岛素受体底物(Insulin receptor substrate,IRS)、磷脂酰肌醇3激酶(Phosphatidyl inositol kinase 3,PI3K)、蛋白激酶B(AKT)和葡萄糖转运蛋白4(Glucose transporters 4,GLUT4),导致GLUT4定位于细胞膜。肝脏在维持血糖水平及身体功能方面起着重要作用。PCR结果显示,与对照组相比,IR(P=0.0003)、PI3K(P=0.0061)、AKT(P=0.0004)和GLUT4(P=0.0033)基因表达分别显著降低,差异均有统计学意义(P<0.05)。见图2。
3 讨论
肥胖被不仅被认为是脂肪肝的危险因素,同时与2型糖尿病也具有一定相关性。脂肪的大量堆积可以引起脂肪组织和肝脏组织的代谢异常,从而引起脂肪和肝脏的胰岛素抵抗[7]。本实验采用高脂饲料喂养的方法,来构建肥胖并伴有胰岛素抵抗的大鼠模型。高脂饲料喂养大鼠9周之后,根据实验所得Lee指数和禁食过夜后大鼠的空腹血糖、空腹胰岛素及HOMA-IR水平的相关数据可知,本研究成功构建了肥胖伴有胰岛素抵抗大鼠模型。
TNF-α是一种由脂肪细胞和炎症细胞分泌的细胞因子,与肥胖和2型糖尿病的发生相关。近期一项临床研究表明,肥胖伴2型糖尿病患者的血清中TNF-α水平明显升高[8]。本实验发现,肥胖大鼠的肝脏组织中TNF-α的基因水平明显升高。因此,我们推测肥胖可能通过上调肝脏组织中TNF-α分泌,从而影响肝脏代谢功能。
GLUT4是一种胰岛素调节的葡萄糖转运蛋白,通常在低胰岛素条件下发现于脂肪和肌肉细胞中。然而,高水平的胰岛素可以诱导胞内小泡的GLUT4向质膜移位,增加细胞摄取更多葡萄糖[9]。PI3K在胰岛素诱导的葡萄糖摄取中起重要作用。大量研究表明,PI3K/AKT信号通路是正常代谢所必需的,并且其不平衡导致肥胖和2型糖尿病的发生[10]。PI3K由IRS上调,胰岛素受体底物结合并激活其下游效应因子AKT,导致GLUT4转运至细胞膜。GLUT4在胰岛素诱导的肌肉和脂肪组织葡萄糖提取中起关键作用。在糖尿病前期和糖尿病中,GLUT4的表达/易位被检测到减少,参与了损害血糖控制的机制[11]。身体各种组织中受损的PI3K/AKT信号通路可以导致肥胖和2型糖尿病,进而引起胰岛素抵抗;反之,胰岛素抵抗可以抑制PI3K/AKT途径,形成恶性循环[12]。PI3K/AKT信号通路与肝脏胰岛素相关,绿色巴西棕榈提取物可以通过调节PI3K/AKT信号通路,进而提高胰岛素敏感度,改善肝脏胰岛素抵抗[13]。本实验发现,高脂喂养大鼠中肝脏组织中胰岛素受体、PI3K、AKT和GLUT4基因表达显著降低。因此,笔者推测:高脂饮食喂养,可以促进肝脏组织中TNF-α的表达,进而抑制PI3K、AKT、GLUT4的表达,从而引发胰岛素抵抗。炎症因子介导的PI3K/AKT信号通路在胰岛素抵抗的发生发展中发挥重要作用,这为胰岛素抵抗的治疗提供了新的治疗思路。
本实验结果显示长期高脂饮食可以通过抑制胰岛素相关信号通路,降低肝脏组织对胰岛素敏感度,从而诱发大鼠胰岛素抵抗。但是关于肝脏组织在胰岛素抵抗中发挥的作用还需要进一步探究。
[参考文献]
[1]Yang Y,Shields GS,Guo C,et al.Executive function performance in obesity and overweight individuals:a meta-analysis and review[J].Neurosci Biobehav Rev,2018,84:225.
[2]Hsieh CC,Wang YF,Lin PY,et al.Seed peptide lunasin ameliorates obesity-induced inflammation and regulates immune responses in C57BL/6J mice fed high-fat diet[J].Food Chem Toxicol,2021,147:111908.
[3]Akash MSH,Rehman K,Liaqat A.Tumor necrosis factor-alpha:role in development of insulin resistance and pathogenesis of Type 2 diabetes mellitus[J].J Cell Biochem.2018,119(1):105-110.
[4]Huang YL,Zeng J,Chen GQ,et al.Periodontitis contributes to adipose tissue inflammation through the NF-<kappa>B,JNK and ERK pathways to promote insulin resistance in a rat model[J].Microbes Infect,2016,18(2):804.
[5]Benomar Y,Taouis M.Molecular mechanisms underlying obesity-induced hypothalamic inflammation and insulin resistance: pivotal role of resistin/TLR4 pathways [J].Front Endocrinol(Lausanne),2019,10(3):140.
[6]Huang YL,Guo WH,Zeng J,et al.Prediabetes enhances periodontal inflammation consistent with activation of TLR mediated NF-кB pathway in rats[J].J Periodontol,2016,87(5):e64.
[7]Yazıcı D,Sezer H.Insulin resistance, obesity and lipotoxicity [J].Adv Exp Med Biol,2017,960(5):277-304.
[8]Alzamil H.Elevated serum TNF-α is related to obesity in Type 2 diabetes mellitus and is associated with glycemic control and insulin resistance[J].J Obes,2020,30(1):5076858.
[9]James DE,Brown R,Navarro J,et al.Insulin-regulatable tissues express a unique insulin-sensitive glucose transport protein[J].Nature,1988, 333(6169):183-185.
[10]Huang X,Liu G,Guo J,et al.The PI3K/AKT pathway in obesity and Type 2 diabetes[J].Int J Biol Sci,2018,14(11):1483-1496.
[11]Esteves JV,Enguita FJ,Machado UF.MicroRNAs-Mediated regulation of skeletal muscle GLUT4 expression and translocation in insulin resistance[J].J Diabetes Res,2017:7267910.
[12]Huang X,Liu G,Guo J,et al.The PI3K/AKT pathway in obesity and type 2 diabetes [J].Int J Biol Sci,2018,14(11):1483.
[13]Mazibuko-Mbeje SE,Dludla PV,Roux C,et al.Aspalathin-enriched green rooibos extract reduces hepatic insulin resistance by modulating PI3K/AKT and AMPK pathways[J].Int J Mol Sci,2019,20(3):E633.
[收稿日期]2020-10-15
本文引用格式:范向寧,刘柯,朱久育,等.炎症因子对肥胖大鼠肝脏组织胰岛素信号通路的影响研究[J].中国美容医学,2021,30(12):102-104.

