2型糖尿病患者血清CD36、同型半胱氨酸与动脉粥样硬化的相关性分析
余潺潺,刘桂胜,刘春蕾
(建德市第一人民医院 检验科,浙江 杭州 311600)
动脉粥样硬化(atherosclerosis,AS)通过动脉中膜增厚、斑块形成,引发血管狭窄或斑块脱落形成血栓,动脉粥样硬化性心血管疾病(Atherosclerotic cardiovascular disease,ASCVD)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者致残及致死的主要原因,严重危害患者生命健康[1]。既往研究发现,通过控制血糖并不能降低T2DM患者ASCVD导致的病死率,因此寻找其他参与AS病理过程的生化指标并尽早进行检测、对其进行干预以改善T2DM患者预后具有重要价值。CD36是一种巨噬细胞表面跨膜糖蛋白,协助修饰型低密度脂蛋白的跨膜转运,在AS的病理过程中发挥重要作用,同型半胱氨酸(Homocysteine,HCY)是AS的独立危险因素之一[2]。本研究探讨CD36、HCY对T2DM患者并发AS的影响,现汇报如下。
1 对象与方法
1.1 研究对象 选取2017年1月—2019年1月于建德市第一人民医院内分泌科就诊的T2DM患者130例,其中颈动脉粥样硬化斑块患者(AS组)58例和未硬化患者(NAS组)72例,AS组患者均符合2009年血管超声指南中对颈动脉粥样硬化诊断标准。纳入标准:①符合1999年WHO糖尿病诊疗指南中对T2DM的诊断标准;②入院后治疗前生化及颈部血管超声资料完整。排除:①近期感染者,合并慢性炎症者;②合并恶性肿瘤及自身免疫性疾病者;③合并其他内分泌性疾病者;④3月内服用维生素B族及叶酸等补充剂者。本研究经我院伦理委员会批准。
1.2 资料收集
1.2.1 一般资料 收集患者年龄、性别、身高、体重、糖尿病病程、血压等临床资料,计算患者体质量指数(BMI)。
1.2.2 生化指标 入组患者于入院次日清晨抽取肘部静脉血5 mL,经3 500 r/min离心5 min后,去上层血清待用。采用德国罗氏诊断有限公司的C701型全自动生化分析仪器分析患者空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、HCY、总胆固醇(total cholesterol,TC)以及甘油三酯(triglyceride,TC)水平。采用R&D公司试剂盒通过酶联免疫吸附法(ELISA)检测患者sCD36水平,检测过程严格按照试剂盒说明书进行。
1.2.3 颈动脉内膜厚度 采用PHILIPS IU22型超声波显像诊断仪,在颈总动脉分叉1.5 mm处测量颈动脉内膜中层最大厚度(Carotid intima media thickness,CIMT),取双侧中较大值记录,AS判定标准为满足以下两条中至少一条:①CIMT≥1.5 mm;②颈动脉内膜中层局限性增厚凸入管腔超过0.5 mm或较周围颈动脉内膜中层增加50%。
1.3 统计学方法 应用SPSS17.0处理数据。计量资料采用t检验,计数资料采用χ2检验,影响因素采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 T2DM患者基线资料对比 2组T2DM患者性别、年龄、病程等一般资料差异无统计学意义(P>0.05),见表1。

表1 患者基线资料对比
2.2 T2DM患者实验室指标对比 AS组T2DM患者HCY及sCD36水平显著高于NAS组,差异有统计学意义(P<0.05)。2组患者FBG、HbAl、TC及TG水平差异无统计学意义(P>0.05)。见表2。

表2 患者FBG、HbAl、TC、TGHCY及sCD36水平对比
自变量βsx-WaldPOR95%CIHCY0.160.0510.010.0021.171.06~1.30sCD360.900.328.000.0052.461.32~4.60常量-3.990.9716.79<0.0010.02
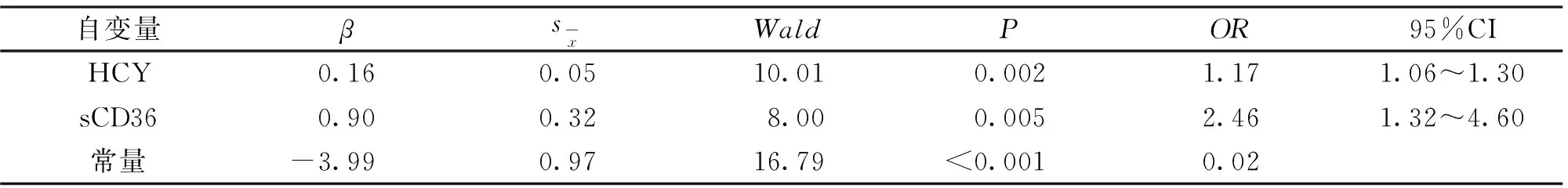
2.3 T2DM患者合并AS的二元logistic回归分析 以T2DM患者是否合并AS作为因变量,将HCY、sCD36作为自变量纳入多因素二元logistic回归分析,结果显示,HCY及sCD36是DM患者发生AS的独立影响因素(P<0.05)。
3 讨论
中心血管疾病是糖尿病患者最常见的并发症和最常见的直接死亡原因[3],对糖尿病患者生活质量及生命健康构成严重威胁。有研究表明,FPG不是糖尿病大血管病变的独立危险因素[4],提示存在血糖以外的其他机制促进糖尿病患者AS的发生发展。故寻找相关指标以发现动脉粥样硬化危险因素并进行干预,对提高糖尿病患者生活质量及延长患者生命具有深远的意义。
CAS可有效反应全身动脉粥样硬化情况[5]。HCY是人体内蛋氨酸及半胱氨酸代谢过程中重要的中间产物,其体内含量与维生素B6、维生素B12及叶酸密切相关[6]。研究表明,DM患者HCY水平与CIMT相关,分析其机制可能为:①DM患者高糖及胰岛素抵抗(IR)状态降低了胃肠道对微生物B6、维生素B12及叶酸等物质的吸收,降低了其他HCY代谢过程中相关酶的活性,导致HCY水平升高。②升高的HCY通过氧化应激等方式增加DM患者高糖对血管内皮的损伤,促进大血管病变的发生[7]。CD36是B类清道夫受体成员,是主要分布于单核细胞、血小板以及血管内皮细胞表面的跨膜糖蛋白,能帮助细胞对氧化型(ox-LDL)、乙酰化型(AcLDL)等修饰后的低密度脂蛋白以及长链脂肪酸的摄取[8]。AS病理中增生、渗出及变质等现象符合炎症病理的表现,并随着AS患者中炎症介质表达改变的发现,AS被认为是一种炎症性疾病[9]。高糖及慢性炎症反应通过活化巨噬细胞上调其表面CD36的表达,增加对ox-LDL等的摄取参与AS病理过程,是AS形成的关键步骤。患者糖基化终产物及糖化LDL作为配体与CD36结合可促进巨噬细胞泡沫化形成泡沫细胞。CD36通过抑制AS斑块中泡沫细胞向血管淋巴结外迁发挥稳定AS的作用,加速AS进程[10]。CD36还可促进凝血、促进单核细胞聚集。sCD36是由凋亡巨噬细胞及AS中分泌、脱落至血液中的CD36胞外区,其血液浓度可间接代表巨噬细胞表面CD36水平。
本研究结果表明,AS组DM患者HCY及sCD36水平显著高于DM无AS者,HCY及sCD36是DM患者发生AS的独立危险因素,与既往研究结果相符。受限于样本量,本文未对斑块等级进行分组详细分析,其水平与AS板块病变程度相关性有待进一步多中心扩大样本量的研究。张文俊等[11]研究发现,T2DM患者HCY水平较健康人群普遍增高,其中不稳定斑块DM患者HCY水平高于稳定斑块与无斑块DM患者,稳定斑块患者HCY水平高于无斑块DM患者。提示HCY与DM患者AS斑块状态相关。
综上所述,血清HCY及sCD36水平在T2DM合并AS患者中表达显著增高,是T2DM患者并发AS的独立危险因素,对于HCY及sCD36水平异常增高的AS高危患者应完善B超等相关检查以明确有无AS发生,并通过早诊断、早干预,减少T2DM患者心血管事件发生,改善患者预后。

