急性心肌梗死合并游离壁破裂和室间隔穿孔的危险因素分析
郑红艳 魏钟海 宋杰 马冬辉
210008 南京大学医学院附属鼓楼医院心内科
急性心肌梗死(acute myocardial infarction,AMI)是在冠状动脉病变的基础上,发生血供急剧减少或中断,使得相应的心肌严重、持久的缺血缺氧,导致心肌坏死。我国AMI发病率仍在逐年升高[1],其最严重的并发症之一为心脏破裂(cardiac rupture,CR),一旦发生,死亡率极高,预后极差[2],已有文献报道CR占院内AMI总死亡人数的4%~20%[3]。CR包括心室游离壁破裂、室间隔穿孔和乳头肌断裂,其中前两者发生率明显高于后者,临床上确诊主要靠超声心动图或心包穿刺。其主要治疗措施为外科修补手术,但仅有少数患者能有机会得到外科手术并好转,很多患者在发生CR后短时间内即死亡。
对于AMI患者,如何早期识别可能发生CR的高危因素,有重要的临床意义[4]。本研究收集了2013年10月至2020年3月我院AMI患者的临床资料,分析了AMI后发生游离壁破裂和室间隔穿孔的患者的临床特征和发生CR的危险因素。
1 对象和方法
1.1 研究对象
回顾性分析我院2013年10月至2020年3月收治的AMI患者,选取28例合并CR的AMI患者为CR组,按照1∶2选择年龄、性别、心肌梗死部位和入院全球急性冠脉事件登记(global registry of acute coronary events,GRACE)评分类似的56例未合并CR的AMI患者为非CR组。AMI的诊断标准符合2017年ESC制定的AMI全球统一标准[5]。入选标准:(1)心脏游离壁破裂:表现为持续电活动但无心排血量及脉搏,超声心动图提示心包积液,或心包穿刺抽出不凝血;(2)室间隔穿孔:胸骨左缘4~5肋间可闻及粗糙的全收缩期杂音,超声心动图提示室间隔连续中断,且心室水平分流。符合以上任一标准即可判定为发生CR。排除标准:(1)非CR引起的大量心包积液;(2)急性创伤;(3)合并基础疾病的终末期患者(已知肿瘤或系统性疾病);(4)严重感染患者。本次研究符合医学伦理学要求,经医院伦理委员会批准通过。
1.2 观察指标
收集患者的性别、年龄、既往病史(陈旧心肌梗死、高血压、糖尿病、高血脂、脑梗死、肾功能不全、痛风)、心肌梗死部位、生化指标、心功能、室壁瘤、血压、心率、入院时GRACE评分、发病至就诊时间、心功能Killip分级、冠状动脉病变支数,以及住院期间的药物治疗,包括硝酸酯、抗栓药、他汀、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)抑制剂和β受体阻滞剂等。
1.3 统计学方法
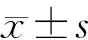
2 结果
2.1 两组的基本资料比较
84例患者中,女性44例(52.4%),平均年龄为(74.32±11.54)岁。CR组共28例,其中女性14例(50.0%),非CR组共56例,其中女性30例(53.6%)。两组既往病史(陈旧心肌梗死、高血压、糖尿病、高血脂、肾功能不全、痛风)均无统计学差异(均为P>0.05),但CR组的既往脑梗死率明显多于非CR组(39.3%比8.3%,P<0.01)(见表1)。
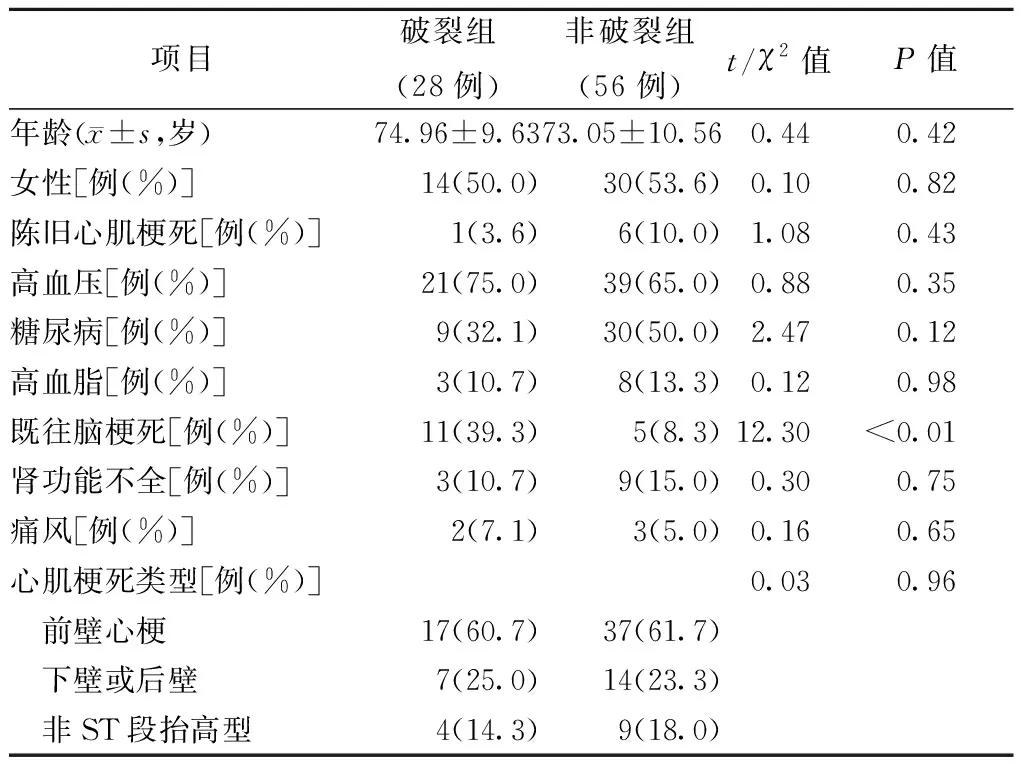
表1 两组的基本资料比较
2.2 两组的临床资料比较
CR组的白细胞计数明显高于非CR组,高密度脂蛋白胆固醇水平低于非CR组,入院时外周收缩压水平低于非CR组,且室壁瘤的比例高于非CR组(35.7%比8.3%),上述差异具有统计学意义(均为P<0.05)。两组在血红蛋白、血小板计数、空腹血糖、血肌酐等方面均无统计学差异(均为P>0.05)(见表2)。
2.3 两组的用药情况比较
两组抗栓药物使用率均为100%,硝酸酯及他汀使用率均无差异。CR组β受体阻滞剂、RAAS抑制剂使用率均明显低于非CR组,差异具有统计学意义(均为P<0.01)(见表2)。
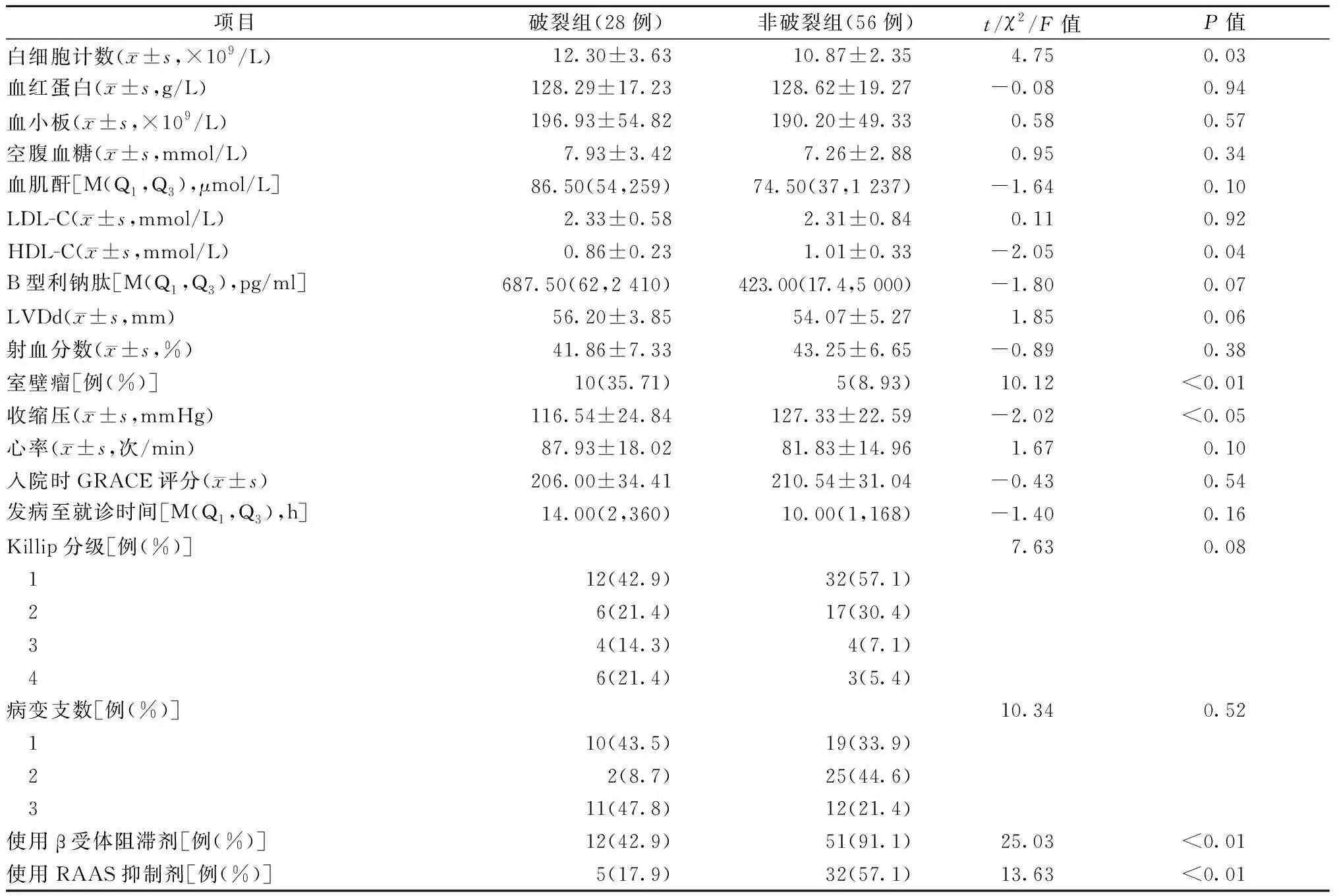
表2 两组的临床资料比较
2.4 两组患者的短期病死率
CR组中游离壁破裂16例,室间隔穿孔11例,游离壁破裂合并室间隔穿孔1例。游离壁破裂仅1例接受外科手术并存活,其余15例均死亡。室间隔穿孔有7例接受外科手术,6例存活,1例术后死亡,其余4例均死亡。游离壁破裂合并室间隔穿孔的1例患者死亡。住院期间,CR组21例死亡(75%),而非CR组无死亡病例。
2.5 Logistic单因素及多因素回归分析
Logistic单因素回归分析提示与CR有关的因素有:女性、年龄、既往脑梗、Killip分级、白细胞计数、室壁瘤、心率、RAAS抑制剂、β受体阻滞剂。女性、高龄、既往脑梗死、Killip 4级、白细胞计数升高(>10×109/L)、合并室壁瘤、心率快(>100次/min)的AMI患者更易发生CR(均为P<0.05),RAAS抑制剂和β受体阻滞剂可降低CR的发生(均为P<0.05)。将上述单因素回归分析有统计学意义的变量纳入多因素回归分析,结果显示,CR的独立危险因素有既往脑梗死和室壁瘤。既往脑梗死患者发生CR的风险是无脑梗死患者的6倍(OR=6.00,95%CI:1.43~25.26,P=0.01),有室壁瘤患者发生CR的风险是无室壁瘤患者的7.45倍(OR=7.45,95%CI:1.75~31.71,P<0.01)。β受体阻滞剂可降低CR的发生,为独立的保护因素(OR=0.07,95%CI:0.02~0.25,P<0.01)。
3 讨论
心脏破裂是AMI患者死亡的主要原因之一,既往有文献报道女性及高龄患者更易发生CR[6]。其原因可能与以下两方面有关:(1)女性心肌较男性薄,且女性更易出现情绪应激等情况;(2)随着年龄增长,女性的雌激素保护作用减弱,血脂代谢受到影响,使得血管内皮功能下降及抗炎作用减弱[7]。而年龄与 AMI患者的预后密切相关[8]。这可能与老年患者心室壁心肌较薄、心肌抗张强度降低和脆性增加有关[9]。随着年龄增长,心肌细胞发生退行性变,纤维结缔组织及脂肪对心肌细胞浸润比例高,心肌顺应性下降,组织纤维再生及修复心肌坏死区域能力差,故更易发生CR[10]。
本研究中既往脑梗死患者发生CR风险明显增高,且经多因素回归分析提示其为发生CR的独立危险因素。心血管疾病与脑血管疾病有共同的危险因素[11],既往脑梗死患者更多的合并高血压、糖尿病、外周血管疾病等,冠状动脉粥样硬化更严重,且脑梗死后患者认知功能可能有所下降,导致就诊延迟[12],使得心肌缺血缺氧时间久、范围大,更容易出现CR。
CR组白细胞计数较非CR组明显增高,提示AMI后CR组患者全身性应激反应更重,炎性细胞可通过氧化应激、释放蛋白酶造成更多的心肌细胞坏死。Hu等[13]研究表明白细胞为CR的独立危险因素,说明炎性细胞在AMI后CR中起关键作用。本研究中亦观察到白细胞计数升高(>10×109/L)发生CR的风险提高3倍。Gao等[14]研究观察到破裂的心脏中有更严重的炎性细胞渗出,炎症因子表达和细胞外基质降解。过多的炎性细胞可分泌蛋白水解酶等损伤心肌细胞及细胞间质内胶原,增加了CR的风险。CR组室壁瘤比例较非CR组明显增多,且为发生CR的独立危险因素。室壁瘤往往发生在前壁心肌梗死且梗死范围较大的患者,心肌梗死后心尖部室壁变薄,供血终末区坏死程度显著,侧支循环少,心肌收缩时对无活动力且僵硬的坏死区产生剪切力,导致其易发生破裂[15]。
Qian等[4]研究显示心率增快为CR的独立预测因子,本研究中,心率>100次/min发生CR的风险是心率<80次/min的5.8倍,说明心率越快,心脏负担越重,越易发生CR。既往有研究表明入院时 Killip 3级或4级是 AMI 后CR的一个独立危险因素[13],本研究亦观察到Killip 4级发生CR的风险为Killip 1级的6倍,这说明Killip 4级的患者心肌梗死面积大,入院时已发生心原性休克,更易发生CR。
在药物使用方面,与非CR组比较,CR组使用β受体阻滞剂、RAAS抑制剂比例较低,单因素回归分析显示β受体阻滞剂、RAAS抑制剂均可降低CR的发生,且β受体阻滞剂的这种作用独立存在。Gong等[16]研究显示,β受体阻滞剂对AMI后梗死愈合有一定的益处。这与β受体阻滞剂能够抑制交感神经兴奋,降低基础心率、增加心室舒张时间,改善心肌灌注有关,因此,若无绝对禁忌证,应当尽早使用β受体阻滞剂。RAAS抑制剂能够降低AMI后CR的风险,其机制与该类药物抑制炎症反应及减少AMI后早期不良心脏重构有关[14]。因此,发生AMI后,在病情允许的情况下,尽早使用上述药物对预防CR有极大的作用。
综上所述,合并CR的AMI患者短期死亡率高,常伴有脑梗死史、白细胞计数升高、室壁瘤和低血压。既往脑梗死和室壁瘤为CR的独立危险因素,而β受体阻滞剂为CR的独立保护因素。然而,本研究为单中心回顾性研究,样本量较小,因CR的确诊缺乏尸检,故存在选择偏倚, 有待进一步深入研究。
利益冲突:无