例析高中化学的离子反应
◇ 云南 符丽群
电解质在溶于水后会发生电离,产生可以自由游动的离子,离子之间发生的相互作用称作离子反应.本文围绕电解质、离子反应的条件和离子反应方程式展开叙述,结合实例探讨离子反应.
1 电解质
电解质是指在熔融状态下或者在水溶液中能够导电的化合物.常见的强电解质包括酸、碱、盐;水属于弱电解质;蔗糖、CH4、CO2、SO2、酒精等都属于非电解质.判断某物质是否是电解质,首先,从物质分类看,物质是否是化合物.若物质不是化合物则不是电解质也不是非电解质.单质、混合物既不是电解质,也不是非电解质.其次,从物质的性质来看,电解质在一定条件下才可以导电.电解质导电的条件是电解质溶于水或者在熔融状态下,二者具备其一即可.有些电解质溶于水导电,但熔融状态不导电,例如HCl气体;而有些电解质只有在熔融状态下才导电,例如BaSO4.有些化合物是否是电解质与溶解性无关,例如蔗糖可以溶于水,但蔗糖属于非电解质,BaSO4、CaCO3属于难溶于水的盐,但BaSO4、CaCO3属于电解质.溶于水能导电的化合物也不一定是电解质,例如CO2溶于水能导电,不是说CO2可以电离出自由游动的离子,而是CO2溶于水,与H2O 反应生成H2CO3,H2CO3可以电离出能自由游动的离子,所以只能说H2CO3是电解质,而CO2本身不属于电解质.
例1NaCl是否为电解质?
分析NaCl属于盐类物质,溶于水,在水分子的作用下,Cl-和Na+会脱离NaCl晶体,进入水溶液中,产生可以自由游动的Cl-和Na+,发生电离,能够导电.NaCl是电解质,电离方程式可以表示为NaCl=Cl-+Na+.
例2HCl和NaOH 是否为电解质? 请写出电离方程式.
分析HCl属于酸类物质,HCl溶液中存在可以自由游动的H+和Cl-,发生电离,能够导电.NaOH属于碱类物质,溶于水,在水分子的作用下,OH-和Na+会脱离NaOH 晶体,进入水溶液中,产生可以自由游动的OH-和Na+,发生电离,能够导电.HCl是电解质,电离方程式可以表示为HCl=H++Cl-.NaOH 是电解质,电离方程式可以表示为NaOH=OH-+Na+.
有些学生会问;金属可以导电,那金属属于电解质吗? 答案是不属于.因为只有化合物才有可能是电解质,金属为单质,不是化合物,所以不可能是电解质.要注意区分电解质溶液和金属导电之间的区别,充分理解并掌握电解质的定义,只有在完全满足电解质定义的情况下才能判断该物质属于电解质,缺一不可.
2 离子反应的条件
酸、碱、盐的水溶液中发生的反应,实质上是两种电解质在水溶液中相互交换离子的反应.产生这类离子反应的条件有:生成沉淀、放出气体、生成水.只要具备以上三个条件中的一个,离子反应就会发生,举例如下.
(1)向盛有1mL1mol·L-1HCl溶液的试管中,加入1mL1mol·L-1NaOH 溶液,振荡,混合均匀,虽然肉眼观察不到明显的变化,但实际上,HCl电离出来的H+与NaOH 电离出来的OH-结合生成水,发生了离子反应.
(2)向盛有1 mL1 mol·L-1Na2SO4溶液的试管中,加入1mL1mol·L-1BaCl2溶液,振荡,混合均匀,发现有白色沉淀生成,这是由于Na2SO4电离出来的与BaCl2电离出来的Ba2+结合生成BaSO4白色沉淀,发生了离子反应.
(3)向盛有2mL1mol·L-1HCl溶液的试管中,加入1mL1mol·L-1Na2CO3溶液,振荡,混合均匀,发现有气泡产生,这是由于Na2CO3电离出来的与HCl电离出来的H+结合生成CO2气体,发生了离子反应.
以上实验的离子反应方程式可以表示为

根据离子反应的条件可以确定几种离子在同一溶液中是否可以共存.多种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应,若离子之间能发生反应,则不能大量共存.
例3在水溶液中不能大量共存的一组离子是( ).
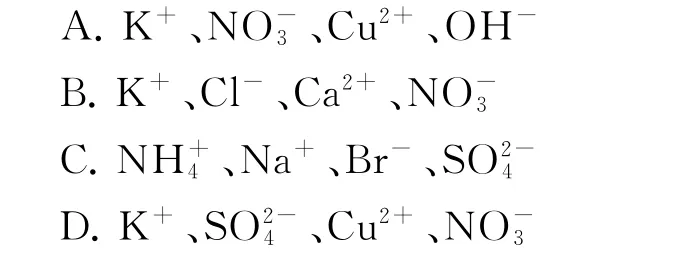
分析选项A 中Cu2+和OH-发生反应,生成难溶于水的Cu(OH)2沉淀,所以不能大量共存,选项B、C、D 中的离子在同一水溶液中都不会发生反应.答案为A.
3 离子反应方程式的书写
离子反应方程式是指用实际参加反应的离子符号来表示反应的式子,书写步骤主要包括4步:
1)写出反应的化学方程式.
2)把溶于水、容易电离的物质写成离子的形式,把难溶于水的物质、气体、弱电解质用化学式表示,沉淀物质用↓标出,气体物质用↑标出.
3)删去等号两边不参与反应的离子.
4)检查等号两边的原子个数和电荷总数是否相等.
例4下列反应离子方程式正确的是( ).

分析选项B 中虽然电荷守恒,但MgSO4在溶液中以和Mg2+形式存在,写离子方程式时要拆开;选项C中H2少了气体符号“↑”;选项D 电荷守恒但加入少量氢氧化钡,由于量少所以氢氧根离子都要参加反应,离子方程式为

答案为A.
常见的化学反应都是在水溶液中进行的,参加反应的物质大多都是酸、碱、盐,在日常生活和学习中,我们经常可以接触到这些反应.通过对离子反应的学习,有助于我们更好地学习和掌握混合物的分离、物质的提纯等知识点.在日常生活中,帮助我们科学有效地清除水中的污染物、热水器中的水垢等,使我们的生活更加便利.

