产维生素K2贝莱斯芽孢杆菌ND的诱变育种及突变子快速筛选
赵长乐,汤贵祥,万银平,黄晓梅,张慧莉
(石河子大学 生命科学学院,新疆维吾尔自治区 石河子市 832000)
维生素K2(VK2)由一个萘醌核和一条聚异戊二烯侧链组成,是一种脂溶性黄色结晶化合物,由Doisy等[1]从腐败鱼肉中首次发现.Bhalerao等[2]研究发现VK2可以用来治疗帕金森综合征等线粒体疾病.陈雪英等[3]证明VK2在绝经后大鼠的血管钙化过程中有重要作用.王冠等[4]发现VK2对绝经后骨质疏松患者疗效显著,且与甲状腺激素联合使用效果更佳.
VK2可通过化学合成[5]和微生物发酵获得.发酵法生产VK2的菌种多为黄杆菌、纳豆芽孢杆菌、解淀粉芽孢杆菌、枯草芽孢杆菌等[6-8].培养基和培养条件的优化[9]、诱变育种是比较常用的提高菌种产量的手段,黎恒等[10]利用紫外和等离子诱变,获得一株N-乙酰-D-氨基葡萄糖提高4.1倍的解淀粉芽孢杆菌突变子.褚清龙[11]对解淀粉芽孢杆菌的原生质体进行紫外诱变,获得一株酸性α-淀粉酶的活力由105U/mL提高到267U/mL的突变子.
20世纪60年代,原生质体融合技术开始兴起,使两亲本的基因组进行发生重组并最终获得具有双亲优良性状的融合子.相较于传统的育种方法,原生质体融合技术的重组率更高、受两亲本结合的限制小,能够打破种间远缘杂交不亲和的障碍问题,完全无需了解两亲本菌株作用机制和遗传物质[12-13],因此是一种理想的用于改良菌种生产能力的方法.
贝莱斯芽孢杆菌ND(BacillusvelezensisND)是本实验室自纳豆粉中筛选得到可以生产VK2(MK-7)的野生型菌株,该菌株在装有2mL发酵培养基的试管中静态发酵7d,VK2产量为27.57mg/L,在3L发酵罐中连续发酵7d,VK2产量达71.72mg/L,同发酵模式下产量居世界前列仅次于澳大利亚学者Berenjian团队[14]在极限搅拌和通气状态下的226mg/L.本研究对贝莱斯芽孢杆菌ND利用多种诱变手段进行诱变,以求获得VK2产量进一步提高的优质工业菌种,同时对贝莱斯芽孢杆菌ND进行原生质体制备和融合的研究为后续基因组改组提供数据支持.由于VK2的含量普遍使用高效液相色谱法(HPLC)来检测[15-16],虽然测定的VK2含量精度高,但是通量低、耗时长、成本高不利于快速筛选突变子,为了克服上述弊端,本实验构建了用于快速筛选VK2突变子的检测体系.
1 材料与方法
1.1 菌株和培养基
菌株:BacillusvelezensisND(GenBank:MN831888).该菌株是本实验筛选的一株可以生产VK2(MK-7)的野生菌株,能在含有较高浓度甲萘醌的培养基中生长,革兰氏染色和菌落形态、培养特性均与枯草芽孢杆菌相似.
种子培养基:牛肉膏5g/L、蛋白胨10g/L、葡萄糖10g/L、NaCl 5g/L.
发酵培养基:酵母浸粉18g/L、大豆蛋白胨17g/L、甘油8g/L,K2HPO43g/L,CaCl22g/L,NaCl 80g/L.
筛选培养基:谷氨酸钠0.1g/L、KH2PO46g/L、K2HPO4·3H2O 14g/L、柠檬酸钠1g/L、MgSO4·7H2O 0.2g/L、(NH4)2SO42g/L、葡萄糖0.5g/L.
高渗缓冲液(SMM):蔗糖0.5mol/L,MgCl2·6H2O 0.02mol/L,顺丁烯二酸0.02mol/L调节pH至6.5,115℃灭菌20min.
溶菌酶溶液:用SMM配置浓度为100mg/mL,0.22μm一次性滤膜过滤除菌.
40% PEG-6000溶液:使用高渗缓冲液配制,0.22μm一次性滤膜过滤除菌.
再生培养基:使用SMM缓冲液代替蒸馏水的种子培养基,115℃灭菌20min.
1.2 方法
1.2.1 菌株的发酵实验
静态发酵:接种单菌落于种子培养基培养至对数生长期,以10%(体积分数)接种于装有2mL发酵培养基的试管中,于37℃恒温培养箱中连续培养7d.
发酵罐发酵:将生长至对数期菌液,以10%(体积分数)接种于装有1L发酵培养基的发酵罐中连续培养7d,发酵温度为37℃,转速为500r/min,通气量为120L/h.
1.2.2 VK2检测方法的建立
安捷伦1100高效液相色谱分析仪对VK2精确测定,色谱柱为COSMOSIL 5C18-MS-Ⅱ(4.6ID×250mm),参考尉鸿飞[6]利用HPLC检测黄杆菌中VK2的方法.
VK2标准品用异丙醇溶解稀释为16,32,64,100mg/L,吸取200μL于96孔板中以异丙醇作对照,均3个样品重复,用酶标仪(Molecular Devices,SpectraMax M2)检测其在248nm下吸光度.
1.2.3 诱变菌株的筛选方法
甲萘醌是VK2的结构类似物,对VK2的合成有抑制作用,研究证明,甲萘醌可协助筛选高产的突变菌株[17],通过早期实验的优化,在筛选培养基中添加55mg/L甲萘醌,该剂量下致死率为90%左右,既保证了菌落的数量,又具备一定的筛选压力.
挑取单菌落于装有种子培养基的96孔深孔细胞板中培养至对数生长期,以10%接种量接种于装有2mL发酵培养基的试管中进行静态发酵7d,发酵结束后使用汤贵祥等[18]的方法提取VK2,由于HPLC检测VK2精确度高但通量太低,无法短时间内对大批量诱变菌株的VK2产量进行检测,先将VK2提取液使用酶标仪通过分光光度法测定,再将产量高的进行HPLC测定,构建了一种可快速筛选高产VK2突变菌株的方法.
1.2.4 原生质体的制备及再生
原生质体制备率及再生率公式:制备率=(A-B)/A×100%;再生率=(C-B)/(A-B)×100%.
设A:酶解前的菌悬液于种子培养基固体平板生长的菌落数,B:酶解后的菌悬液于种子培养基固体平板生长的菌落数,C:酶解后的菌悬液于再生培养基固体平板生长的菌落数.
菌悬液制备:取对数期菌液离心并用无菌水洗涤2次,菌泥用SMM缓冲液进行悬浮.
最佳溶菌酶浓度的选择:加溶菌酶至菌悬液中于37℃水浴锅中反应30min.为探究制备体系中酶浓度对原生质体制备和再生的影响,溶菌酶终浓度分别为0.01,0.03,0.05,0.10,0.20mg/mL.
最佳酶解温度的选择:加入溶菌酶于菌悬液中至终浓度为0.1mg/mL,于水浴锅中反应20min.为探究温度对原生质体制备和再生的影响,酶解温度分别为27,32,37,42,47℃.
最佳酶解时间的选择:加入溶菌酶于菌悬液中至终浓度为0.1mg/mL,于32℃水浴锅中进行反应.为探究酶解时间对原生质体制备和再生的影响,酶解时间分别为10,20,30,40,50min.
1.2.5 原生质体灭活
灭活率计算公式:灭活率=(灭活前在再生培养基平板上生长的菌落数-灭活后在再生培养基平板上生长的菌落数)/灭活前在再生培养基平板上生长的菌落数×100%.
灭活就是采用某些物理或者化学的手段对原生质体悬液进行处理,使其失去活性,但不致死.一般经过灭活处理后,因原生质体内部的部分结构损伤,原生质体会丧失自我修复的能力[19].本次实验采用热灭活和紫外灭活,一方面,几乎能够省去部分或全部的标记工作减少工作量;另一方面,可以排除双方亲本类型的再生,便于选择需要的融合子,因而这项技术在微生物育种中已被广泛使用[20].
原生质体的热灭活:制备好的原生质体转移于1.5mL的EP管中,置于60℃恒温水浴锅中进行处理.为探究处理时间对原生质体的灭活效果,处理时间设置为2,4,6,8,10min,根据10倍稀释法稀释至合适浓度后涂布于再生培养基平板.
原生质体的紫外灭活:将制备好的原生质体置于紫外灯下30cm处进行处理.为探究紫外照射时间对原生质体的灭活效果,照射时间设置为20,30,40,50,60,70s,根据10倍稀释法稀释至合适浓度后涂布于再生培养基平板.
1.2.6 原生质体融合
融合频率=融合后再生培养基平板上生长的菌落数/灭活前双亲原生质体总数×100%.
分别取等量的,紫外灭活、热灭活后的原生质体悬液于1.5mL EP管中混合均匀,37℃,200r/min震荡5min,后4000r/min离心5min收集菌体,立即加入1mL 40% PEG-6000来悬浮菌泥,置于37℃中,融合完成后3000r/min离心洗涤2次,最后稀释涂布于再生培养基平板.为探究原生质体最佳融合时间,融合时间分别为2,4,6,8,10min.
1.2.7 贝莱斯芽孢杆菌ND的单因素诱变
菌悬液的制备:取对数期菌液6000r/min离心5min,再用无菌水离心洗涤2次.
紫外诱变:菌悬液于7cm的平皿中搅拌状态下照射30s,并于黑暗中冰浴1h以抑制光修复酶的活性,根据10倍稀释法稀释至合适浓度,并涂布于筛选培养基,37℃培养.为探究诱变距离对贝莱斯芽孢杆菌ND的诱变效应,诱变距离设置为10,20,30,40,50cm.
NTG诱变:先用适量丙酮将NTG溶解,然后加入9倍体积的0.1mol/L的PBS缓冲液(pH=6),配置成1mg/mL的母液备用,菌悬液使用0.1mol/L的PBS缓冲液(pH=6)制备.菌悬液中加入NTG母液致终浓度为100μg/mL,于37℃,200r/min下分别处理2,8,14,20,26min,诱变结束后用生理盐水洗涤2次以终止反应.
EMS诱变:菌悬液使用0.1mol/L的PBS缓冲液(pH=6)制备,取EMS原液于菌悬液至终浓度0.15mol/L,37℃,200r/min下分别处理15,30,45,60,75,90min,诱变结束后用生理盐水洗涤2次以终止反应.
DES诱变:菌悬液使用0.1mol/L的PBS缓冲液(pH=7.2)制备.取DES原液加2倍体积的乙醇助溶,最后加入菌悬液中至终浓度为2%,37℃,200r/min下分别处理5,10,15,20,25,30min,诱变结束后用生理盐水洗涤2次以终止反应.
ARTP诱变:取10μL菌悬液于载片上,涂匀后转移至操作箱进行诱变,工作条件为:10SLM,120W,分别处理20,50,80,110,140s.诱变结束后将载片转移至装有1mL无菌水的EP管中振荡1min彻底洗脱载片上的菌体,根据10倍稀释法稀释至合适浓度涂布于筛选培养基平板.
1.2.8 贝莱斯芽孢杆菌ND的复合诱变
诱变剂的复合处理常有一定的协同效应,增强诱变效果,其突变率普遍比单独处理的高[21].EMS-紫外复合诱变:菌悬液在紫外灯下50cm处照射30s,离心并用0.1mol/L的PBS缓冲液(pH=6)进行悬浮,加EMS至终浓度为0.15mol/L,处理45min,诱变结束后用生理盐水洗涤2次以终止反应.
LiCl-紫外复合诱变:菌悬液于紫外灯下50cm处照射30s,诱变后菌悬液涂布于含有1%,1.5%,2%,2.5%,3%(质量分数)LiCl的筛选培养基平板上.
2 结果与讨论
2.1 菌株的发酵结果
贝莱斯芽孢杆菌野生型菌株ND在3L发酵罐中的连续发酵如图1所示,随着发酵的进行发酵液中的甘油逐渐被消耗,菌体在80h前急剧增殖,80h后发酵液中菌体数量逐渐稳定,VK2的含量(HPLC测定)始终处于增长状态,连续发酵168h后发酵液中VK2产量达到71.72mg/L.
2.2 VK2浓度高通量检测方法与HPLC方法评定
如图2(a)所示,5个浓度梯度的VK2标准品和发酵液提取液的HPLC检测曲线,将峰面积对VK2浓度进行拟合,得到标准曲线为y=33.784x,R2=0.9979可信度较高,且发酵提取的样品经过HPLC纯化后特征峰清晰无杂峰,可用于准确测定VK2浓度.
如图2(b)所示,以VK2浓度为横坐标,标准品溶液在248nm下吸光度为纵坐标拟合的标准曲线方程为y=0.02309+7.25097×10-4x,R2=0.99824,由此我们判定分光光度法检测VK2的含量是可行的.提取诱变菌株发酵液中的VK2,分别用HPLC和分光光度法对提取液中的VK2含量进行检测,如图2(c)所示,两种检测方法的测定结果一致性较低,可能发酵液提取物中的杂质干扰了VK2含量检测的准确性;当VK2含量高于30mg/L时,特征吸收波长下的吸收值变大,相对的降低了杂质吸收的干扰,两种测定方法的结果存在很好的相关性(y=27.27405+3.78559x,R2=0.99301)(图2(d)).表1列出了经过随机诱变获得的部分菌株发酵提取液中的VK2含量经HPLC和分光光度法测定的结果.每个样品做4次重复,可以看出VK2含量经分光光度法测定的重复性较好.综合上述实验结果,我们发现虽然分光光度法不能用于对发酵液提取液中的VK2浓度进行定量检测,但是其检测结果与HPLC检测结果的线性关系可以用来辅助筛选高产突变菌株.
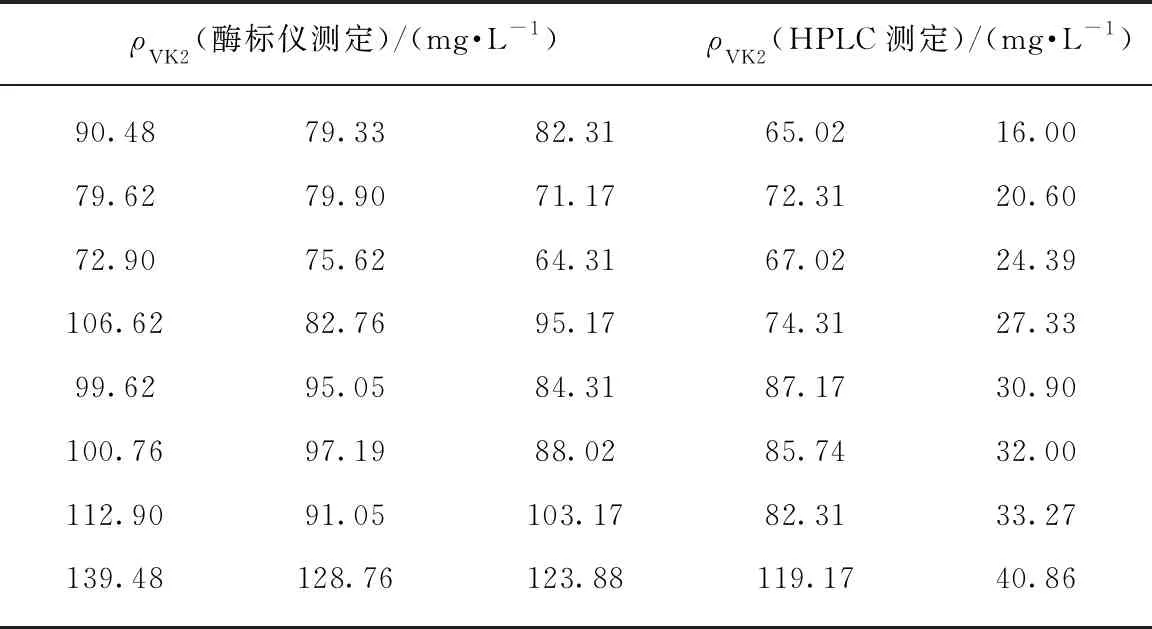
表1 酶标仪检测与液相色谱测定发酵液中维生素K2含量Tab.1 Detection of Vitamins K2 in fermentation broth by microplate reader and liquid chromatography
2.3 贝莱斯芽孢杆菌ND原生质体的制备与再生
2.3.1 溶菌酶浓度对原生质体制备与再生的影响
结果如图3(a)所示,随着酶浓度的增大,贝莱斯芽孢杆菌ND原生质体的制备率逐渐增大,而再生率则逐渐降低,大溶菌酶浓度超过0.1mg/L时再生率骤降,过高的酶浓度不利于原生质体的再生[22].综合考虑原生质体再生率和制备率,选择溶菌酶0.1mg/mL为原生质体最佳制备浓度,此时再生率为8.2%,制备率为94.5%.
2.3.2 酶解温度对原生质体制备的影响
如图3(b)所示,随着处理温度的升高,贝莱斯芽孢杆菌ND原生质体的制备率逐渐增加,而原生质体的再生率随温度先增加后减少,32℃时原生质体的再生率最高,有研究表明随着温度的提高,酶解速度加快,与此同时酶也因温度升高逐渐变性从而失活,酶反应的最适温度是这两种效应的共同结果[23].因此,综合考虑确定酶解的最适温度为32℃,此时原生质体再生率为17.5%,制备率为81%.
2.3.3 酶解时间原生质体制备的影响
结果如图3(c)所示,随着酶解时间的增加,贝莱斯芽孢杆菌ND原生质体的制备率逐渐增加,而再生率逐渐降低,而再生率先增高后降低,20min时其再生率最高,而后随着处理时间的增加再生率逐渐下降至0.1%.一般认为酶解时间大概在20~40min之间为宜,过长处理时间反而会对原生质体的再生产生不利影响[24],可能是酶解时间过长,细胞壁降解程度增大导致丧失了细胞壁合成所需的引物从而不利形成新的细胞壁.因而20min为贝莱斯芽孢杆菌ND原生质体制备最佳酶解时间,此时再生率为41.2%,制备率为92.5%.
2.4 贝莱斯芽孢杆菌ND原生质体的灭活与融合
热灭活主要是在高温环境中破坏原生质体中的蛋白质结构及活性,结果如图4(a)所示,随着处理时间的增加,灭活率逐渐增加,在6min时灭活率已达到100%.
紫外灭活处理主要作用就是使细菌内部的DNA结构发生变化,使细菌的菌体DNA损伤而失活,如图4(b)所示,随着时间的增加,灭活率急剧增加,处理40s时,灭活率已接近100%.
如图4(c)所示,随着融合时间的增加,原生质体的融合频率先增加,在6min时的融合频率最高,为9.8%,随后融合频率下降,因为PEG对细胞有毒害作用,随着处理时间的延长,对原生质体的损伤程度增加不利于原生质体的再生.
2.5 贝莱斯芽孢杆菌ND诱变条件的确定
2.5.1 紫外诱变剂量的确定
菌液距离紫外灯越近,单位时间内所吸收的辐射量越高.如图5(a)所示,致死率随诱变距离的增大逐渐降低,正突变率随距离的增大增突变率曲线呈“U型”.诱变距离为10cm时致死率为99.99%,正突变率最高,为83.33%,30cm时致死率为78.74%,正突变率最低,为50.00%,50cm致死率为20.12%,正突变率为66.67%.因此在进行单因素诱变时为了尽大可能获得高产突变株,诱变距离选为10cm,综合考虑在进行复合诱变时为兼顾正突变率和足够的存活菌体数量,诱变距离选为50cm.
2.5.2 NTG诱变剂量的确定
如图5(b)所示,在NTG处理在2~14min时间段,致死率由81.46%逐渐增大到98.07%,而后致死率保持较为稳定的水平不再增减,而正突变率则随着处理时间的增加先增高再降低,14min时正突变率最高45%.因此选择对贝莱斯芽孢杆菌ND进行NTG诱变最佳的处理时间为14min.
2.5.3 EMS诱变剂量的确定
图5(c)所示,致死率随EMS处理时间的延长从3.53%逐渐增大到98.96%,正突变率曲线为先降低后升高至最大再持续降低的“马鞍形”,处理时间在45min时正突变率达到最大为95%,此时致死率为77.7%.因此选择对贝莱斯芽孢杆菌ND进行EMS诱变最佳条件为45min.
2.5.4 DES诱变剂量的确定
图5(d)所示,致死率随DES处理时间的延长由43.88%增大到96.08%,而正突变率曲线为先先升高再降低最后继续升高的“马鞍形”,当处理40min时正突变率亦是最大,为70%,致死率此时为99.92%.因此选择对贝莱斯芽孢杆菌ND进行DES诱变最佳条件为40min.
2.5.5 ARTP诱变剂量的确定
图5(e)所示,致死率和正突变率曲线均随着在ARTP处理时间的增加呈现出先快速增高后趋于平稳的趋势,当ARTP处理140s时正突变率达到最高为40%,此时致死率为95%.因此选择对贝莱斯芽孢杆菌ND进行APTP诱变最佳条件为140s.
2.5.6 LiCl-紫外复合诱变剂量的确定
图5(f)所示,随着培养基中LiCl浓度由小逐渐增大,致死率由70.14%逐渐增大到99.05%,而正突变率曲线则随着LiCl浓度的增大先增加后降低,当LiCl浓度为2%时正突变率最大达到100%,此时致死率为85.86%.因此培养基中LiCl最佳添加浓度为2%.
2.5.7 诱变方法的比较
对比贝莱斯芽孢杆菌ND经各种诱变处理的正突变率和单次诱变后VK2提高幅度.如图6所示,菌种经EMS单因素诱变时正突变率最高,为95%,NTG诱变正突变率最低为45%,但NTG诱变的菌株VK2产量提高幅度最高,为35.34%,猜测是贝莱斯芽孢杆菌ND对NTG最为敏感,NTG对其基因组的改变程度最大.另外值得注意的是,复合诱变的诱变效果相较于单因素诱变,突变菌株VK2产量提高幅度均较单因素诱变明显,LiCl-紫外复合诱变的正突变率最高,单次VK2产量提高幅度也达到了较高的水平,可能与LiCl对细菌的修复系统活性的影响有关[25].
2.7 突变菌株的VK2生产能力验证
鉴于微生物对同一种诱变剂连续诱变表现出的“疲劳效应”,本实验依次使用紫外、NTG、EMS、DES、ARTP、LiCl+紫外、EMS+紫外进行诱变,野生型菌株经诱变10次后共得到4株VK2生产能力明显增加的菌株,分别为FU23-7(诱变7轮获得)、A35-9、A99-9(诱变9轮获得)、E3-10(诱变10轮获得),将上述4株菌株和野生菌株ND同时在装有2mL发酵培养基的试管中进行静态发酵,7d后测定菌体干重并提取发酵液中VK2进行HPLC检测.如表2所示,E3-10每升发酵液中细胞干重(DCW)和VK2产量均较野生菌有大幅度额提高,其VK2产量为36.23mg/L,较野生型菌株ND 27.57mg/L提高31.42%.对E3-10进行传代稳定性研究,如图7所示,E3-10连续传代8次后,突变菌株VK2生产能力稳定.
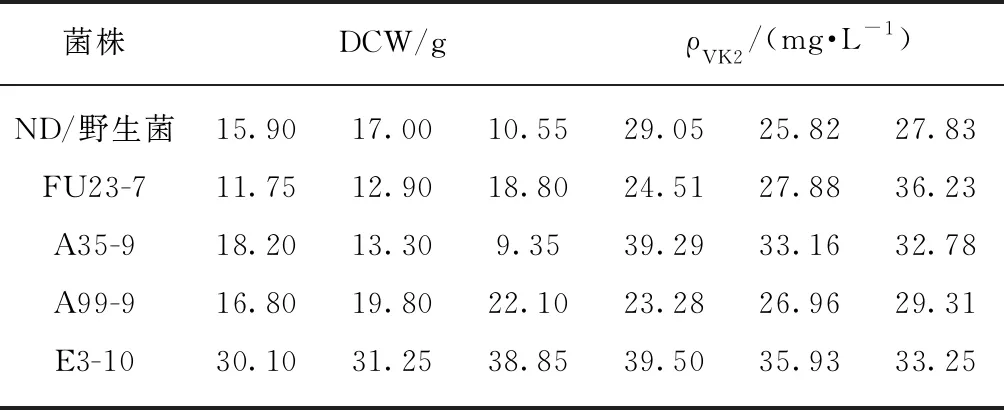
表2 突变菌株的生产能力Tab.2 Production capacity of mutants
3 结 论
对发酵提取液中VK2含量的检测,本研究发现当发酵提取液中VK2含量高于30mg/L时,可以将分光光度法通量高与HPLC检测准确性高的特点想结合,构建一个可以筛选突变菌株的检测方法,大大提高了产VK2菌株诱变育种的工作效率.
由于单一诱变剂连续处理菌株具有“疲劳效应”,并且国内外鲜有对贝莱斯芽孢杆菌诱变的报道,本研究利用常见诱变剂以及新兴ARTP诱变技术,对贝莱斯芽孢杆菌ND进行了紫外、NTG、EMS、DES、ARTP、LiCl+紫外、EMS+紫外诱变,为同行对贝莱斯芽孢杆菌ND进行诱变提供了的数据支持和经验参考,并最终获得一株VK2产量较野生型提高31.42%的能稳定遗传的突变菌株.
对贝莱斯芽孢杆菌ND原生质体制备研究得出,溶菌酶的质量浓度为0.1mg/mL,酶解20min,酶解温度为32℃时原生质体的再生效果较好,制备率也较高.灭活后的原生质体在40% PEG-6000诱导下,于37℃下处理6min融合频率最高,为贝莱斯芽孢杆菌的基因组改组提供了经验参考.

