过表达EPSPS基因提高栽培稻与杂草稻/野生稻杂种后代的木质素含量研究
吴 晋,方 佳,蔡星星,卢宝荣
(复旦大学 生命科学学院 生物多样性与生态工程教育部重点实验室,上海 200438)
莽草酸循环(shikimic acid cycle)广泛存在于所有植物以及多种微生物中,是碳水化合物代谢和次生代谢的重要中转站,并为其他次生代谢的途径提供底物[1-2].莽草酸途径的产物是苯丙氨酸、酪氨酸和色氨酸,而苯丙氨酸和酪氨酸是木质素合成的重要前体物质[3].木质素合成一般由苯丙氨酸和酪氨酸经过一系列合成途径形成木质素单体,再由这些木质素单体聚合而形成成熟的木质素多聚物[4].通常根据不同木质素单体的形成,可以将其分为3种:对羟基苯基木质素(H-木质素),愈创木基木质素(G-木质素)和紫丁香基木质素(S-木质素),而这3种木质素对应来源的3种单体分别是:对香豆醇,松柏醇和芥子醇[5-6](图1).通常在单子叶植物中,G-木质素的含量最高,约占木质素总量的42%~80%[7-8].
木质素是自然界含量较丰富的芳香族高聚物,仅次于纤维素的含量[9-10],主要存在于植物次生结构中,是构成植物细胞壁的主要成分之一,其中以次生组织中导管与管胞等结构的木质素含量最高[11].木质素填充于细胞壁中,大大加强了细胞壁的硬度,使植物细胞获得了一定的机械强度和抗压能力,有利于植物水分的运输及细胞生理和结构的变化[12].因此,木质素有益于植物的生长发育过程,对于支撑植物的躯干、抗病、抗逆等有着不可缺少的作用[13].此外,近年来的研究表明,高含量的植物木质素对于能量转化效率也具有重要作用,因此提高木质素的含量在生物能源的挖掘与利用中具有潜在的重要价值[14].
EPSPS(5-烯醇式丙酮酰莽草酸-3-磷酸合酶)是莽草酸循环途径中第六步的关键酶,当EPSPS的作用受到抑制时,莽草酸途径会中断,从而影响植物的正常生长和发育,最终导致植物死亡,这也是草甘膦除草剂的除草作用机制[15].在前期的研究中,我们发现过量表达EPSPS酶的转基因栽培稻,其EPSPS转基因渐渗到杂草稻和野生稻群体之后,在不施用草甘膦除草剂的环境中,含转基因杂种后代群体的适合度相关性状如光合速率、单株分蘖数、单株穗数、单株种子数等均有显著增加[16-17].因此,过表达EPSPS基因是否会增加转基因植株的总体生物量?是否会导致转基因植物中木质素总含量的增加以及3种不同类型的木质素(H-、G-、S-木质素)含量的比例关系改变?这些都是等待人们去揭示的有意义科学问题.此外,木质素合成途径是由芳香族氨基酸中的苯丙氨酸、酪氨酸经过脱氨基等反应生成肉桂酸、对香豆酸及其羟基和甲羟基衍生物的辅酶A酯等组分,这些辅酶A酯类再经一系列还原反应生成木质素的主要3种单体,并经过糖基化反应后运输到相关部位组织,最后经氧化聚合生成木质素[18].因此,如果转基因植株中的木质素含量有显著增加,过表达EPSPS基因是否会对合成木质素途径中相关代谢产物的基因表达(见图1中有问号的部分)产生影响?这也是有待揭示的科学问题.
研究表明,禾本科植物中的G-木质素的含量最高(42%~80%),在G-木质素合成途径中的关键酶共有8个:苯丙氨酸脱氨酶(PAL)、肉桂酸-4-羟基化酶(C4H)、酪氨酸脱氨酶(TAL)、咖啡酸-5-羟基阿魏酸-O-甲基转移酶(COMT)、4-香豆酸辅酶A连接酶(4CL)、肉桂酰辅酶A还原酶(CCR)、肉桂醇脱氢酶(CAD)和过氧化物酶(POD)(图1).但是,过表达EPSPS基因是否会影响转基因栽培稻×杂草稻和转基因栽培稻×野生稻杂种群体PAL、C4H、TAL、COMT、4CL、CCR、CAD和POD基因的表达水平,以及该通路上的代谢物(如苯丙氨酸,酪氨酸,阿魏酸)含量变化,仍属未知.
因此,本文希望回答以下科学问题:(1) 过表达EPSPS基因是否增加栽培稻×杂草稻/野生稻杂种后代的总体生物量?(2) 过表达EPSPS基因是否提高栽培稻×杂草稻/野生稻杂种后代的木质素含量,特别是G-木质素含量?(3) 过表达EPSPS基因是否会引起杂种后代木质素合成途径中与G-木质素相关的重要代谢产物和基因表达量变化?上述研究的结果,有助于进一步解析莽草酸循环途径对于木质素合成的关键作用,也可以为利用EPSPS基因过表达提高木质素产量、优化生物能源资源的挖掘提供理论依据和策略.
1 材料和方法
1.1 材料
本研究中所选用的材料为通过转基因获得的过表达EPSPS栽培稻(EP3,父本)与杂草稻(母本)的杂交分离F3后代(WE1和WE2)以及EP3与野生稻(母本)杂交分离产生的F3后代(WR1和WR2)(图1,表1).实验材料WE1,WE2,WR1和WR2的获得过程为,转基因栽培稻与杂草稻/野生稻人工杂交后,经自交分离获得F3代转基因阳性(WE1++,WE2++,WR1++和WR2++)与阴性群体(WE1--,WE2--,WR1--和WR2--)(表1,图2,见第668页).

表1 本研究的实验材料与特征描述 Tab.1 Experimental materials and their characters used in this study
1.2 方法
1.2.1 植株生物量测定
生物量是以植株的总干重来衡量的.F3转基因阳性群体(WE1++,WE2++,WR1++和WR2++)和阴性群体(WE1--,WE2--,WR1--和WR2--)中分别随机选出20粒种子,一共160粒种子,萌发30d后,检测所有植株的生物量.植株总干重的检测方法为:收集供试材料全株于105℃下烘1h,然后用60℃烘干至恒重,再称量每株材料的重量.
1.2.2 木质素含量测定
各样品木质素总含量(m总木质素)测定包含3个步骤:(1) 木质素含量占干物质比例(K木质素);(2) 木质素的吸光率(A木质素);(3) 根据(1)和(2)计算各样品木质素总含量.具体步骤如下:
(1) 随机选取转基因栽培稻×杂草稻杂种F3后代(WE1++,WE2++,WE1--和WE2--)及转基因栽培稻×野生稻杂种F3后代(WR1++,WR2++,WR1--和WR2--)30d水培幼苗各5株,取整株幼苗于105℃下烘1h,然后用60℃烘干至恒重,将样品混合磨碎后称量并记下总质量(m1);将烘至恒重的砂芯坩埚称量并记录其质量(m2);将混合样品放入烧杯中,加入足量72% H2SO4后用玻璃棒搅拌,室温静置4h,将混合液移至1000mL三角瓶中,加入蒸馏水765mL在电炉上回流煮沸2h,再用已烘至恒重的坩埚抽滤混合液,然后用200mL热水洗涤滤渣3次,将称有滤渣的坩埚在105℃下烘干至恒重并称量(m3).
重复测定3次,获得平均木质素含量比例:K木质素=(m3-m2)/m1×100%.
(2) 随机选取转基因栽培稻×杂草稻杂种F3后代(WE1++,WE2++,WE1--和WE2--)及转基因栽培稻×野生稻杂种F3后代(WR1++,WR2++,WR1--和WR2--)30d水培幼苗各5株,取整株幼苗于105℃下烘1h,然后用60℃烘干至恒重,称量每株幼苗的质量(m);将上述幼苗材料及m3研磨成粉末后,分别称取粉末0.005g放入20mL试管中,加入25%溴乙酰-乙酸溶液(质量分数)2.5mL和高氯酸0.1mL,将试管口密封;在70℃下恒温水浴30min,每隔10min振荡试管;将反应液移入到装有3mL冰乙酸和1mL 2mol/L NaOH的容量瓶中,混匀后用冰乙酸定容至10mL(V);以冰乙酸作为空白对照,用NanoDrop2000c超微量紫外分光光度计测量溶液在280nm波长处吸光值(OD280,读数大于1时需要用冰乙酸适当稀释).
重复测定3次,获得平均木质素含量吸光率:A总木质素=OD280×V/(m×K总木质素).
以获得的K木质素和A木质素为标准值,以各样品(20株)定容至10mL(V)测得的OD280值,计算木质素总含量:m总木质素=OD280样品×V/A总木质素.
3种不同木质素(H-、G-、S-木质素)含量测定步骤:从杂种F3转基因阳性群体(WE1++,WE2++,WR1++和WR2++)和阴性群体(WE1--,WE2--,WR1--和WR2--)30d的水培幼苗中,分别随机选出18株,每样品包含6株(混样),3次重复;采用气相色谱-质谱联用技术对3种木质素含量分别进行测定.根据各样品和内标的色谱峰面积比,计算各样品中3种木质素的含量.
1.2.3 苯丙氨酸和酪氨酸的相对含量测定
杂种F3转基因阳性群体(WE1++,WE2++,WR1++和WR2++)和阴性群体(WE1--,WE2--,WR1--和WR2--)水稻种子萌发30d后,分别随机选出18株水培幼苗,6株混样,共3个重复,一共144株植株,采用液相色谱-质谱联用技术对苯丙氨酸和酪氨酸含量进行测定,并计算相对含量.计算方法:以阴性群体的苯丙氨酸和酪氨酸含量为1来换算阳性群体的相对含量.色谱条件:采用ACQUITY UPLC®BEH C18色谱柱,进样量5μL,柱温40℃,流动相A—含0.1%甲酸和0.1%七氟丁酸的乙腈,流动相B—0.1%甲酸水,流速0.2mL/min;梯度洗脱程序如下:0~1.5min,5%A;1.5~2min,5%~20%A;2~7min,20%~30%A;7~8.5min,30%~98%A;8.5~10.5min,98%A;10.5~11min,98%~5%A;11~12.5min,5%A.质谱条件:电喷雾电离(ESI)源,正离子电离模式.离子源电压3200V,溶剂温度380℃,锥孔电压20V.采用多重反应监测(MRM)进行扫描.
1.2.4 阿魏酸的相对含量测定
杂种F3转基因阳性群体(WE1++,WE2++,WR1++和WR2++)和阴性群体(WE1--,WE2--,WR1--和WR2--)水稻种子萌发30d后,分别随机选出18株水培幼苗,6株混样,3个重复,一共144单株,采用高效液相色谱技术对阿魏酸含量进行测定,并计算相对含量,计算方法:以阴性群体的阿魏酸含量为1来换算阳性群体的相对含量.色谱条件:Agilent Zorbax 300Extend-C18色谱柱,进样量10μL,柱温35℃,流动相A—1%乙酸水溶液,流动相B—甲醇,流速1.0mL/min,选用325nm色谱波长,采用等梯度洗脱,0~25min,90%A,10%B.
1.2.5 基因相对表达量测定
杂种F3转基因阳性(WE1++,WE2++,WR1++和WR2++)和阴性群体(WE1--,WE2--,WR1--和WR2--),在水稻种子萌发水培30d后,分别随机选出18株水培幼苗,6株混样,3个重复,一共144单株.本研究选择的目标基因分别编码苯丙氨酸脱氨酶(PAL)、酪氨酸脱氨酶(TAL)、肉桂酸-4-羟基化酶(C4H)、咖啡酸-5-羟基阿魏酸-O-甲基转移酶(COMT)、阿魏酸-5-羟基化酶(F5H)、4-香豆酸辅酶A连接酶(4CL)、肉桂酰辅酶A还原酶(CCR)、肉桂醇脱氢酶(CAD)、过氧化物酶(POD).本研究使用天根公司的RNAprep Pure植物总RNA提取试剂盒DP432提取水稻叶片总RNA,使用TaKaRa公司的PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit,以水稻总RNA为模板,反转录合成cDNA.利用Primer Premier 5.0设计荧光定量特异性引物,引物见表2.荧光定量PCR反应体系为:总体积20μL,2×ChamQ SYBR Color qPCR Master Mix 10μL,引物F(5μmol/L)0.8μL,引物R(5μmol/L)0.8μL,50×ROX Reference Dye 2 0.4μL,cDNA模版2μL,ddH2O 6.0μL.荧光定量PCR反应在ABI 7500序列扩增仪上进行,反应程序:50℃ 5 min;95℃ 5s,58℃ 30s,72℃ 40s共40个循环.
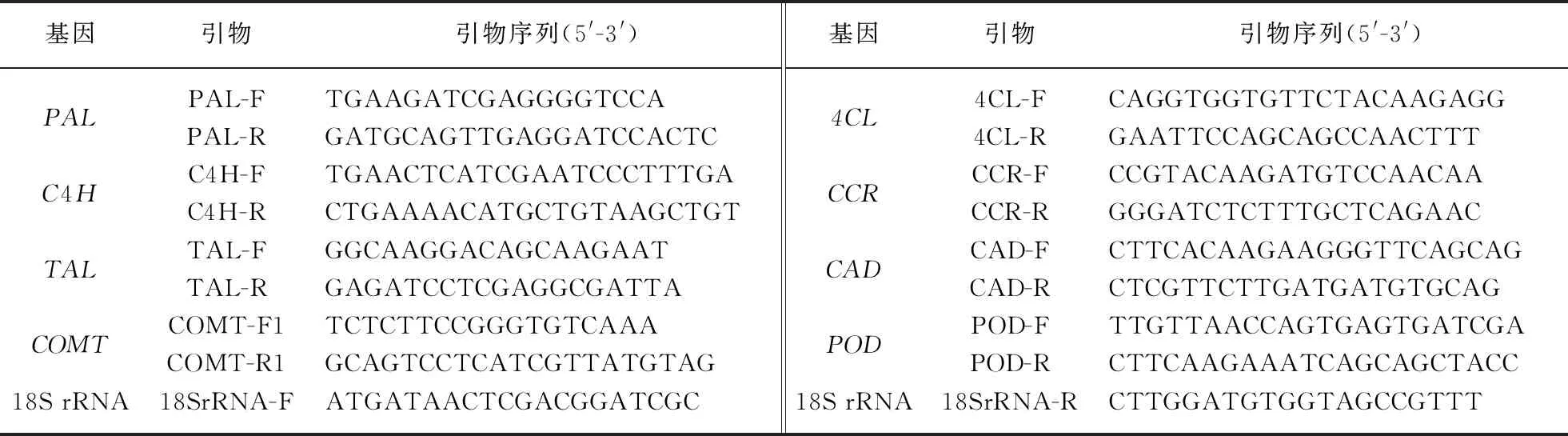
表2 荧光定量检测木质素合成通路中关键基因的引物Tab.2 Primer pairs for quantitative detection of key gene expression in lignin biosynthesis pathway by fluorescence
1.2.6 数据分析
本研究中采用独立样本t检验分析EPSPS转基因对栽培稻与杂草稻/野生稻杂交后代生物量干重、木质素总含量、不同木质素含量及比例,木质素合成途径中代谢物含量以及木质素合成相关基因表达量的影响.本研究中的数据统计和分析软件采用Microsoft Excel 2016和IBM SPSS Statistics 19.
2 结果与分析
2.1 转EPSPS基因阳性与阴性杂种群体的生物量
生物量(干重)的检测结果表明,在种子萌发后30d的水稻幼苗期,过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)以及野生稻(WR1,WR2)4个杂交组合的F3后代分离群体中,转基因阳性群体(WE1++,WE2++,WR1++和WR2++)的生物量均显著高于阴性对照群体(WE1--,WE2--,WR1--和WR2--),并且大部分组合的差异达到了极显著水平(图3).
在种子萌发后30d的水稻幼苗期,转基因阳性群体(WE1++,WE2++,WR1++和WR2++)的生物量是对应转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--)的1.28倍、1.22倍、1.41倍、1.26倍,相对于转基因阴性群体分别提高了28.0%、21.8%、41.2%、26.1%.这一结果表明,过表达EPSPS基因增加了栽培稻与杂草稻/野生稻杂交后代中含有过表达EPSPS基因群体(个体)的生物总量或干物质总质量.
2.2 转EPSPS基因阳性与阴性杂种群体的木质素含量
利用紫外分光光度计法测量木质素含量的实验结果表明,在种子萌发后30d的水稻幼苗期,含过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)以及野生稻(WR1,WR2)4个杂交组合的F3分离群体中,转基因阳性(WE1++,WE2++,WR1++和WR2++)群体的木质素总质量显著高于其对应的阴性(WE1--,WE2--,WR1--和WR2--)对照群体.转基因阳性群体的木质素总质量分别为3.08mg、2.76mg、4.47mg、3.05mg;而转基因阴性对照群体的木质素总质量分别为2.32mg、2.13mg、2.93mg、2.42mg,相较之下转基因阳性群体的木质素总含量分别提高了24.5%、22.7%、34.4%、20.7%(图4).
同样,在30d的水稻幼苗期,转基因阳性(WE1++,WE2++,WR1++和WR2++)群体的S-木质素和G-木质素含量均显著高于其对应的转基因阴性(WE1--,WE2--,WR1--和WR2--)对照群体的含量(图5(a),(b)),但是H-木质素的含量在转基因阳性和阴性群体之间没有显著差异(图5(c)).通过计算,得出转基因阳性群体幼苗中的S-木质素含量分别是对应阴性群体的1.58倍、1.82倍、2.28倍和1.96倍;而转基因阳性群体的G-木质素含量分别是对应阴性群体的1.49倍、1.99倍、2.34倍和2.41倍(图5(c)).另外,分析结果还表明,H-、G-和S-木质素含量的比例关系在转基因阳性和阴性杂种群体之间并未发生显著变化.
2.3 转EPSPS基因阳性与阴性杂种群体的苯丙氨酸、酪氨酸和阿魏酸含量
采用液相色谱-质谱联用技术对苯丙氨酸和酪氨酸检测结果表明,在种子萌发后30d的水稻幼苗期,转过表达EPSPS基因栽培稻与杂草稻(WE1)以及野生稻(WR2)两个杂交组合的F3分离群体中,转基因阳性群体(WE1++和WR2++)的苯丙氨酸和酪氨酸的含量均显著高于其对应的阴性对照群体(WE1--和WR2--).但另1个含过表达EPSPS基因栽培稻与野生稻(WR1)的杂交组合F3分离群体中,转基因阳性群体(WR1++)的苯丙氨酸和酪氨酸的含量与其阴性对照群体(WR1--)相比没有显著差异(图6).检测到的转基因阳性群体(WE1++、WR1++和WR2++)中苯丙氨酸质量分别为32.15μg、55.07μg、15.01μg,而其对应的转基因阴性群体(WE1--、WR1--和WR2--)中苯丙氨酸质量分别为21.89μg、49.81μg、8.94μg.同时,转基因阳性群体(WE1++、WR1++和WR2++)中酪氨酸的质量分别为18.17μg、27.64μg、8.50μg,而其对应的转基因阴性群体(WE1--、WR1--和WR2--)中酪氨酸的质量分别为13.32μg、26.65μg、5.40μg.
转基因阳性群体(WE1++、WR1++和WR2++)的苯丙氨酸含量是其相应转基因阴性对照群体(WE1--、WR1--和WR2--)的1.47倍、1.11倍和1.68倍,相对于转基因阴性群体分别提高了46.9%、10.5%和67.8%;转基因阳性群体(WE1++、WR1++和WR2++)的酪氨酸含量是其转基因阴性对照群体(WE1--、WR1--和WR2--)的1.36倍、1.04倍和1.58倍,相对于转基因阴性群体分别提高了36.4%、3.7%、57.5%(表3).
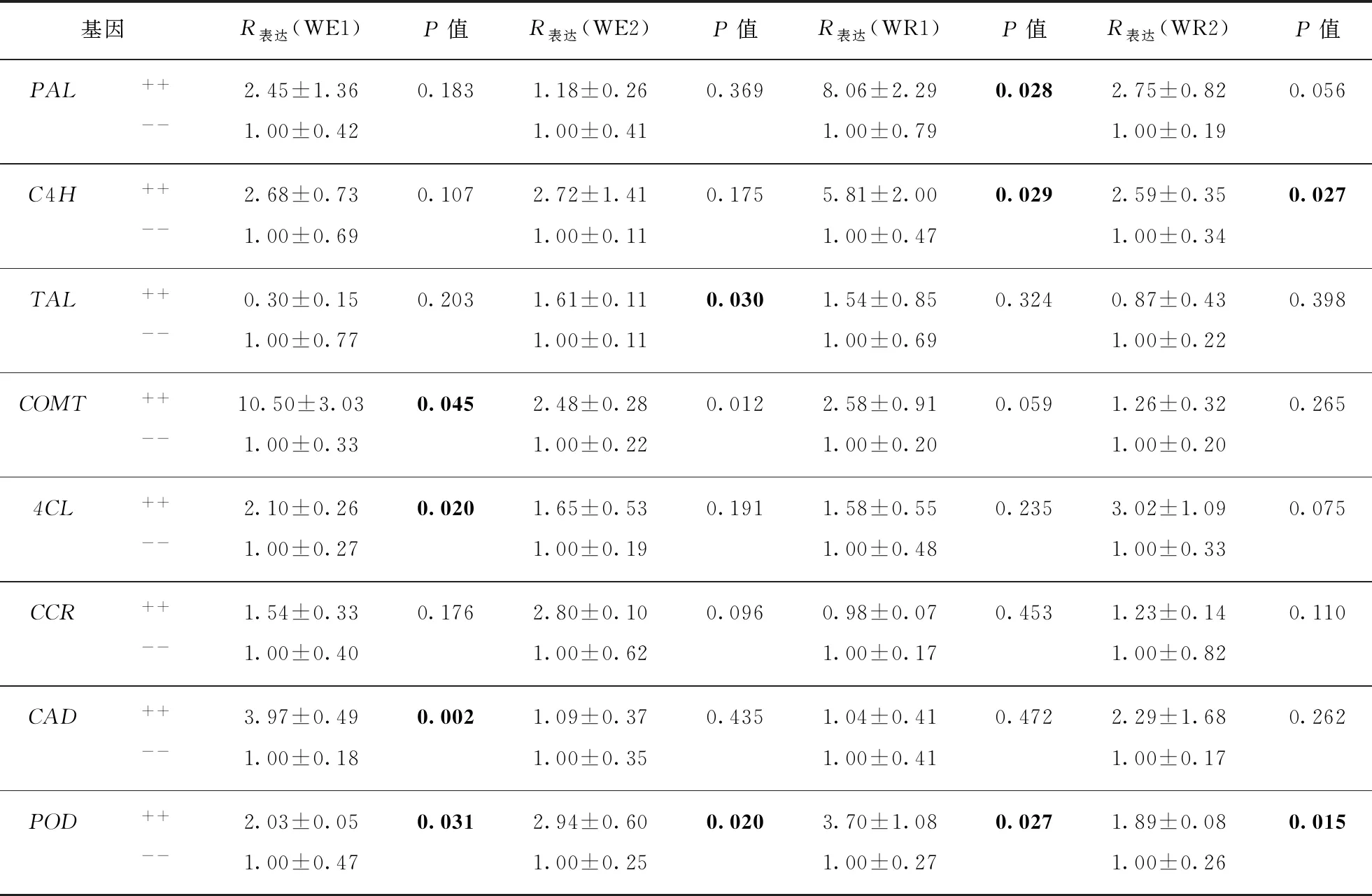
表3 杂种后代(F3)中EPSPS转基因阳性与阴性群体的木质素合成途径上基因的相对表达量Tab.3 Relative expression of eight genes in lignin synthesis pathway between EPSPS transgenic and non-transgenic progeny derived from EPSPS cultivated rice and weedy/wild rice hybrids
采用高效液相色谱技术对阿魏酸检测结果表明,转过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)以及野生稻(WR1,WR2)4个杂交组合的F3分离群体中,转基因阳性群体(WE1++,WE2++,WR1++和WR2++)的阿魏酸含量均显示近显著(+)或者显著(*)高于其对应的转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--)(图7).
转基因阳性群体(WE1++,WE2++,WR1++和WR2++)阿魏酸的质量分别为0.3061μg、0.2736μg、2.5575μg、0.4097μg;其对应转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--)阿魏酸的质量分别为0.2170μg、0.1586μg、1.0830μg、0.2530μg.转基因阳性群体的阿魏酸质量分别是其对应转基因阴性对照群体的1.41倍、1.73倍、2.36倍、1.62倍,相对于转基因阴性群体分别提高了41.1%、72.5%、136.2%、61.9%(图7).
2.4 转EPSPS基因阳性与阴性杂种群体的木质素合成相关基因表达量
荧光定量检测木质素合成通路上相关基因表达量的结果表明,在含过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)以及野生稻(WR1,WR2)4个杂交组合的F3分离群体中,转基因阳性群体(WE1++,WE2++,WR1++和WR2++)的木质素合成通路上相关基因的表达量与其对应的转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--)相比均有不同程度的上调(表3).
木质素合成途径中8个基因(图1)的相对表达量分别是:苯丙氨酸脱氨酶基因(PAL)的表达量在4个杂交组合(WE1、WE2、WR1、WR2)中分别提高了2.45倍、1.18倍、8.06倍和2.75倍;肉桂酸-4-羟基化酶基因(C4H)的表达量在4个杂交组合中分别提高了2.68倍、2.72倍、5.81倍和2.59倍;酪氨酸脱氨酶基因(TAL)的表达量在4个杂交组合中分别是转基因阴性群体的0.30倍、1.61倍、1.55倍、0.87倍;咖啡酸-5-羟基阿魏酸-O- 甲基转移酶基因(COMT)的表达量在4个杂交组合中分别提高了10.50倍、2.48倍、2.58倍和1.26倍;4- 香豆酸辅酶A连接酶基因(4CL)的表达量在4个杂交组合中分别提高了2.10倍、1.65倍、1.58倍和3.02倍;肉桂酰辅酶A还原酶基因(CCR)的表达量在4个杂交组合中分别是转基因阴性群体的1.54倍、2.80倍、0.98倍、1.23倍;肉桂醇脱氢酶基因(CAD)的表达量在4个杂交组合中分别提高了3.97倍、1.09倍、1.04倍和2.29倍(表3).
值得注意的是,过氧化物酶基因(POD)的表达量在4个杂交组合中分别提高了2.03倍、2.94倍、3.70倍和1.89倍(表3),而且含过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)以及野生稻(WR1,WR2)4个杂交组合的F3阳性群体中(WE1++,WE2++,WR1++和WR2++),POD的相对表达量均显著高于其转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--)(图8).
3 讨 论
本研究的一系列实验结果表明,在含过表达EPSPS基因栽培稻与杂草稻(WE1,WE2)/野生稻(WR1,WR2)4个组合杂交后代的F3分离群体中,转基因阳性群体(WE1++,WE2++,WR1++和WR2++)的生物量和木质素含量(总含量、G-木质素、S-木质素)均显著高于转基因阴性对照群体(WE1--,WE2--,WR1--和WR2--).上述研究结果明确地回答了本文提出的第1和第2个问题,即过表达EPSPS基因可以提高抗草甘膦除草剂转基因栽培稻与其野生近缘种杂种后代的生物量和木质素含量.
前期的研究表明,转基因栽培稻中过表达EPSPS基因渐渗到杂草稻群体中后,不仅提高了含有转基因杂种后代群体抗草甘膦除草剂的能力,而且还显著提高了适合度相关性状表现,如光合速率、分蘖能力、单株穗数和种子数等[16],在转基因栽培稻与野生稻杂种后代群体以及转EPSPS拟南芥中也发现了类似现象[17,20].本研究发现转EPSPS基因可以提高杂种后代的生物量与木质素含量,表明过表达不同来源的EPSPS基因可能为植物带来适合度的利益,提高植物的生存竞争能力,有利于植物的生长繁殖与扩张.另外,由于木质素可以提高植物的机械支撑强度,并且在抗逆、抗病方面有重要作用[18,21-22],木质素合成过程中产生的一些酚类和自由基也有利于提高植物的自我防御能力[23-24].因此,上述研究结果不仅可以从分子水平解释转EPSPS基因植物适合度优势产生的原因,而且还提示过表达EPSPS转基因的生物安全评价值得重视.因为该转基因一旦通过基因漂移从转基因作物渐渗到它们的野生近缘种群体,就可能因其适合度优势带来潜在的非预期生态环境风险[25-30].
本研究结果还发现,在转过表达EPSPS基因栽培稻与杂草稻的杂种F3后代(WE1)以及与野生稻的杂种后代(WR2)中,含转基因杂种群体的苯丙氨酸和酪氨酸含量比阴性对照显著增加,阿魏酸含量也有不同程度的增加,表明过表达莽草酸途径中EPSPS酶,可以在很大程度上影响其下游相关代谢产物的含量.同时,本研究还发现过表达EPSPS基因还影响了转基因栽培稻与杂草稻以及野生稻杂种后代G-木质素合成通路上相关基因的表达量,即转基因阳性群体中一系列与木质素合成相关基因的表达量与其对应的阴性群体相比较均有不同程度的上调,其中过氧化物酶基因(POD)的表达量在所有转基因阳性杂种群体中都表现出显著上调.上述结果回答了本文提出的第3个问题,即过表达EPSPS基因可以在很大程度上影响木质素合成通路上相关代谢产物的含量和基因的表达量.前人的研究表明,过氧化物酶(POD)通过催化不同木质醇单体发生脱氢聚合反应,并且参与调节木质素在植物细胞壁的聚合过程而使细胞壁的伸展性发生改变,这对植物生长具有一定的调节作用[19].本研究也证实POD是G-木质素合成过程中的一个非常关键的酶.
木质素作为植物在自然环境中存在的第二大聚合物,不仅对植物的生长发育有重要的作用,也是重要的生物能源代谢库[14].众所周知,广义的生物质能源大致包括3种不同的利用方式:(1) 植物的直接燃烧;(2) 生物能的转化,包括农作物秸秆气化和沼气利用;(3) 生物液体燃料,生物乙醇和生物柴油.木质素是一种储量大、可再生以及环境友好的自然资源,利用可再生自然资源生产燃料乙醇也正在引起科研工作者的更广泛关注[9,31-32],木质素经加工处理后作为能量及材料来源的应用前景巨大.本研究发现的过表达内源或外源的EPSPS基因,具有显著提高植物生产木质素潜力的现象与机理,为将来生物能源的资源创新和生产应用,特别是通过转基因生物技术和基因编辑技术来提高木质素产量,提供了一种新的重要策略和方法.
综上所述,木质素是自然界中含量丰富的芳香族高聚物,在植物的生长发育过程中具有非常重要的作用.揭示过量表达內源或外源EPSPS基因在木质素合成途径中如何影响植物相关代谢产物的变化以及基因的表达动态,不仅可以为后续有关木质素合成的进一步研究提供很好的借鉴,也有益于更好利用这一过程来提高木质素的产量,发挥其在生物能源开发与利用中的作用.另外,过量表达EPSPS基因可以为转基因植物带来适合度优势,这一类转基因一旦通过基因漂移从栽培植物渐渗到野生近缘种群体中,也可能导致不可预测的潜在环境风险,必须重视在商品化应用中对其进行严格的环境安全评价.

