响应曲面法优化蒺藜中黄酮和皂苷的提取工艺*
张 剑,谭健聪,杨钰蓉,张 博,韩 禄,刘春叶
(西安医学院 药学院,陕西 西安 710021)
蒺藜为蒺藜科植物蒺藜的干燥成熟果实,在中国有着悠久的用药历史,历代医学家对其多有论述和应用,目前为临床常用药,并被收载入中国药典。现代研究表明,蒺藜在心脑血管、抗氧化、抗衰老、改善性功能、治疗皮肤病等方面具有重要作用[1-2]。蒺藜水溶性成分主要是黄酮、皂苷类,黄酮类化合物具有抗氧化、抗病毒、抗肿瘤、清除自由基等多种生物活性[3-5],蒺藜皂苷可以减少自由基的生成,促进自由基的清除,减轻脂质过氧化反应[6-7]。蒺藜提取物可通过干扰花生四烯酸代谢调节血小板黏附、抗血小板凝集和抗氧化功能,对心血管疾病具有预防作用[8]。李明娟等[9]和Sharawy等[10]研究认为,蒺藜提取物能够显著抑制动物的糖异生作用,同时显著降低血清甘油三酯含量。因此,从蒺藜中高效、经济地提取黄酮和皂苷类成分,使蒺藜更广泛地得到应用显得尤为重要。
现有的报道大多以蒺藜果为研究对象[11-13],并且是以蒺藜中单一组分的提取作为研究目标[14-17],将黄酮和皂苷同时提取并比较蒺藜果和叶中含量的研究并不多见[5]。作者采用综合评价较高的微波辅助法[11]对蒺藜中黄酮和皂苷同时提取,对比了蒺藜叶和果实中总黄酮和总皂苷的含量,通过响应曲面法对提取工艺条件进行优化,以期得到蒺藜中总黄酮和皂苷的最佳提取条件,为蒺藜的开发利用奠定基础。
1 实验部分
1.1 原料、试剂与仪器
蒺藜果实和叶:产自陕北,经西安医学院生药教研室张寒副教授鉴定为蒺藜科植物蒺藜的果实和叶。
薯蓣皂苷:B21176-20mg,芦丁:B20771-20mg,上海源叶生物科技有限公司;水为超纯水;其余试剂均为分析纯,市售。
电热恒温水浴锅:HH-2,北京科伟永兴仪器有限公司;电脑微波超声波组合萃取仪:XH-300A,北京祥鹄科技发展有限公司;紫外分光光度计:UV762,上海佑科仪器仪表有限公司;循环水真空泵:SHZ-DⅢ,巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 标准曲线的制作
(1)黄酮标准曲线的制作[18]。精密称取芦丁标准品14.7 mg,加适量甲醇超声溶解并定容至50 mL容量瓶中,得芦丁标准品储备液,用移液管精密吸取该溶液0、1、2、3、4、5和6 mL分别置于25 mL容量瓶中,加0.04 g/mL NaNO2溶液1 mL,摇匀,放置6 min后加入0.1 g/mL Al(NO3)3溶液1 mL,摇匀,放置6 min后加入0.1 g/mL NaOH溶液10 mL,最后用水稀释至刻度,摇匀放置15 min。在200~600 nm扫描标准品最大吸收波长,在最大吸收波长处测量吸光度。以吸光度为纵坐标,芦丁质量浓度为横坐标绘制标准曲线,回归方程为y=17.75x+0.005 5,R2=0.998 6。
(2)皂苷标准曲线的制作[18]。精密称取薯蓣皂苷9.1 mg,加甲醇超声溶解并定容至50 mL容量瓶中,得薯蓣皂苷标准品溶液。精密吸取该溶液0、0.20、0.40、0.60、0.80、1.00和1.20 mL于7支具塞试管中,水浴加热挥去溶剂。在每支试管中精密加入高氯酸5 mL,密塞,于25 ℃水浴30 min。取出后立即放入冰水中冷却,在300~500 nm扫描标准品最大吸收波长,在最大吸收波长处测量其吸光度。以吸光度为纵坐标,薯蓣皂苷质量浓度为横坐标绘制标准曲线,回归方程为y=29.867x+0.038 1,R2=0.999 6。
1.2.2 蒺藜中总黄酮与总皂苷成分的提取方法及提取率比较
分别取蒺藜叶和果实饮片,粉碎,过孔径380 μm筛[14],分别用石油醚回流3 h脱脂,阴干,得供试品粉末,于密封袋中保存备用。精密称取供试品粉末1.00 g,加入乙醇静置20 min后进行微波提取,减压过滤提取液,取滤液减压蒸馏至干,使用甲醇超声溶解并定容至50 mL容量瓶中,作待测液供黄酮和皂苷提取率测定,比较蒺藜叶和果实的提取率。
1.2.3 单因素实验
以黄酮和皂苷提取率为考察指标,在微波功率为300 W的条件下分别考察提取时间、提取温度、m(提取液)∶m(原料)(以下简称液料比)、φ(乙醇)4个因素对蒺藜黄酮和皂苷提取率的影响。
1.2.4 响应曲面法优化提取工艺
在单因素实验基础上,确定自变量,分别以黄酮提取率和皂苷提取率为响应值,采用Box-Behnken实验方法对实验的提取温度、提取时间、液料比和φ(乙醇)进行四因素三水平实验设计。数据处理采用Design Expert.V 8.0.6.1软件进行分析。
2 结果与讨论
2.1 蒺藜叶和果实活性成分提取率比较结果
蒺藜叶和果实活性成分提取率见表1。

表1 叶和果实提取率比较结果
由表1可知,蒺藜叶中活性成分提取率显著高于果实活性成分提取率,故选择蒺藜叶作为蒺藜活性成分提取工艺优化的原料,扩大中药来源,可为药材的选择提供借鉴和参考。
2.2 单因素实验结果
2.2.1 提取时间对蒺藜黄酮和皂苷提取率的影响
精密称取蒺藜叶供试品粉末1.00 g,固定提取温度为30 ℃,功率为300 W,液料比为30,φ(乙醇)=70%,静置20 min后提取,设定提取时间分别为5、10、15、20、25、30和35 min,考察提取时间对蒺藜黄酮和皂苷提取率的影响,结果见图1。

t/min图1 微波时间对黄酮及皂苷提取率的影响
由图1可知,在提取过程中,随着时间的增加,黄酮和皂苷提取率逐渐增加,这是因为溶剂随时间增长逐渐渗透到细胞内部,直至皂苷和黄酮达到溶解平衡。在提取时间为25 min黄酮和皂苷的提取率达到最大值。时间继续延长,提取率有所下降,这可能是由于时间过长导致过多杂质也随之析出,且目标产物也容易分解,从而影响黄酮和皂苷的收率[18]。
2.2.2 提取温度对蒺藜黄酮和皂苷提取率的影响
精密称取蒺藜叶供试品粉末1.00 g,固定提取时间为25 min,功率为300 W,液料比为30,φ(乙醇)=70%,静置20 min后提取,设定提取温度分别为30、40,50、60和70 ℃,考察提取温度对蒺藜黄酮和皂苷提取率的影响,结果见图2。

t/℃图2 温度对黄酮和皂苷提取率的影响
由图2可知,随着温度的升高,黄酮提取率逐渐升高,在60 ℃时提取率趋于稳定;皂苷提取率先上升,60 ℃后有下降的趋势。由此说明,提取温度也不是越高越好,因为提取温度过高可能导致目标产物的分解,提取率反而下降[19]。
2.2.3 液料比对蒺藜黄酮和皂苷提取率的影响
精密称取蒺藜叶供试品粉末1.00 g,固定提取时间为25 min,提取温度为60 ℃,功率为300 W,φ(乙醇)=70%,设定液料比10~70,静置20 min后提取,考察液料比对蒺藜黄酮和皂苷提取率的影响,结果见图3。

液料比图3 液料比对黄酮和皂苷提取率的影响
由图3可知,液料比对黄酮和皂苷提取率影响较大,随着液料比逐渐增大,黄酮和皂苷提取率有较大的提升,在液料比为50时趋于稳定,若进一步扩大液料比不仅对黄酮和皂苷提取率贡献意义不大,反而增加了提取成本。
2.2.4φ(乙醇)对蒺藜黄酮和皂苷提取率的影响
精密称取蒺藜叶供试品粉末1.00 g,固定提取时间为25 min,功率为300 W,液料比为50,提取温度为60 ℃,静置20 min后提取,设定φ(乙醇)=10%、30%、50%、70%和90%,考察φ(乙醇)对蒺藜黄酮和皂苷提取率的影响,结果见图4。

φ(乙醇)/%图4 φ(乙醇)对黄酮和皂苷提取率的影响
由图4可知,随着φ(乙醇)的升高,黄酮和皂苷提取率变化显著,呈先升后降的趋势,当φ(乙醇)=70%,黄酮和皂苷提取率同时达到最大值。
2.3 响应面实验结果与分析
根据蒺藜黄酮和皂苷单因素提取结果,得蒺藜黄酮和皂苷提取率(Y1和Y2)为评价指标,对微波提取时间(A)、微波提取温度(B)、液料比(C)、φ(乙醇)(D)为主要影响因素,每个因素3个水平,Box-Behnken实验设计的因素水平表见表2,响应面实验设计及结果见表3。
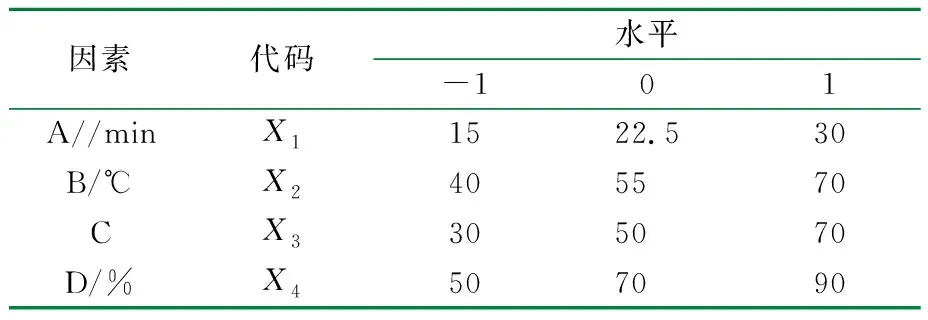
表2 蒺藜黄酮和皂苷提取实验因素水平及编码

表3 响应面实验设计及结果
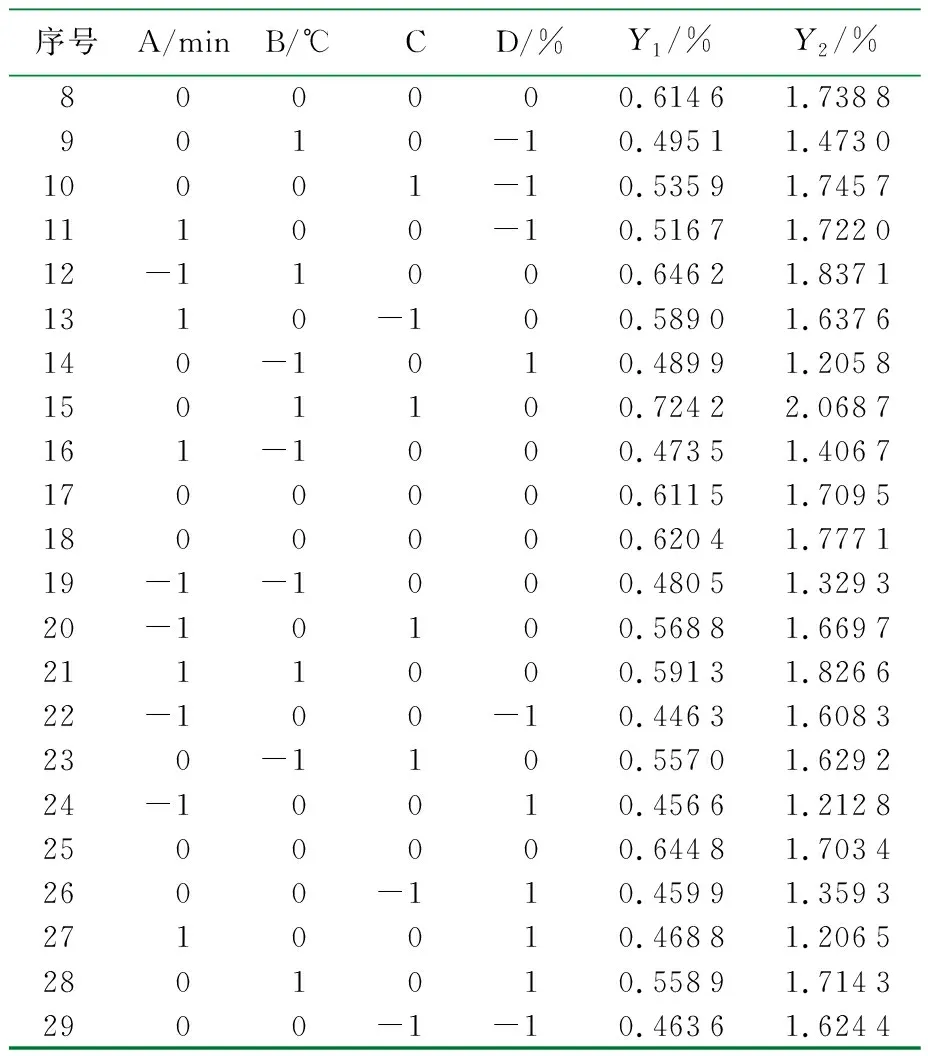
续表

2.3.1 方差分析
分别对以黄酮和皂苷提取率为响应值建立的回归模型进行方差分析,考察回归模型的显著性、重现性、拟合程度以及各因素对响应值的影响情况。
(1)以黄酮提取率为响应值的回归模型方差分析结果见表4。
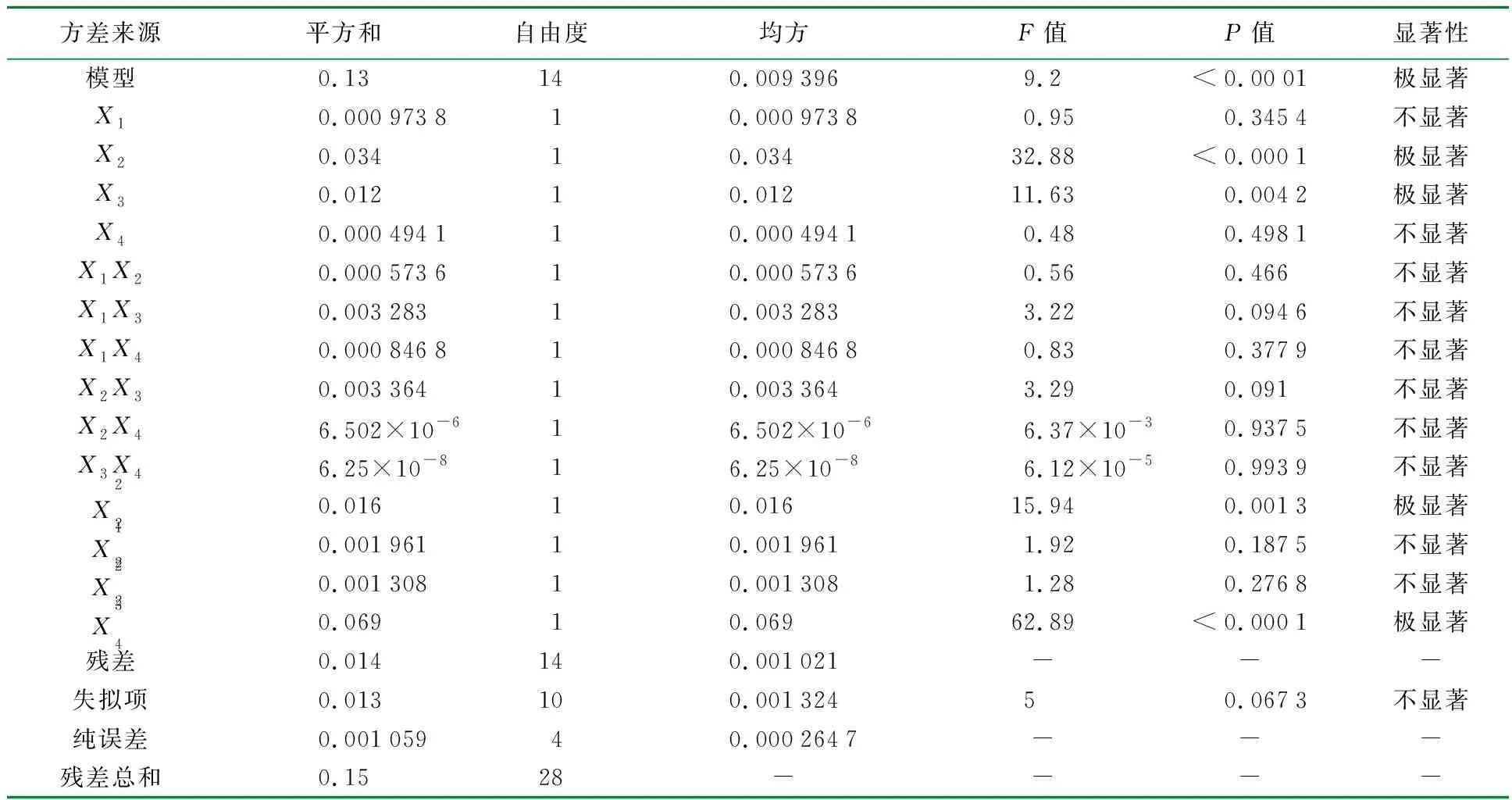
表4 以黄酮提取率为响应值的回归模型方差分析1)
由表4可知,该模型P<0.000 1,表明模型达到高度显著水平。失拟项P=0.067 3>0.05,表现为不显著;校正确定系数R2=0.902 0,说明该模型能解释90.20%的响应值变化,拟合程度良好,能够较好地反映微波提取时间,微波提取温度,液料比和φ(乙醇)与蒺藜黄酮提取率的关系;模型响应值的变异系数CV=5.90%,表明实验操作重复性好(<10%)。因此可以用此模型对蒺藜黄酮提取进行分析和预测,各因素对蒺藜黄酮提取率影响的大小顺序为温度>液料比>时间>φ(乙醇)。各因素对蒺藜黄酮提取率的交互影响不显著。
(2)以皂苷提取率为响应值的回归模型方差分析见表5。

表5 以皂苷提取率为响应值的回归模型方差分析1)
由表5可见,该模型P=0.002 1,达到极显著水平;失拟项P=0.004,表现为极显著,说明实验中存在误差较大的失拟因素;校正确定系数R2=0.837 4,说明该模型能解释83.74%的响应值变化;变异系数CV=2.66%,说明该实验重复性良好(<10%);4个因素中,温度、φ(乙醇)对响应值影响极显著,按影响大小排序为温度>φ(乙醇)>液料比>时间;X1X2、X2X3、X3X4、X1X3、X1X4、X2X4的P值均大于0.1,说明各因素对响应值的交互影响不显著。
2.3.2 各因素交互作用分析
(1)以黄酮提取率为响应值的响应曲面分析。根据响应面软件可以得到各因素间对蒺藜中黄酮提取率的交互影响3D响应面图,见图5~图8。

图5 温度和时间交互作用对蒺藜总黄酮提取率影响的3D响应面图
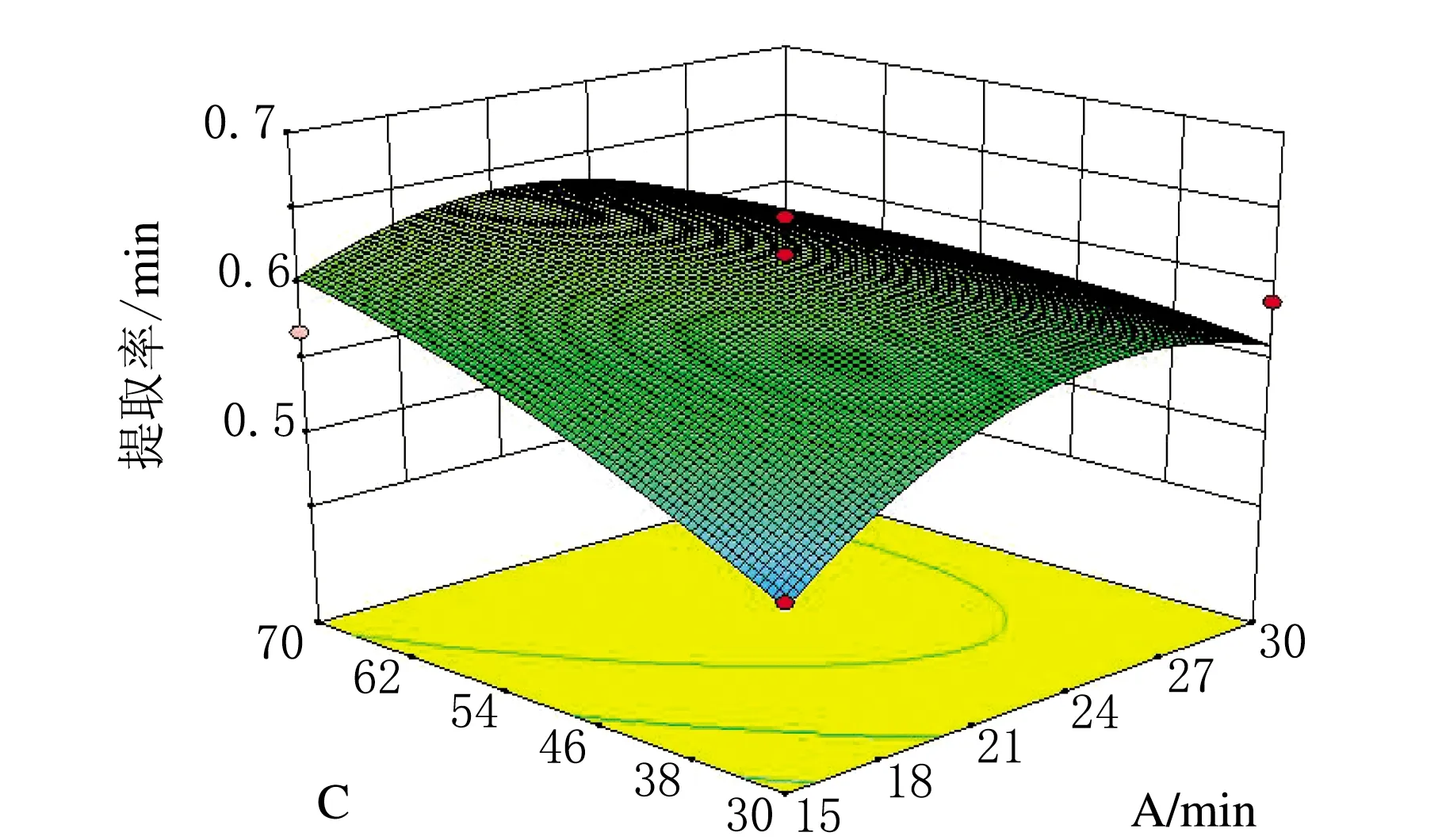
图6 时间和液料比交互作用对蒺藜总黄酮提取率影响的3D响应面图
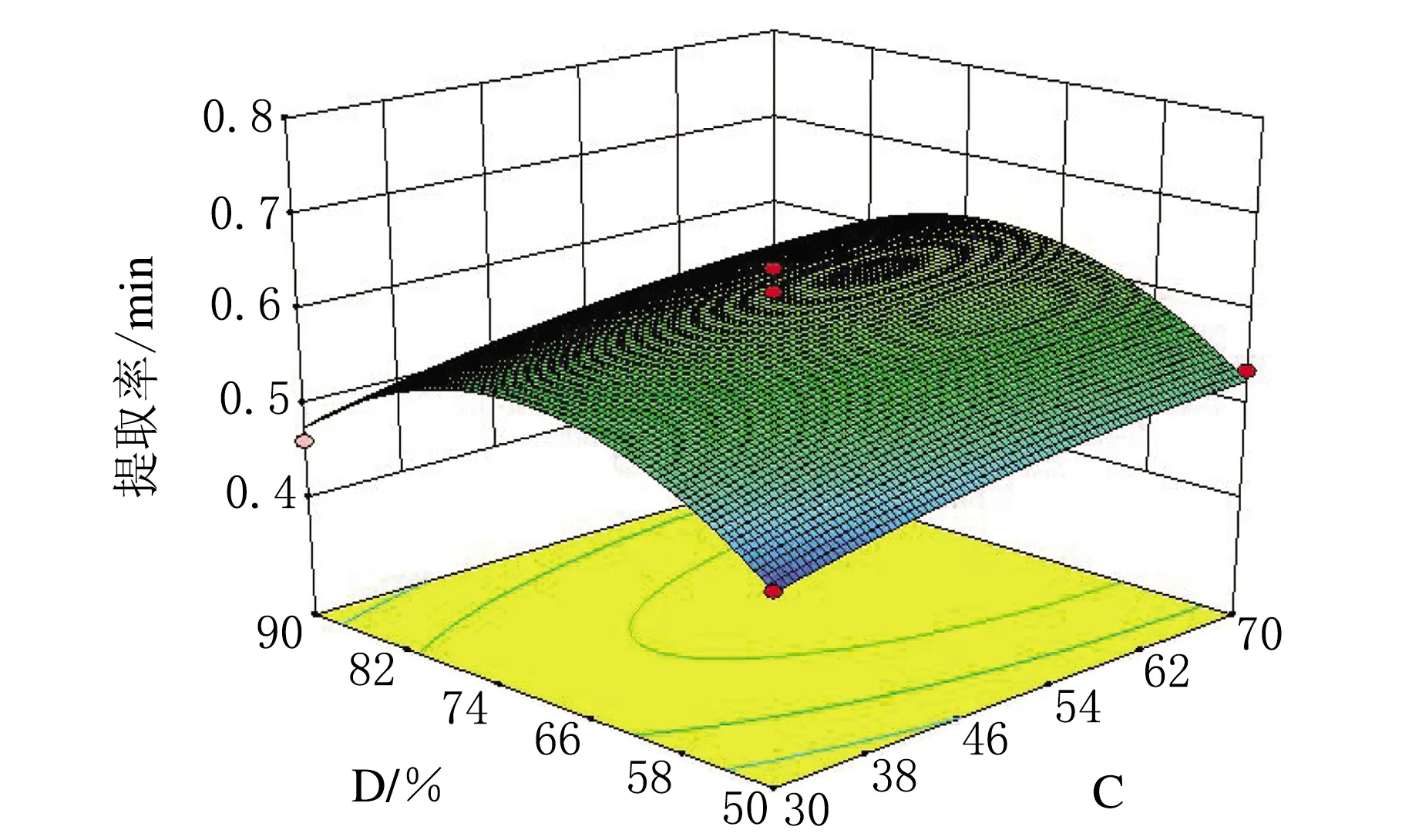
图7 φ(乙醇)和液料比交互作用对蒺藜总黄酮提取率影响的3D响应面图

图8 温度和φ(乙醇)交互作用对蒺藜总黄酮提取率影响的3D响应面图
响应面图中越陡峭的一方,其对提取的影响越大。由图5可知,温度对蒺藜中黄酮提取率的影响大于提取时间的影响;由图6可知,液料比的影响略大于提取时间的影响;由图7可知,φ(乙醇)对蒺藜中黄酮提取率的影响要明显大于液料比的影响;由图8可知,温度对蒺藜中黄酮提取率的影响要明显大于φ(乙醇)的影响。由此可得,温度对蒺藜中黄酮的提取率影响最大,其次是φ(乙醇)、液料比和提取时间,与方差分析得出的结论一致。
(2)以皂苷提取率为响应值的响应曲面分析。根据响应面软件可以得到各因素间对蒺藜中皂苷提取率的交互影响3D响应面图见图9~图12。

图9 温度和时间交互作用对蒺藜总皂苷提取率影响的3D响应面图

图10 时间和液料比交互作用对蒺藜总皂苷提取率影响的3D响应面图
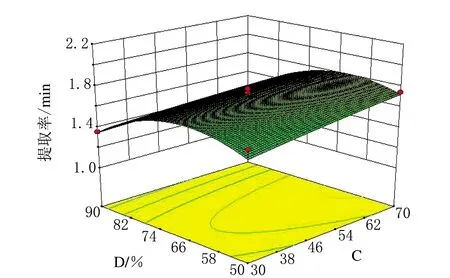
图11 φ(乙醇)和液料比交互作用对蒺藜总皂苷提取率影响的3D响应面图

图12 温度和φ(乙醇)交互作用对蒺藜总皂苷提取率影响的等高线图和3D响应面图
响应面图中越陡峭的一方,其对提取的影响越大。由图9可知,温度对蒺藜中黄酮提取率的影响大于提取时间的影响;由图10可知,液料比的影响略大于提取时间的影响;由图11可知,φ(乙醇)对蒺藜中黄酮提取率的影响要明显大于液料比的影响;由图12可知,温度对蒺藜中黄酮提取率的影响要明显大于φ(乙醇)的影响。由此可得,温度对蒺藜中皂苷的提取率影响最大,其次是φ(乙醇)、液料比和提取时间,与方差分析得出的结论一致。
2.3.3 最佳条件预测与验证
通过Design Expert软件进行数据拟合分析,得到最佳提取工艺为时间20.32 min,温度70 ℃,液料比70,φ(乙醇)=69.88%。在此条件下,黄酮和皂苷提取率分别为0.71%、2.02%。平行进行3组实验对最佳工艺进行验证,为了便于操作,选取提取时间为20 min,φ(乙醇)=70%,温度为70 ℃,液料比为70。结果表明,总黄酮的提取率分别为0.69%、0.71%、0.68%,平均值为0.69%;总皂苷提取率分别为1.99%、2.11%、1.98%,平均值为2.03%,与预测值基本吻合,说明预测模型可靠。
3 结 论
蒺藜叶中活性成分提取率显著高于果实活性成分提取率;响应曲面法不但可以对微波辅助提取蒺藜中黄酮和皂苷工艺条件进行优化,还可以对最佳提取条件下的提取率进行预测,预测值与实际测量值吻合度较高。研究的最佳提取产率高于相关文献报道[14,18],由此表明,该方法能兼顾2种活性成分提取率的最大化,避免生产中的资源浪费,对资源的合理开发利用具有一定的指导意义,也可为相关研究和工业化生产工艺条件的优化提供借鉴和参考。

