棘孢木霉GH11家族木聚糖酶的异源表达及酶学性质
余 静,刘学强,马俊文,李 雪,江正强,闫巧娟,杨绍青,*
(1.中国农业大学 工学院/中国轻工业食品生物工程重点实验室, 北京 100083;2.中国农业大学 食品科学与营养工程学院, 北京 100083)
木聚糖是一类杂合多聚糖,主链由β-D-吡喃木糖残基通过β-1,4-糖苷键连接,侧链上含有不同类型的取代基团,如α-1,2-葡萄糖醛酸基、α-L-阿拉伯呋喃糖基、O-乙酰基、4-O-甲基葡萄糖醛酸、半乳糖和阿魏酸等[1-2]。木聚糖普遍存在于植物细胞壁中[3],如稻草、玉米芯、麦麸和甘蔗渣等多种农业废弃物中均含有大量天然木聚糖组分[2]。木聚糖的生物转化是实现生物质资源高效开发和利用的一个主要方向。
木聚糖酶(β-1,4-xylanase, EC 3.2.1.8)是一类能够降解木聚糖的酶系,广泛存在于植物、微生物、甲壳类动物和原生动物体中[4]。迄今,已报道的木聚糖酶大多分布在糖苷水解酶(glycoside hydrolase,GH)10家族和11家族,此外还有少数木聚糖酶分布于GH的5、7、8、30和43家族[5]。不同家族木聚糖酶在结构、酶学性质及适用领域上均存在较大差异,其中GH11家族木聚糖酶的数量相对较多(CAZy数据库迄今收录了1 922条序列信息)。GH11家族木聚糖酶结构大多呈现为单一结构域,相对分子质量一般小于30 kDa,最适pH值一般为酸性到中性范围,对不同来源的木聚糖底物具有特异性,且水解产物主要以低聚木糖为主,单糖含量较少[5]。酸性木聚糖酶由于在酸性条件下可保持较高活性,在食品和动物饲料等行业中具有良好的应用前景[6]:如茎点霉(Phomasp.)GH11家族木聚糖酶xynMF13A最适pH值为5.0,在烘焙、低聚木糖生产和海产品加工中显示出了潜在应用价值[7];出芽短梗霉(Aureobasidiumpullulans)GH11家族木聚糖酶最适pH值为4.0,该酶良好的耐酸、耐盐和耐乙醇特性使其在果汁生产和酿酒行业中显示出良好的应用价值[8]。不同应用领域对木聚糖酶的酶学特性需求差别较大,因此,继续发掘新型的、特性优良的木聚糖酶具有重要意义。
棘孢木霉(Trichodermaasperellum)是我国2005年新发现的可有效抑制植物病害的木霉菌株[9]。目前已有该菌株固体发酵产木聚糖酶的研究报道[10-12],但是主要集中在固体发酵条件优化等方面,尚未见棘孢木霉木聚糖酶基因克隆表达及酶学性质等方面的研究。本实验室前期筛选、鉴定并保藏了一株棘孢木霉,本研究拟从该菌基因组中克隆一个GH11家族木聚糖酶基因,并将其在大肠杆菌中进行异源表达,进一步研究重组酶的基本酶学性质。
1 材料与方法
1.1 材料与试剂
菌株与质粒:棘孢木霉由本实验室筛选并保藏;大肠杆菌DH5α和BL21(DE3)感受态细胞,北京博迈德生物技术公司;pET-28a(+)质粒,含卡那霉素抗性基因、多克隆酶切位点以及T7启动子,受IPTG(异丙基硫代-β-半乳糖苷)诱导,美国Invitorgen公司。
真菌基因组DNA提取试剂盒,杭州倍沃医学科技有限公司;总RNA提取试剂盒、高纯质粒制备试剂盒,北京天根生化科技有限公司;低分子质量标准蛋白质、限制性内切酶BamHI和NhoI、T4 DNA连接酶,大连TaKaRa公司;TransStart FastpfuDNA polymerase,北京全式金生物技术公司;AxyPrep DNA凝胶回收试剂盒,AxyGen公司;Ni-NTA亲和层析柱,GE公司;木糖、低聚木糖、榉木木聚糖,Mezayme公司;桦木木聚糖、燕麦木聚糖、小麦阿拉伯木聚糖、壳聚糖、大麦β-葡聚糖、可溶性淀粉、槐豆胶、羧甲基纤维素、可德兰多糖、pNP-β-xylopyranoside,美国Sigma公司。其他试剂如无特殊说明均为分析纯。
PDA平板培养基:200 g·L-1土豆、20 g·L-1葡萄糖、15 g·L-1琼脂。
YPD液体培养基:10 g·L-1酵母浸粉、20 g·L-1蛋白胨、20 g·L-1葡萄糖。
LB液体培养基:5 g·L-1酵母浸粉、10 g·L-1蛋白胨、10 g·L-1NaCl。
LB平板培养基:5 g·L-1酵母浸粉、10 g·L-1蛋白胨、10 g·L-1NaCl、15 g·L-1琼脂。
1.2 仪器与设备
PB21型pH计,德国赛多利斯公司;JJT- 900型超净工作台,北京半导体设备一厂;GL- 20B型高速冷冻离心机,上海安亭科学仪器厂;HWS24型电热恒温水浴锅、DHP- 9052型电热恒温培养箱,上海一恒科学仪器有限公司;HZQ- X100型恒温双层振荡培养箱,江苏太仓实验设备厂;DYY- Ⅲ2型稳压稳流电泳仪,北京市六一仪器厂;Power Pac Basic型电泳仪、MyCycler型PCR自动扩增仪,美国Bio- Rad公司;TS- 1型脱色摇床,江苏海门其林贝尔仪器制造有限公司;TU- 1800PC型紫外可见分光光度计,北京普析通用仪器设备有限责任公司;JY92- ⅡN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;KTA型蛋白纯化系统,美国GE Healthcare公司。
1.3 实验方法
1.3.1木聚糖酶基因的克隆和表达载体的构建
将棘孢木霉接种于YPD液体培养基中,30 ℃摇瓶培养3 d。10 000 r·min-1离心3 min,收集0.1 g菌丝体,在研钵中加入液氮迅速研磨菌体,收集磨碎的真菌组织。使用真菌基因组DNA提取试剂盒提取棘孢木霉基因组DNA;使用总RNA提取试剂盒提取棘孢木霉总RNA,采用PolyATract mRNA Isolation Systems(Promega)方法从棘孢木霉总RNA中纯化mRNA,并合成cDNA第一链。
在NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)中搜索到棘孢木霉GH11家族木聚糖酶TaXyn11A基因序列,并以此设计上下游引物。分别以棘孢木霉基因组DNA和cDNA为模板,添加上游引物TaXyn11AF(5′ CCGGAATTCGCTCCCACTGAGACCGTG 3′)和下游引物TaXyn11AR(5′ GAATGCGGCCGCTCAGCTAACGTTAATGTTTGCGTTAC 3′)进行PCR扩增,以获得编码成熟蛋白的核酸序列。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸80 s,循环35次;最后72 ℃后延伸5 min。将PCR产物进行琼脂糖凝胶电泳分析(琼脂糖质量浓度为10 g·L-1),然后切胶回收目的条带。将PCR扩增回收的DNA片段进行测序,和pET-28a(+)载体以BamH I和NhoI进行双酶切,用T4连接酶连接目的基因片段和表达载体。
1.3.2木聚糖酶基因TaXyn11A序列分析
利用在线软件SignalP4.1(http:∥www.cbs.dtu.dk/services/signalP)分析棘孢木霉木聚糖酶信号肽编码序列。采用NCBI BLAST(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi/)进行序列同源性比对。采用Clustal Omega(http:∥www.ebi.ac.uk/Tools/msa/clustalo/)进行多重序列比对,并采用Boxshade(http:∥ww.ch.embnet.org/software/BOX-form.html/)生成多序列比对图。
1.3.3TaXyn11A在大肠杆菌中的表达
将连接完成后的质粒转化大肠杆菌DH5α,并涂布于LB平板培养基。挑选菌落PCR验证为阳性的转化子测序。取测序正确的阳性转化子接种LB液体培养基,提取质粒,转化大肠杆菌BL21(DE3)。挑取阳性转化子接种于10 mL LB液体培养基(含50 μg·mL-1卡那霉素),37 ℃,200 r·min-1培养。取对数期的菌液作为种子液,接种于200 mL LB液体培养基(含50 μg·mL-1卡那霉素),37 ℃,200 r·min-1培养至OD600值为0.6~0.8时,加入IPTG至终浓度为1 mmol·L-1,30 ℃诱导过夜。
1.3.4重组木聚糖酶TaXyn11A的纯化
重组大肠杆菌诱导过夜后,10 000 r·min-1离心3 min,弃上清液。用缓冲液A(20 mmol·L-1、pH值为8.0的Tris-HCl缓冲液,含500 mmol·L-1NaCl和20 mmol·L-1咪唑)重悬菌体,混合均匀后于冰水浴中超声破碎(200 W,超声3 s,间歇4 s,120次)。于4 ℃条件下,10 000 r·min-1离心10 min,上清液即为粗酶液。
TaXyn11A的纯化采用快速蛋白液相色谱纯化系统。将粗酶液以0.5 mL·min-1的流速加载到Ni-NTA亲和层析柱(1 cm×10 cm)上。上样后依次用缓冲液A、缓冲液B(20 mmol·L-1、pH值为8.0的Tris-HCl缓冲液,含500 mmol·L-1NaCl和50 mmol·L-1咪唑)、缓冲液C(20 mmol·L-1、pH值为8.0的Tris-HCl缓冲液,含500 mmol·L-1NaCl和200 mmol·L-1咪唑)洗脱,洗脱体积均为5倍柱体积,洗脱流速均为1 mL·min-1。测定各组分的酶活力,收集有木聚糖酶活力的洗脱液,用缓冲液D(20 mmol·L-1、pH值为8.0的Tris-HCl缓冲液)4 ℃下透析6 h。
用SDS-PAGE法分析重组木聚糖酶纯度。SDS-PAGE分析参照Laemmli[13]的方法进行:分离胶体积分数为12.5%,浓缩胶体积分数为4.5%。考马斯亮蓝R-250染色显示蛋白条带,甲醇、乙酸洗脱背景色。
1.3.5酶学性质表征
1.3.5.1 酶活力和蛋白含量的测定
酶活力测定参照Liu等[14]的方法,并采用3,5-二硝基水杨酸(3, 5-dinitrosalicylic acid,DNS)法检测所产生的还原糖量(以木糖作为标准)。将100 μL适当稀释的酶液加入到900 μL质量浓度为10 mg·mL-1的榉木木聚糖底物中(用50 mmol·L-1、pH值为5.0的柠檬酸缓冲液配制),50 ℃下反应10 min,加入1 mL DNS终止反应,沸水浴15 min,加入1 mL体积分数为40%的酒石酸钾钠溶液,最后在540 nm下测定吸光值。木聚糖酶的酶活力单位(U·mL-1)定义为每分钟生成1 μmol木糖所需要的酶量。
蛋白含量的测定参照Liu等[14]的方法,以牛血清白蛋白作为标准蛋白。
1.3.5.2 重组木聚糖酶分子质量的测定
采用SDS-PAGE法检测TaXyn11A分子质量,以标准蛋白分子质量(molecular weight,MW)的对数值(lg(MW))为纵坐标,迁移率为横坐标绘图,根据目标蛋白迁移率计算出目标蛋白分子质量。标准蛋白包括溶菌酶(14.4 kDa)、大豆胰蛋白酶抑制剂(20.1 kDa)、胸苷磷酸化酶(29.0 kDa)、卵清蛋白(44.3 kDa)、牛血清白蛋白(66.2 kDa)和磷酸化酶B(97.2 kDa)。
1.3.5.3 最适pH值和酸碱稳定性的测定
1)最适pH值的测定。采用50 mmol·L-1的不同缓冲液(pH值为3.0~11.0)配制的榉木木聚糖(10 mg·mL-1)作为底物,于50 ℃下测定木聚糖酶酶活力。以最大值为100%,分别计算不同pH值条件下的相对酶活力。
2)酸碱稳定性的测定。将稀释后的酶液与不同pH值的缓冲液混合,40 ℃温水浴和冰水浴下先后各处理30 min,然后在最适条件下测定残余酶活力,以未经处理酶液作为对照。缓冲液体系包括:柠檬酸缓冲液(pH值为3.0~6.0)、乙酸缓冲液(pH值为4.0~6.0)、MES缓冲液(pH值为5.5~6.5)、MOPS缓冲液(pH值为6.5~7.5)、磷酸缓冲液(pH值为6.0~8.0)、Tris-HCl缓冲液(pH值为7.0~9.0)、CHES缓冲液(pH值为8.0~10.0)和CAPS缓冲液(pH值为10.0~11.0)。
1.3.5.4 最适温度和热稳定性的测定
1)最适温度的测定。在30~70 ℃范围内,于50 mmol·L-1柠檬酸缓冲液(pH值为5.0)中测定木聚糖酶活力。以最大值为100%,分别计算各温度下的相对酶活力。
2)热稳定性的测定。将酶液与50 mmol·L-1柠檬酸缓冲液(pH值为5.0)混合后,分别在30~60 ℃和冰水浴下先后处理30 min,然后在50 ℃下测定酶活力。以未经处理的酶液作为对照,分别计算各温度处理后的残余酶活力。
3)半衰期的测定。将酶液分别于40~50 ℃保温不同时间,用冰水浴冷却30 min,间隔不同时间取样,在最适条件下测定酶活力。以未经处理的酶液作为对照计算残余酶活力,最后通过回归方程计算不同温度下酶活力衰变至50%的时间。
1.3.5.5 金属离子和化合物对酶活力影响的测定
将木聚糖酶与不同金属离子和化合物(终浓度为1 mmol·L-1)混匀,置于40 ℃条件下保温30 min,立即冰水冷却30 min。以加入相同浓度金属离子和化合物的缓冲液为空白对照,在pH值为5.0的柠檬酸缓冲液及50 ℃下测定木聚糖酶酶活力。以不加入金属离子的酶活力为100%计算相对酶活力。
金属离子及化合物包括:Fe2+、Fe3+、Cu2+、Mn2+、Ca2+、Na+、Co2+、Zn2+、K+、Ni2+、Ba2+、Cr3+、Mg2+、Ag+、乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)和β-巯基乙醇。
1.3.5.6 重组木聚糖酶底物特异性的测定
用50 mmol·L-1、pH值为5.0的柠檬酸缓冲液配制10 mg·mL-1不同种类聚糖和人工合成底物(pNP-β-xylopyranoside),在50 ℃下测定酶活力。聚糖底物包括:桦木木聚糖、榉木木聚糖、燕麦木聚糖、小麦阿拉伯木聚糖、大麦β-葡聚糖、壳聚糖、槐豆胶、可溶性淀粉、可德兰多糖和羧甲基纤维素。以木聚糖酶对榉木木聚糖的酶活力为100%,分别计算木聚糖酶对各种底物的比酶活力和相对酶活力。
1.3.5.7 重组木聚糖酶水解特性的测定
用50 mmol·L-1、pH值为5.0的柠檬酸缓冲液配制10 mg·mL-1的木聚糖(榉木、桦木及燕麦木聚糖)及低聚木糖(木二糖~木五糖)底物。在底物中加入2 U·mL-1的TaXyn11A,40 ℃水浴反应,定时取样并用沸水煮沸5 min灭活,冷却后离心取上清液进行薄层层析(TLC)、高效液相色谱(HPLC)分析,以木糖和低聚木糖作为标准。TLC分析方法:展层剂为正丁醇、乙酸和水的混合液(三者体积比为2∶1∶1),显色剂为甲醇与浓硫酸混合液(二者体积比为95∶5)。HPLC分析方法:RID检测器,检测器温度为35 ℃,色谱柱为氨基柱,流动相为体积分数为72%的乙腈,流速为0.6mL·min-1,柱温为45 ℃,运行时间为30 min。
1.4 数据处理
数据统计和图片处理采用Origin 8.0进行,数据均为3次平行。
2 结果与分析
2.1 木聚糖酶基因(TaXyn11A)的克隆和表达结果
图1为木聚糖酶基因TaXyn11A的克隆与表达结果。分别以棘孢木霉基因组DNA和cDNA为模板,利用引物TaXyn11AF和TaXyn11AR,PCR扩增木聚糖酶基因,得到长度为784 bp和672 bp[图1(a)]的片段,该基因含有1个内含子。TaXyn11A片段经BamHI和NhoI酶切后,与经相同双酶切后的载体pET-28a(+)进行连接,构建的重组表达载体pET-28a(+)-TaXyn11A如图1(b),然后将该载体转化至大肠杆菌BL21(DE3)中进行诱导表达。
TaXyn11A编码的木聚糖酶TaXyn11A由223个氨基酸组成,SignalP分析表明,其N端存在一个由19个氨基酸组成的信号肽序列。图2为TaXyn11A与其他GH11家族木聚糖酶多重氨基酸序列比对结果,图2显示,在性质已报道的木聚糖酶中,TaXyn11A与来自哈茨木霉C4(Trichodermaharzianum)的GH11家族木聚糖酶xynⅡ(NCBI accession No. B5A7N4.1)同源性最高,为85.2%,其次为里氏木霉QM6a(Trichodermareesei,G0RUP7.1,84.8%)、桔青霉FERM P-15944(Penicilliumcitrinum,Q2PGY1.1,62.1%)和烟曲霉A1163(Aspergillusfumigatus,B0Y8Q8.1,58.7%)GH11家族木聚糖酶。此外,比对分析发现,T.harzianumC4、T.reeseiQM6a和P.citrinumFERM P-15944来源GH11家族木聚糖酶都含有两个保守谷氨酸残基,这些残基可能在底物结合和催化中起关键作用。木聚糖酶TaXyn11A的这两个谷氨酸残基分别位于蛋白序列的第119和210位。
2.2 酶学性质分析
2.2.1重组木聚糖酶的纯化及分子质量分析
图3为重组木聚糖酶TaXyn11A的纯化结果。由图3(a)可见,粗酶液采用Ni-NTA亲和层析纯化得到电泳级纯酶。酶的纯化倍数为3.2倍,酶活力回收率为70%,比酶活力由224.0 U·mg-1提高到706.0 U·mg-1。由图3(b)可见,SDS-PAGE法测定TaXyn11A的分子质量为24.2 kDa。Ezeilo等[10]利用棘孢木霉发酵油棕叶产木聚糖酶,在最佳发酵条件下,粗酶液中含有4个不同分子质量的木聚糖酶,分子质量分别为18.4、22.0、31.6、32.0 kDa。GH11家族木聚糖酶的分子质量一般小于30 kDa,TaXyn11A的分子质量与其他GH11家族木聚糖酶相近,如嗜热踝节菌(Talaromycesthermophilus)木聚糖酶T-XynC(22.6 kDa)[15]、绳状踝节菌(Talaromycesfuniculosus)木聚糖酶xynC(23.6 kDa)[16]、异宗毁丝霉(Myceliophthoraheterothallica)木聚糖酶r-ec-XylMh(24.7 kDa)[17]和宏基因组来源木聚糖酶MetXyn11(28 kDa)[18]。
2.2.2pH值对酶活力的影响
一般来说,GH11家族木聚糖酶最适pH值为6.5~7.5[5]。图4为pH值对TaXyn11A酶活力影响的实验结果,由图4(a)可知,TaXyn11A在pH值为5.0时显示出最大酶活力,为酸性木聚糖酶。与其他GH11家族木聚糖酶相比,该酶的最适pH值与T.funiculosus木聚糖酶xynC[16]、枯草芽孢杆菌(Bacillussubtilis)木聚糖酶MxynA[19]和P.citrinum木聚糖酶[20]一致,低于M.heterothallica木聚糖酶r-ec-XylMh[17]和骆驼瘤胃宏基因组来源木聚糖酶XylCMS[21](pH值均为6.0),但高于A.pullulans[8]木聚糖酶(pH值为4.0)。由图4(b)可知,TaXyn11A在pH值为4.0~10.0时保温30 min,残余酶活力保持在80%以上,显著优于其他大多数GH11木聚糖酶的酸碱稳定范围,如MetXyn11[18](pH值为6.0~9.0)、SWT[22](pH值为4.5~7.0)和MxynA[19](pH值为4.0~8.0)。TaXyn11A较好的耐酸性和酸碱稳定性使其在食品、饲料等行业具有潜在应用价值。

缓冲液包括柠檬酸缓冲液(■)、乙酸缓冲液(●)、MES缓冲液(◆)、MOPS缓冲液(▲)、磷酸缓冲液(▼)、Tris-HCl缓冲液(□)、CHES缓冲液(〇)和CAPS缓冲液(△)。图4 pH值对TaXyn11A酶活力的影响Fig.4 Effect of pH on activity of TaXyn11A
2.2.3温度对酶活力的影响
大多数真菌木聚糖酶的最适温度在45~60 ℃[8]。图5为温度对TaXyn11A酶活力影响的实验结果。由图5(a)可知,TaXyn11A为中温木聚糖酶,最适温度为50 ℃,低于T.funiculosus木聚糖酶(55 ℃)[16]和T.asperellum木聚糖酶(60 ℃)[10]。由图5(b)可知,TaXyn11A在45 ℃及以下保持稳定,在45 ℃时保温30 min能分别保持初始酶活力的87.9%,而来源于M.heterothallicaF.2.1.4的木聚糖酶r-ec-XylMh在40 ℃以下保温30 min,仅能保持初始酶活力的72%[17]。由图5(c)可知,TaXyn11A在40、45、50 ℃的半衰期分别为28.8 h、14.3 h、18 min,在55 ℃以上迅速失活;而来源于黑曲霉(Aspergillusniger)GH11木聚糖酶xynEV-34在45 ℃时的半衰期仅为23 min[23]。通常来说,烘焙行业中面团的醒发温度为35~38 ℃[8],因此在中温条件下表现出最大酶活力的木聚糖酶可能更加适用于烘焙行业。
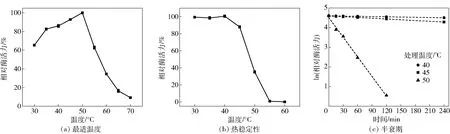
图5 温度对TaXyn11A酶活力的影响Fig.5 Effect of temperature on activity of TaXyn11A
2.2.4金属离子和化合物对TaXyn11A酶活力的影响
1 mmol·L-1的EDTA、Mn2+和Cr3+对TaXyn11A的活性有激活作用,分别使其比酶活力提升了19%、14%和10%。SDS和CTAB处理对该酶酶活力有明显抑制作用,分别使其丧失88%和61%的比酶活力。除此之外,其他金属离子及化合物对该酶的影响较为微弱。其他大多数已报道的GH11家族木聚糖酶活性都被SDS强烈抑制,如木聚糖酶MetXyn11等[18]。
2.2.5TaXyn11A的底物特异性分析
TaXyn11A的底物特异性分析结果如表1。表1显示:在测定的11种底物中,TaXyn11A只能降解木聚糖底物,对大麦β-葡聚糖、壳聚糖、槐豆胶、可溶性淀粉、可德兰多糖、羧甲基纤维素等其他天然底物均没有表现出水解活性。TaXyn11A水解燕麦木聚糖的比酶活力最高(989.6 U·mg-1),其后依次为小麦阿拉伯木聚糖(727.6 U·mg-1)、榉木木聚糖(706.0 U·mg-1)和桦木木聚糖(484.5 U·mg-1)。T.thermophilus来源木聚糖酶T-XynC对燕麦木聚糖(861.91 U·mg-1)的水解能力也高于榉木木聚糖(549.88 U·mg-1)和桦木木聚糖(519.71 U·mg-1)[15]。此外,TaXyn11A对人工底物对硝基苯-β-D-木吡喃糖苷没有水解活性,说明该木聚糖酶可能不具有β-木糖苷酶活性。
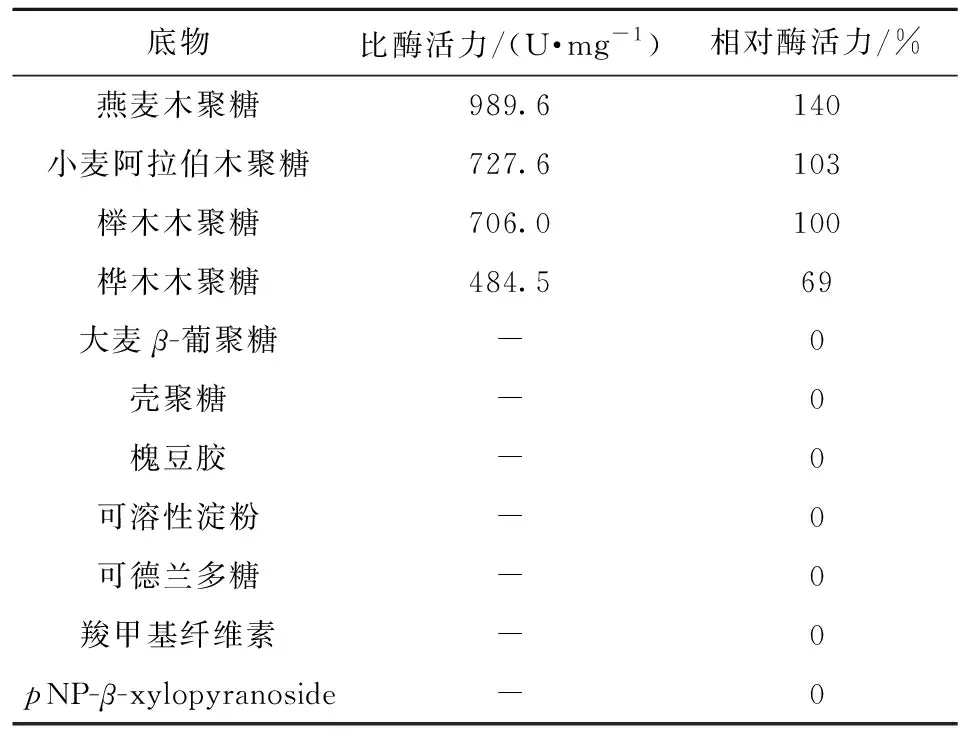
表1 TaXyn11A的底物特异性Tab.1 Substrate specificity of TaXyn11A
2.2.6TaXyn11A的水解特性分析

M:木糖和低聚木糖标准品(X.木糖;X2.木二糖;X3.木三糖;X4.木四糖;X5.木五糖;X6.木六糖)。图6 TaXyn11A水解木聚糖和低聚木糖产物TLC分析结果Fig.6 TLC analysis of hydrolysis products of xylans and xylooligosaccharides by TaXyn11A
大多数GH11家族木聚糖酶水解木聚糖的产物中以低聚木糖为主,单糖含量相对较少。TaXyn11A水解特性分析结果见图6。图6(a)和图6(b)表明:TaXyn11A水解榉木木聚糖和桦木木聚糖时,反应初始15 min,产物主要为聚合度(degree of polymerization,DP)六以上的低聚木糖,随着水解时间的延长,这些低聚木糖分子逐步被水解为DP更低的低聚木糖;水解12 h后,榉木木聚糖的产物主要为木二糖(3.42 mg·mL-1)、木三糖(0.60 mg·mL-1)、木五糖和木六糖,此外还含有少量木糖(0.17 mg·mL-1),而桦木木聚糖的水解产物主要为木二糖~木六糖,其中木二糖~木四糖的质量浓度分别为2.15、0.82、0.20 mg·mL-1。榉木木聚糖和桦木木聚糖主链的木糖残基被4-O-甲基-D-葡萄糖醛酸或D-葡萄糖醛酸部分取代(取代率约为13%),因此,水解产物中木五糖和木六糖可能是带有葡萄糖醛酸侧链的低聚木糖。由图6(c)可知:TaXyn11A水解燕麦木聚糖的产物主要为聚合度2~5的低聚木糖,其中木二糖~木四糖的质量浓度分别为0.56、0.40、0.56 mg·mL-1,产物中的木五糖可能带有L-阿拉伯呋喃糖残基[24]。其他GH11家族木聚糖酶具有相似的水解特性,例如:Wu等[15]用T.thermophilus来源木聚糖酶水解桦木木聚糖,水解产物以木二糖~木六糖为主,水解燕麦木聚糖的产物主要为木二糖~木五糖;产黄纤维单胞菌(Cellulomonasflavigena)GH11家族木聚糖酶CFXyl3水解榉木木聚糖产物为木二糖~木六糖[25]。TaXyn11A不能水解木二糖和木三糖[图6(d)],但可以水解木四糖和木五糖[图6(e)和图6(f)],且水解产物以木二糖和木三糖为主,即仅有两个木糖基团和3个木糖基团主链的低聚木糖不能被该酶水解,有4个及以上木糖基团的低聚木糖主链存在时该酶才可以作用,因此推测该酶的最小水解底物是木四糖。
3 结 论
从棘孢木霉基因组中克隆得到一个GH11家族酸性木聚糖酶基因(TaXyn11A),该基因编码的蛋白质同一些已报道的GH11家族木聚糖酶氨基酸序列同源性较高,其中,与哈茨木霉的木聚糖酶xynⅡ同源性为85.2%。该基因在大肠杆菌中实现异源表达,纯酶分子质量为24.2 kDa,对燕麦木聚糖的比酶活力达到989.6 U·mg-1。重组木聚糖酶TaXyn11A具有良好的耐酸性,最适反应pH值为5.0,在pH值为4.0~10.0时保持稳定。TaXyn11A无纤维素酶活性,能特异性水解燕麦木聚糖、小麦阿拉伯木聚糖、榉木木聚糖和桦木木聚糖底物,并产生聚合度为2~6的低聚木糖,该酶在食品、饲料、低聚木糖等的生产中具有潜在的应用前景。

