燕麦蒽酰胺生理功能研究进展
郁永辉,刘柯杉,王 静
(北京工商大学 中加食品营养与健康联合实验室/食品营养与人类健康高精尖创新中心, 北京 100048)
近年来,全谷物食品对健康的作用越来越受重视,研究发现全谷物食品预防糖尿病、心脑血管疾病、癌症等常见慢性疾病的成效显著[1-2],全谷物食品比水果蔬菜具有更好的降低冠心病等发病风险的效用[3-4]。燕麦是百合纲(Liliopsida)莎草目(Cyperales)禾本科(Poaceae)燕麦属(Avena)植物,在世界各地被广泛地种植及食用,尤其在北欧、北美和我国华北地区较为常见[5]。燕麦中含有膳食纤维、蛋白质、脂质、低聚糖、维生素及矿物质等多种营养成分[6],已逐渐成为一种公认的安全健康全谷物食品。随着对燕麦的深入研究,β-葡聚糖、类黄酮、酚类化合物(如生育酚和燕麦蒽酰胺)等多种生物活性成分备受关注,且各种生物活性成分在降胆固醇[3,7]、调节肠道菌群[8]、促进脂肪代谢[9]等方面发挥重要作用。多酚类化合物是植物代谢过程中的一种次生产物[10],在燕麦中种类较多且含量丰富,可参与调控多种生理机能,具有预防慢性疾病、促进机体健康的作用[2]。燕麦蒽酰胺是燕麦中特有的一种可溶性酚类化合物[11],国内外研究均证实燕麦蒽酰胺具有抗氧化、减轻炎症反应、预防动脉粥样硬化、抗肿瘤等多种生理功能,可有效预防皮肤老化、降低冠心病、防治结肠癌等常见疾病的发生风险[12],在疾病防控方面被寄予厚望。
1 燕麦蒽酰胺的化学结构
燕麦蒽酰胺是一系列由羟基肉桂酸及其衍生物和邻氨基苯甲酸及其衍生物通过酰胺键相连接而成的酚类化合物,目前已经发现20多种不同结构的燕麦蒽酰胺[13],其主要分布在燕麦籽粒、麸皮外壳、糊粉层和叶子中[14]。燕麦蒽酰胺在燕麦中的质量分数约为2~300 mg/kg[15],其中含量较高的有3种,分别是燕麦蒽酰胺2p(N-4′-羟基肉桂酰-5-羟基邻氨基苯甲酸)、燕麦蒽酰胺2f (N-4′-羟基-3-甲氧基肉桂酰-5-羟基邻氨基苯甲酸)和燕麦蒽酰胺2c(N-3′, 4′-二羟基肉桂酰-5-羟基邻氨基苯甲酸), 即燕麦蒽酰胺A、B和C,它们分别是由5-羟基邻氨基苯甲酸中氨基的氢原子被p-香豆酸、阿魏酸和咖啡酸中的酰基所取代,经酰胺键连接而来的化合物(图1)。3种燕麦蒽酰胺的区别主要体现在肉桂酸部分苯环的3位碳上分别连接了氢原子(燕麦蒽酰胺2p)、氧甲基(燕麦蒽酰胺2f)和羟基(燕麦蒽酰胺2c),其中天然燕麦中燕麦蒽酰胺2c的含量最高[16]。研究表明:燕麦蒽酰胺通过酰胺键连接的两个苯环结构中,肉桂酸及其衍生物结构部分对于燕麦蒽酰胺的抗氧化活性影响较大[17],研究认为燕麦蒽酰胺2c的抗氧化活性最高可能是由于肉桂酸部分邻羟基结构比邻氧甲基和氢原子的抗氧化效率更高[1,18],说明燕麦蒽酰胺的生物学活性可能与其化学结构密切相关。此外,燕麦蒽酰胺与用于治疗支气管炎、过敏性鼻炎及其他过敏性疾病的药物曲尼司特[N-(3,4-二甲氧基肉桂酰)邻氨基苯甲酸]的结构十分相近[19](图 2)。大量的实验研究证明:曲尼司特的疗效主要体现在其可抑制肥大细胞和白细胞释放促炎细胞因子、趋化分子等炎性介质并调节核因子κB (nuclear factor kappa-B, NF-κB) 的活化[20],这可为燕麦蒽酰胺抗炎等生物学活性的研究提供参考。而燕麦蒽酰胺在抗氧化、减轻炎症反应、预防动脉粥样硬化及抗肿瘤等方面均发挥重要的生理功能。

图1 燕麦蒽酰胺主要成分的分子结构Fig.1 Molecular structure of main components of avenanthramides
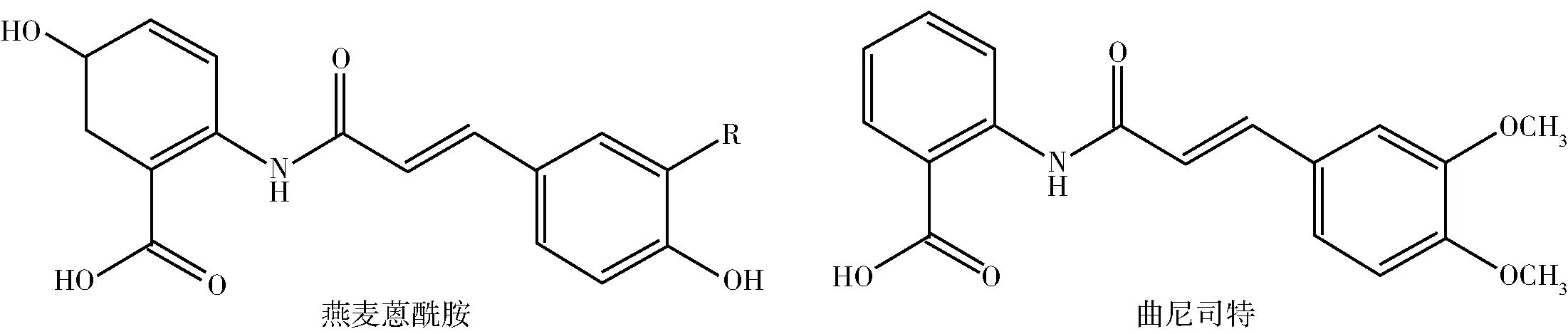
图2 燕麦蒽酰胺与曲尼司特分子结构Fig.2 Molecular structure of avenanthramides and tranilast
2 燕麦蒽酰胺的生理功能
2.1 抗氧化作用
氧化应激是自由基在体内的一种负调节反应,它可导致体内渗出的中性粒细胞在炎症区聚集,蛋白酶分泌增加,产生大量氧化产物,从而损伤组织[14,18]。研究表明:多酚类化合物具有较强的抗氧化活性,而燕麦蒽酰胺的抗氧化能力是咖啡酸、阿魏酸等燕麦中其他主要多酚类化合物的10~30倍[14]。多酚类化合物的抗氧化性主要是通过在自由基上添加氢原子进而抑制自由基链反应,从而减少活性氧化剂介导的细胞成分氧化损伤。从燕麦蒽酰胺的结构来看,自由基的清除主要取决于芳香环中的取代方式和供氢的羟基数量。研究表明:燕麦蒽酰胺的众多结构中燕麦蒽酰胺2c的抗氧化能力最强,这主要取决于燕麦蒽酰胺2c肉桂酸部分的取代基邻羟基抗氧化效果优于邻氧甲基(燕麦蒽酰胺2f)和氢原子(燕麦蒽酰胺2p)[1,14];燕麦蒽酰胺与其他常见抗氧化活性成分如咖啡酸、阿魏酸、香豆酸、α-生育酚等相比,其抗氧化活性顺序为α-生育酚>燕麦蒽酰胺>咖啡酸>阿魏酸>对香豆酸[14],虽然燕麦蒽酰胺的抗氧化活性弱于α-生育酚,但其对亚油酸氧化的抑制时间比α-生育酚更长,原因可能是燕麦蒽酰胺中肉桂酸部分的酚结构可以发生偶联反应而产生二聚体,燕麦蒽酰胺抗氧化活性的延长与其能形成二聚体结构密切相关[1];因此,燕麦蒽酰胺是燕麦多酚化合物中抗氧化活性较强且持续时间较长的重要生物活性成分。

图3 燕麦蒽酰胺抗氧化的潜在分子机制Fig.3 Potential molecular mechanism of antioxidant effect of avenanthramides
另外,燕麦蒽酰胺可与其他抗氧化剂联用并增强机体氧化防御能力。燕麦蒽酰胺与维生素C协同作用可抑制氧和酶的活性[23],从而降低低密度脂蛋白(low density lipoprotein, LDL)的氧化作用,减轻大鼠组织中氧化应激反应[24]。研究表明:燕麦蒽酰胺与维生素C之间的作用和杏仁麸皮中酚类与维生素E之间的协同作用类似,维生素E也可减少铜离子对维生素C的氧化,与维生素C一起协同保护LDL免受氧化,并增强大鼠的抗氧化能力[23, 25-26]。因此,燕麦蒽酰胺可促进机体抗氧化酶活性、清除体内ROS进而发挥抗氧化活性,是开发具有抗氧化功能保健食品的重要生物活性成分。
2.2 减轻炎症反应作用
炎症包括局部和全身性反应,是一种以红、肿、热、痛等为主要特征的身体表现,按照持续时间可分为急性炎症和慢性炎症。近年来研究发现炎症尤其是慢性炎症与多种疾病如帕金森、肿瘤等发生密切相关[27]。NF-κB蛋白家族是重要的炎症反应调节因子,其活性主要受ⅠκB激酶(ⅠκB kinase, IKK)调控[28],而燕麦蒽酰胺可减弱IKK的磷酸化、抑制NF-κB的活化而下调促炎细胞因子的表达,发挥抗炎作用。研究表明,燕麦蒽酰胺可作为下调IKKβ活性的变构抑制剂而缓解骨骼肌细胞的炎症反应[28]。在角质细胞中,燕麦蒽酰胺可抑制ⅠκB的降解、下调NF-κB活性进而降低促炎细胞因子的表达[29-30]。此外,燕麦蒽酰胺处理可抑制肿瘤坏死因子α(tumor necrosis factorα, TNF-α)诱导的NF-κB高表达,从而减少白细胞介素8(interleukin 8, IL-8)等炎性介质的释放[18];也可通过降低IL-1β诱导的TNF-α和IL-6表达,抑制单核细胞NF-κB活化来减轻机体炎症反应[28-29]。燕麦蒽酰胺衍生物同样可发挥重要的抑炎活性,燕麦蒽酰胺2c的甲基化衍生物可剂量依赖地显著下调内皮细胞中IL-6、IL-8和单核细胞趋化蛋白-1(mononcyte chemoattractant protein-1, MCP-1)等炎性介质表达[5],降低ⅠκB的磷酸化从而抑制IL-1β和TNF-α介导的NF-κB活化[30]。二氢燕麦蒽酰胺-D是以燕麦蒽酰胺为基础合成的一种物质,可通过抑制神经激肽-1受体(neurokinin-1 receptor, NK1R)或阻断IL-6在细胞中的表达而发挥抗炎止痒的作用[31]。以上研究均表明燕麦蒽酰胺及其衍生物在调控NF-κB信号通路活性及抑制炎症方面发挥重要的作用 (图4),可用于预防和缓解由炎症反应而引发的各种疾病。

图4 燕麦蒽酰胺抑制炎症反应的潜在分子机制Fig.4 Potential molecular mechanism of avenanthramides on reducing inflammatory reaction
2.3 预防动脉粥样硬化作用
动脉粥样硬化是一种具有高发病率和高死亡率特点的心血管疾病[32]。糖尿病、吸烟、肥胖[33]等多种因素均有可能诱发动脉粥样硬化。在动脉粥样硬化的发病机制中细胞因子IL-1、IL-6、IL-8、TNF和MCP-1等发挥重要作用。其中,IL-6可增强内皮细胞中细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)和E-选择素(E-selectin)的表达[30,34];IL-8能够促进血管的生成并推动病变的发生[35];而MCP-1则在早期动脉粥样硬化过程中募集单核细胞向炎症部位浸润,进一步诱发动脉粥样硬化[36]。因此,白细胞介素和TNF-α等炎症因子通过诱导炎症细胞浸润及内皮细胞表达多种细胞因子和黏附分子,从而介导白细胞向内皮下层迁移,致使炎症细胞募集并加速动脉粥样硬化斑块形成[37]。研究发现,摄入酚类化合物与降低动脉粥样硬化风险呈现正相关[30],而燕麦蒽酰胺的摄入有助于抑制促炎细胞因子分泌、降低黏附分子表达及趋化因子释放,从而预防或减轻动脉粥样硬化的相应症状[32,38]。同时,燕麦蒽酰胺混合物处理人类主动脉内皮细胞能够显著抑制黏附因子ICAM-1、VCAM-1和E-选择素的表达及细胞因子IL-6、IL-8和MCP-1的分泌[32],说明燕麦蒽酰胺可有效抑制黏附因子表达、减少炎症因子分泌及炎性细胞浸润,进而降低动脉粥样硬化斑块形成的风险,发挥预防动脉粥样硬化的生理功能。另外,与燕麦蒽酰胺结构相近的临床药物曲尼司特(图2),也具有抑制冠状动脉平滑肌增生的作用。研究表明:100 μg/mL的曲尼司特与40 μg/mL的燕麦蒽酰胺在抑制黏附分子表达及炎性介质分泌等方面效果相近,均能够下调约20% 黏附分子表达和60%炎症因子IL-6的分泌[32];这说明与曲尼司特相比,燕麦蒽酰胺在抑制黏附分子表达及炎症介质分泌等方面的有效剂量更低,其在防治动脉粥样硬化方面的作用可能优于曲尼司特。此外,燕麦蒽酰胺还能通过下调NF-κB的活性来减少动脉内皮细胞中促炎细胞因子、趋化因子和黏附分子等的表达[28]。IL-8可诱导中性粒细胞进入组织,使平滑肌细胞发生增殖、迁移,从而导致动脉粥样硬化斑块血管壁增厚、管腔变窄并增加动脉粥样硬化的风险[39]。而燕麦蒽酰胺可剂量依赖性地抑制NF-κB的活性进而下调IL-8等细胞因子的分泌、减少血管中斑块沉积,进而达到预防动脉粥样硬化的效果[40]。另外,甲基化修饰的燕麦蒽酰胺可增加气体信号分子一氧化氮(nitric oxide, NO)的产生,起到舒张血管、减少平滑肌细胞增殖的作用[15],进一步增强燕麦蒽酰胺预防动脉粥样硬化的能力。燕麦蒽酰胺可通过调控炎性因子分泌及黏附分子表达而发挥预防动脉粥样硬化的功能。此外,高血脂等是诱发动脉粥样硬化的另一危险因素,而降低血浆总胆固醇和提高高密度脂蛋白(high density lipoprotein, HDL)胆固醇水平,可降低发生动脉粥样硬化的风险。研究表明:燕麦蒽酰胺能够上调衰老小鼠脂蛋白脂肪酶mRNA的表达,降低体内甘油三酯水平、提高HDL水平,从而降低患动脉粥样硬化的风险[22]。由此可见,减少炎症介质分泌、下调黏附分子表达及降低血脂水平等是燕麦蒽酰胺发挥预防动脉粥样硬化功能的潜在途径,并在心脑血管疾病防控方面发挥重要的作用。
2.4 抗肿瘤作用
肿瘤是目前全球高发的疾病,2018年统计显示全球新发肿瘤患者1 810万,死亡960万,而我国的肿瘤发病率和死亡率均居世界首位[41-42],因此具有抗癌活性的食物或生物活性成分越来越受关注。肿瘤的发生与细胞无节制增殖密切相关,而p53、p21cip1、细胞周期蛋白-D1(cyclin-D1)和磷酸化视网膜母细胞瘤蛋白(pRb)等是重要的细胞周期调节蛋白[15],其中pRb是细胞分裂增殖过程中重要的负调节因子,也是细胞从G1周期向S周期转变的重要标志[12],而pRb受细胞分裂周期中从G1期进展到S期所必需的cyclin-D1蛋白的调控[43]。研究显示,燕麦蒽酰胺及其甲基化衍生物可显著抑制不同细胞系如血管平滑肌细胞、结肠癌细胞、肝癌细胞和乳腺癌细胞等细胞增殖[39,43],因此燕麦蒽酰胺在防控肿瘤发生方面具有潜在的重要作用。
结肠癌是胃肠道疾病中较为常见的一种恶性肿瘤,诱发结肠癌的主要因素为胃肠道的慢性炎症[44]。流行病学数据和动物研究表明:燕麦等全谷物食品的摄入可显著降低患结直肠癌的风险[44],其中燕麦蒽酰胺可能通过抑制细胞G1-S周期的信号传导进而抑制pRb蛋白活性并降低结肠癌细胞的增殖能力[43]。另外,燕麦蒽酰胺也可通过上调p21cip1的表达来抑制pRb活性,进而降低结肠癌细胞等分裂增殖活性[15, 43]。平滑肌细胞的增殖同样受p21cip1的关键抑癌蛋白和转录因子p53的调控,燕麦蒽酰胺2c的处理可增加p53-p21cip1通路相关蛋白表达,使细胞周期停滞于G1期,进而影响细胞增殖[12,15]。燕麦蒽酰胺2c也可呈剂量依赖性地增加平滑肌细胞中NO的生成,促进 p53蛋白表达,并最终诱导细胞凋亡[39]。此外,燕麦蒽酰胺2c及其甲基化衍生物均能抑制人结肠癌细胞系HT29、LS174T和HCT116等肿瘤细胞增殖,且燕麦蒽酰胺的甲酯衍生物呈现出更好地抑制效果,其作用机制可能是通过促进p53/p21cip1表达或抑制cyclin-D1/pRb蛋白活性等诱导肿瘤细胞凋亡[43],从而发挥抗肿瘤活性。最新研究也显示,燕麦蒽酰胺2p可通过上调miR-129-3p活性进而抑制E3泛素化Pirh2表达,并激活p53信号通路,致使细胞周期出现永久性停滞,最终抑制结肠癌细胞生长并诱导其衰老死亡[45]。
燕麦蒽酰胺也可与其他抗癌物质协同作用而抑制肿瘤细胞增殖,结肠癌细胞Caco-2和肝癌细胞HepG2是两种恶性肿瘤细胞系,燕麦蒽酰胺可在不影响正常细胞增殖的前提下,与其他抗癌物质协同抑制Caco-2细胞的增殖[43],同时燕麦蒽酰胺与牡荆素-2-O-木糖苷两种物质可以通过调节ROS浓度诱导细胞凋亡,单独或联合使用均可促进Caco-2和HepG2细胞凋亡[46]。此外,环氧合酶-2(cyclooxygenase-2, COX-2)在80%~85%的人类和小鼠腺癌、结肠肿瘤中均高表达[47],同时COX-2-前列腺素E2(PGE2)信号通路介导胃肠道上皮癌变,促进与癌变细胞增殖、扩散相关的血管新生[48],说明COX-2在癌症发生过程中发挥重要的促进作用。而燕麦蒽酰胺可下调脂多糖诱导的小鼠腹腔巨噬细胞COX-2酶活性,抑制PGE2的生成[43]。上皮-间质转化(epithelial-mesenchymal transition, EMT)被认为是引发上皮来源的恶性肿瘤的重要因素。天然来源的燕麦蒽酰胺和酵母衍生的重组蒽酰胺均可抑制EMT发生[44],从而发挥抑制肿瘤发生的潜在作用。而酵母衍生的重组蒽酰胺还可抑制细胞周期蛋白cyclin-D1表达,且其比天然燕麦蒽酰胺的抗增殖活性更强,并对EMT过程中细胞迁移的抑制效果更加显著[44]。综上所述,燕麦蒽酰胺可通过阻滞细胞周期和/或促进细胞凋亡等途径抑制肿瘤发生或肿瘤细胞增殖,是化学预防和治疗肿瘤的潜在重要活性成分。
3 研究展望
燕麦作为一种新兴的廉价易获得的谷物,其保健功能越来越得到认可。燕麦蒽酰胺作为燕麦中独特的可溶性多酚类化合物,研究已揭示其在抗氧化、预防心脑血管疾病、缓解炎症、抗肿瘤等多方面具有重要的生物学效应。同时,多酚类化合物在降血糖、调节血脂以及骨质疏松防控等方面也发挥重要的作用,报道显示多酚化合物有助于保护胰岛细胞、促进胰岛素分泌,从而调控血糖[49];可参与机体脂肪代谢及肠道菌群调控并发挥降血脂作用[50];也可有效调控骨髓间充质干细胞分化并预防骨质疏松[51]。因此,应借鉴多酚化合物研究中所发现的生理功能,开展广泛的研究并揭示燕麦蒽酰胺在降血糖、调控血脂、骨质疏松防控及肠道菌群调节等方面的潜在作用,以期更全面深入地了解燕麦蒽酰胺的生理功能。而与燕麦蒽酰胺结构相近的药物曲尼司特在治疗哮喘和抗组胺分泌等方面效果显著,最新研究也发现燕麦蒽酰胺在体内和体外均具有较好的抗过敏活性[52],有望用于过敏人群的饮食治疗,进而有助于开发抗过敏类的保健食品。因此,进一步全面、深入地研究并揭示燕麦蒽酰胺的生物学活性,将为含燕麦蒽酰胺的全谷物食品开发奠定良好的基础,充分发掘其在预防和缓解高血糖、高血脂及骨质疏松等相关慢性疾病方面的重要潜在作用。此外,研究结构修饰或化学合成的燕麦蒽酰胺如二氢燕麦蒽酰胺、甲基化燕麦蒽酰胺等有利于拓展燕麦蒽酰胺的来源,为实现燕麦蒽酰胺的工业化生产及营养保健食品的开发利用奠定基础。

