浅谈高中化学盐类水解规律及其解题应用
邱润容
(江西省赣县中学 341100)
一、盐类水解规律
1.“谁强显谁性”
在高中化学知识的学习中,盐类水解是较为基础且重要的知识.盐类水解的实质便是盐中的弱碱阳离子或弱酸阴离子与水电离后的OH-或H+结合生成难电离的分子或离子.“谁强显谁性”便是盐类水解中的一个规律,即只要盐中存在弱碱阳离子或弱酸阴离子,那么该盐类就会进行水解,产生离子,从而判断溶液的酸碱性.在解题时,学生们可以根据已知的这一规律,对问题中的盐溶液进行判断,达到解出题目答案的目的.
2.“有弱就水解”
“有弱就水解”也是盐类水解的规律之一,盐中存在的离子所对应的酸或碱越弱,那么水解就会越彻底.并且,在盐类水解的知识内容中,水的电离平衡也会影响溶液的pH:起初,水的电离正处于平衡状态,但是当其平衡被破坏的程度越大时,溶液的pH也会随之越大.该规律可以用于判断盐溶液的pH和电解质的相对强弱.在教学时,教师们应当重点培养学生的应用能力,引导学生们在解题时运用已知的客观规律,有效求解题目.
二、盐类水解应用
1.盐溶液酸碱性的分析与判断
盐类水解问题中对盐溶液酸碱性的判断需要依据其规律进行分析:谁强显谁性,同强显中性,即强碱弱酸盐显碱性、强酸弱碱盐显酸性、强酸强碱盐显中性.为了使得学生们能够迅速判断出问题所给出盐溶液的酸碱性,教师们需要在日常教学中就引导学生们熟记盐溶液酸碱性判断的规律.在例1的求解中,学生只需要掌握判断规律,就能够轻易将题目求解得出.
例1在正常室温下,下列说法中,有关于0.10mol·L-1的氨水说法正确的是( ).
A.与AlCl3溶液发生反应时,离子方程式为

C.用HNO3溶液完全中和后,溶液不显中性
D.溶液pH为13

2.比较溶液中离子浓度大小
在化学考试中,经常考察学生盐类水解中离子浓度大小的问题.在该部分知识的考察中,学生们需要考虑到水解理论、电离理论、电荷守恒与物料守恒.如果在解题时,仅仅考虑一部分,那么题目就有可能无法解答准确.所以,在相关题目的练习时,教师们需要让学生们先根据“无弱不水解,越弱越水解”的规律对题目进行判断,写出溶液中存在的所有离子.接着,再让学生们根据电荷守恒与物料守恒明确溶液中各离子之间的等量关系,从而得出各离子浓度,最后进行比较.
例2正常室温下,将一元酸HA溶液与KOH溶液等体积混合,进行相应的实验,见下表:
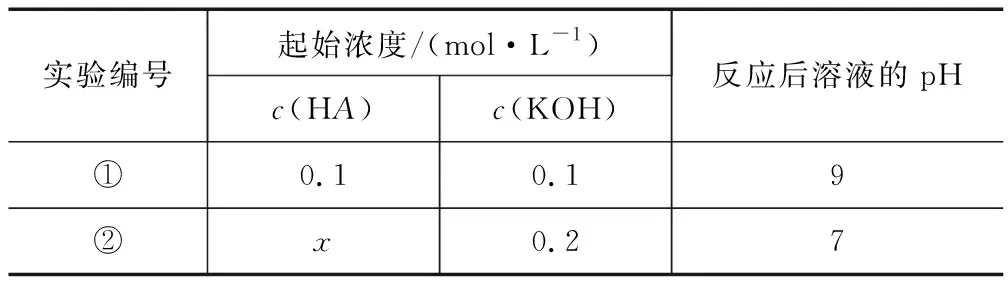
实验编号起始浓度/(mol·L-1)c(HA)c(KOH)反应后溶液的pH①0.10.19②x0.27
下列说法不正确的是( )(忽略体积变化).
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)

3.比较溶液中离子种类的多少
在有关离子种类多少的比较中,教师们需要在练习教学时让学生们能够清楚盐类水解平衡的影响因素,及规律中的“越热越水解,越稀越水解”.水解反应中温度可以使平衡进行左右移动,同时,改变平衡体系中的任意一种物质的浓度,也可以使平衡进行移动.其中升温水解程度增大,物质浓度缩小也会使水解程度增大.教师们可以利用例3对这部分知识进行具体教学.
例3NaHSO3溶液显酸性,并且,溶液中具有以下平衡:

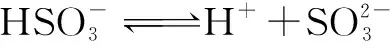
向0.10mol·L-1的NaHSO4溶液中分别加入以下物质,下列选项正确的是( ).




综上所述,盐类水解知识在高中化学学科中具有一定的难度,学生对该部分知识的掌握也存在困难.所以化学教师们需要以培养学生自主学习能力为教学目标,引导学生进行一定量的专项训练,促使学生们能够加强盐类水解知识的内化程度,从而在解题时,能够得心应手而不是手足无措,瞎选一通.高中化学教师们需要重点提升学生解题的能力,使得学生们能够夯实基础,不断提升与发展.

