巧判江苏化学高考平衡图像题中的熵变与焓变
张 磊 周兴璐
(1.江苏省锡山高级中学 214174;2.江苏省无锡市藕塘中学 214153)
化学平衡和速率的图像/表格类试题是一种特殊题型,它有一个十分明显的特点:通过直观、简洁、形象的曲线或数据将所要考查的知识蕴藏在图像或表格中,学生必须先要学会分析图像和表格,才能更好的解答此类题目.该类试题包含的信息容量比较大,对学生能力要求比较高,随着高考的不断改革以及对学科能力学科素养要求的不断提高,这种数形结合的试题将逢考必现.
对2009~2019年这11年江苏省新高考化学卷中出现的有关化学平衡图像在高考中出现的题号进行统计,其结果见表1.

表1 2009 ~ 2019 年江苏省高考化学卷中有关化学平衡的题号
一、问题提出
在苏教版高中化学选修《化学反应原理》专题2,第二单元和第三单元开始接触化学平衡,其中提到化学平衡状态是指在一定条件下的对峙反应,当正反应速率等于逆反应速率且不为零时(v正=v逆≠ 0),反应混合物体系中每一种物质的生成与消耗相同,各组分的含量不在改变时,体系处在一种动态平衡的状态,当外在因素( 如温度、浓度或压力) 发生变化时,化学平衡状态随之发生移动,移动的方向可根据勒夏特列原理进行判断.
在学习“化学平衡状态移动”之前,学生已经学会如何判断化学反应的方向,即通过“熵”判据,熵增有利于反应的自发,“焓”判据,反应放热有利于自发,所以利用熵与焓的综合判据即ΔG=ΔH-TΔS化学反应的方向,如果ΔH<0,ΔS>0,则ΔG<0一定自发;如果ΔH>0,ΔS<0,则ΔG>0一定非自发;如果ΔH<0,ΔS<0或者ΔH>0,ΔS>0,则有可能自发,但利用焓变与熵变判断化学反应方向和其他知识点的相关性不大,考查往往比较局限.在化学平衡图像/表格这类题型中,常常会让学生判断反应方程式的焓变与熵变,那能否通过这样一个化学热力学基础理论知识对化学平衡移动题中的一些信息作出判断呢?如果将两者相结合,既可体现利用焓与熵判断化学反应方向的考查,又能轻松的解决化学平衡中的难题,让学生学以致用有利于化学学科素养的培养,因此对此问题很有必要进行深入研究,为了得到比较好的结果,现举例论证.
二、高考真题分析
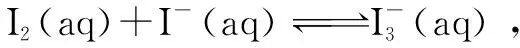

图1

B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
考点分析考查化学平衡中的浓度-温度(c-T)图像分析问题,主要考查焓变、勒夏特列原理、化学平衡常数及化学平衡的移动等相关知识.



表2 反应过程中测定的部分数据
下列说法正确的是( ).
A.反应在前50s的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应ΔH<0
C.相同温度下,起始时向容器中充入1.0mol PCl3、0.20mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
考点分析本题属于化学平衡问题,考查学生对速率,平衡常数,平衡移动等概念的理解与计算.



图2

B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
考点分析本题属于化学平衡中的浓度-温度-压强(c-T-p)图像分析问题,主要考查化学反应与能变变化,熵变、焓变、勒夏特列原理、等效平衡知识.
答案解析选项A.方法一:根据常见的吸热反应可知,C和CO2反应是吸热反应,故ΔH>0,故A错误;
方法二:根据题中图像可知,图中为起始投料不同且达到平衡时CO2的物质的量浓度c(CO2)随温度的变化,要判断反应是吸热还是放热反应,要看温度对反应平衡的影响,采用控制变量法保持其他变量相同,即选择其中任意一条曲线分析;随着温度的升高,CO2平衡后的物质的量浓度减小,平衡向正反应方向移动;通过勒夏特列原理可以知道,升高温度平衡向吸热方向移动,即正反应为吸热反应;说明:C和CO2反应是吸热反应,ΔH>0 ,所以A错误.


表3 在3个容量密闭容器中反应过程测定的部分数据
A.该方应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大
考点分析本题考查化学反应速率的影响,涉及等效平衡问题,为高频考点,侧重于学生的分析能力的考查,题目难度不大,但易错,答题时注意把握反应的特点以及平衡的影响因素.
答案解析选项A.对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH浓度较低,说明升高温度平衡逆向移动,由勒夏特列原理可知,升高温度应该向减弱这一条件的方向移动吸热方向,即逆反应为吸热反应,正反应为放热反应,故A正确.
例5(2019江苏卷第15题)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图3中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化).下列说法正确的是( ).

图3

B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K>2000
考点分析本题考查问题为化学平衡中的转化率-温度(α-T)图像分析,主要考查转化率、焓变、勒夏特列原理、化学平衡状态相关知识.
答案解析选项A.图中虚线为该反应NO的平衡转化率,可知升高温度,NO的平衡转化率降低,平衡逆向移动,根据勒夏特列原理,升高温度,平衡应该向着减弱这一条件的方向移动吸热方向,即逆反应为吸热反应,故正反应ΔH<0,所以A错误.
三、依托真题,巧解难题
由例1-例5,不难发现每当遇到这样的问题不论学生还是教师都会从勒夏特列原理角度分析,先判断化学平衡后改变温度或者压强,根据平衡移动方向决定反应的焓变和熵变.但是如果利用焓与熵的关系作为判断依据,来判断化学反应的焓变与熵变时,就显得异常轻松,一道难题就迎刃而解.
ΔG<0肯定自发,ΔG>0肯定不自发,如果ΔG=0时,化学反应将会处于化学平衡状态;如果ΔG=0,则有两种可能ΔH<0,ΔS<0或者ΔH>0,ΔS>0,这样对于给定的可逆反应达到平衡时的化学方程式,很容易可以判断出反应的熵变,那焓变也呼之欲出了,文章中所选择的五道例题正是可以利用这一规律判断反应熵变和焓变.





综上,虽然江苏新高考11年以来,每年都会涉及到焓变的判断,但只有这五年的可以这样去分析,因为需要满足一定的条件即可以很明确的判断出熵变,只要条件允许,无论图像分析起来有多困难,都能够利用焓变和熵变之间的相互关系,直接得出准确的结论.这也为学生解题提供了一种新的分析思路,将所学得以运用和发扬;当然也遇到过一些不满足这一条件的平衡题目,变相说明不满足这一条件的题目在热力学上是不予支持的,为教师日后出题提供了一种检验的方法.

