白蛋白结合型紫杉醇用于HER2 阴性晚期胃癌一线化疗中的疗效分析
司海燕,苟苗苗,赵海清,张 勇,戴广海
解放军总医院第一医学中心 肿瘤内科,北京 100853
胃癌是我国第二大常见癌症和第二大癌症死亡原因[1]。尽管晚期胃癌的预后较差,但几种细胞毒性药物如氟嘧啶( 氟尿嘧啶、卡培他滨和替吉奥胶囊)、铂类药物( 顺铂和奥沙利铂)、紫杉烷类药物( 紫杉醇、多西他赛)、蒽环类药物表柔比星和拓扑异构酶抑制剂伊立替康均可改善预后[2]。美国国立综合癌症网络(NCCN) 指南推荐DCF 方案( 多西他赛+ 顺铂+5-FU) 和ECF 方案( 表阿霉素+ 顺铂+ 氟尿嘧啶) 作为晚期胃癌的一线化疗[3-4]。但是,对于体能状态良好的患者,可使用细胞毒性药物的三联用药方案。尽管紫杉醇和多西他赛对胃癌和其他实体瘤表现出显著活性,但存在肝毒性、超敏反应和周围神经病等不良反应,需要疗效更好、毒性更低的化疗药物治疗胃癌患者。纳米白蛋白结合型紫杉醇(nab-PTX) 是一种新型紫杉醇,可借助PTX 与白蛋白的结合来解决PTX 溶媒问题,从而使其溶于0.9% 氯化钠注射液,并且不需要针对溶剂引起的超敏反应进行预先用药[5]。Ⅱ期临床试验中,白蛋白结合型紫杉醇二线治疗胃癌患者显示出良好的抗癌活性和可耐受的毒性[6]。但在临床实践中,nab-PTX 一线治疗晚期胃癌的安全性和生存获益尚不清楚。基于这一背景,我们在这项回顾性研究中评价了白蛋白结合型紫杉醇一线治疗晚期胃癌患者的临床安全性和有效性。
资料和方法
1 资料 选取 2011 年 12 月 17 日 - 2018 年 1 月10 日于解放军总医院第一医学中心接受nab-PTX一线化疗的44 例胃癌患者。入选标准:1) 经手术或活检从组织学上证实患有胃癌的HER2 阴性患者;2) 无法通过手术切除的晚期胃癌,且至少有一个可测量病灶;3) 美国东部肿瘤协作组(ECOG) 体能状态评分为0 或1 ;4) 有、无胃造瘘均可;5) 有血常规、肿瘤生物标志物和肝肾功能指标;6) 治疗前签署了化疗知情同意书。
2 治疗 白蛋白结合型紫杉醇在每个周期的第1 天或每个周期的第1 天和第5 天以平均300 ~ 500 mg的剂量在30 min 内静脉给药,每个周期为3 周,严重不良反应或患者不耐受,治疗可延迟。Nab-PTX 是否与其他药物联合使用由医生根据患者总体健康状况决定。
3 有效性( 进期疗效) 评估 患者随访至出现疾病进展/ 死亡或因毒性不耐受而延迟治疗,随访至2018 年4 月10 日。每两个周期通过影像学和计算机断层扫描技术评价疾病进展和新病灶出现情况,并根据实体瘤疗效评价标准(RECIST1.1) 评估肿瘤缓解,包括完全缓解(CR)、部分缓解(PR)、病情稳定(SD) 和疾病进展(PD)。疾病控制率(disease control rate,DCR) 定义为客观缓解率+ 稳定率(CR+PR+SD)。客观缓解率(objective response rate,ORR)定义为CR+PR。
4 安全性评估 根据美国国家癌症研究所通用毒性标准4.0 版(CTC4.0),在每个周期评价毒性。在每个化疗周期的治疗前1 d 采集患者的常规血样。并根据美国国家癌症研究所不良事件通用术语标准(NCI-CTCAE,3.0 版) 对化疗诱发的白细胞减少 症 (chemotherapy-induced leukopenia,CIL) 分级 如 下 :CIL 1 级 (4×109/L ~ 3×109/L)、CIL 2 级(3.0×109/L ~ 1.0×109/L)、CIL 3 级 (2.0×109/L ~1.0×109/L) 和 CIL 4 级 ( < 1.0×109/L)。 根 据 CIL的发生时间,将早发白细胞减少症定义为治疗42 d内发生的2 ~ 4 级白细胞减少症,晚发白细胞减少症定义为治疗42 d 后发生的CIL。在每个周期检测肿瘤标志物CEA 和CA199,以治疗期间的最高水平作为CEA 和C199 的水平。
5 生存影响因素分析 主要终点为PFS,定义为从开始nab-PTX 治疗至疾病进展或死亡的时间。次要终点为OS,定义为从开始nab-PTX 治疗至任何原因导致死亡或末次随访时间。
6 统 计 学 分 析 采 用 SPSS18.0 版 (SPSS Inc.,Chicago,IL,美国) 进行统计分析。计量资料( 主要是时间序列的生存资料) 以中位数Md(IQR) 表示,计数资料以百分比表示。采用Kaplan-Meier 方法及log-rank 检验进行生存分析( 单因素分析),并基于单因素分析结果构建Cox 多因素回归模型并计算风险比(HR)。P<0.05 为差异有统计学意义。
结 果
1 患者一般资料 最终分析共纳入44 例患者,包括 34 例男性、10 例女性,中位年龄 57(28 ~ 85) 岁。其中19 例(38.6%) 接受了胃造瘘术。组织学类型中分化17 例(38.6%),低分化27 例。转移部位肝15 例、肺4 例、淋巴结19 例、骨3 例、腹膜6 例。33 例接受白蛋白结合型紫杉醇联合化疗药物替吉奥胶囊作为一线治疗,11 例接受白蛋白结合型紫杉醇联合顺铂作为一线治疗。白蛋白结合型紫杉醇起始剂量 :260 mg/m2(30 例 )、220 mg/m2(9 例 )、180 mg/m2(5 例 )。 平 均 相 对 剂 量 强 度 为 91.4%(61.5% ~ 100.0%)。22 例中位 CEA 水平< 5 μg/L,其余≥5 μg/L。见表1。
2 疾病缓解及生存情况 被研究患者中,无完全缓解 (CR),18 例 (40.9%) 获得部分缓解 (PR),22例(50%) 疾病稳定(SD),4 例(9.1%) 发生疾病进展(PD)。ORR 为 40.9%,DCR 为 90.9%,见表 2。随访结果显示:中位无进展生存期(progression free survival,PFS) 为 5.1 个月 (95%CI:3.9 ~ 6.3),中位总生存期(overall survival,OS) 为14.1 个月(95%CI:10.7 ~ 14.5)( 图 1)。
3 化疗不良反应 最常报告的≥3 级血液学不良事件为白细胞减少症 (n=7,15.9%),1 ~ 2 级血液学不良事件为白细胞减少症(n=32,72.7%)。但没有患者死于该不良事件。最常见的不良反应为恶心和呕吐(n=16,36.3%)、 手足综合征(n=10,22.7%)、 厌 食 症 (n=10,22.7%)、 疲 乏 (n=9,20.4%)、脱发(n=9,20.4%)、外周感觉神经病(n=6,13.6%)。除外周感觉神经病外,大多数不良事件均可控制。研究期间未发生严重超敏反应( 表3)。

表1 晚期胃癌患者临床特征(n=44)Tab. 1 Clinical characteristics of the HER2-negative advanced gastric cancer patients (n=44)

表2 晚期胃癌一线化疗肿瘤缓解率及生存期(n=44)Tab. 2 Remission rate and survival of advanced gastric cancer treated with first-line chemotherapy (n=44)

表3 Nab-PTX 化疗方案不良事件分析(n, %)Tab. 3 Analysis of adverse events (n, %)
4 治疗后生存影响因素分析 1) 单因素分析:与少于4 个治疗周期的患者相比,≥4 个治疗周期的患者PFS 获益更好( 中位PFS 为3.5 个月vs6.9个月,P=0.001,表3),但中位OS 差异无统计学意义 (P=0.252) ;0 ~ 2 级 CIL 与 PFS(P< 0.06) 和 OS(P<0.01) 延长显著相关。中位CEA 水平<5μg/L和早发CIL的患者OS延长(P=0.046,P=0.035)(表4)。2) 多因素Cox 回归:分析显示,治疗周期≤4 个周期的患者与治疗周期>5 个周期的患者PFS 有统计学差异 (HR=0.19,95%CI=0.08 ~ 0.42,P<0.01)。与 3 ~ 4 级化疗诱发的 CIL 相比,0 ~ 2 级CIL 是PFS 延长的预测因子(HR=2.73,95%CI=1.00 ~ 7.46,P< 0.05)( 表 3)。 尽 管 PFS 无差 异,但nab-PTX 联合顺铂的OS 长于nab-PTX 联合替吉 奥 胶 囊 (HR=0.513,95%CI=0.31 ~ 0.84,P<0.01)。与晚发CIL 相比,早发 CIL 预示 OS 延长(HR:2.48,95%CI=1.13 ~ 5.42,P=0.02)( 表 5)。
讨 论
2005 年,一项针对乳腺癌的Ⅲ期试验显示,与标准紫杉醇相比,纳米白蛋白结合型紫杉醇更安全有效[7]。2012 年,美国食品药品监督管理局(FDA) 批准白蛋白结合型紫杉醇联合卡铂作为晚期NSCLC 的一线治疗药物[8]。对于转移性胰腺癌患者,标准治疗为白蛋白结合型紫杉醇联合吉西他滨,因为该联合治疗显著改善了OS、PFS 和ORR,同时无危及生命的毒性[9]。有研究表明,白蛋白结合型紫杉醇对卵巢癌、前列腺癌和头颈癌也有良好的效果[10]。

图 1 白蛋白结合型紫杉醇治疗晚期胃癌患者中位PFS/OS的生存曲线Fig. 1 Kaplan-Meier curve of PFS/OS in patients with advanced gastric cancer treated by nab-PTX

表4 Nab-PTX 一线治疗晚期胃癌患者的PFS 的影响因素分析Tab. 4 Influencing factors of PFS in the patients with advanced gastric cancer treated by nab-PTX
本研究中,入组了44 例HER2 阴性的晚期胃癌患者,生存获益结果为中位PFS 为5.1 个月(95%CI:3.9 ~ 6.3),中位 OS 为 14.1 个月 (95%CI:10.7 ~14.5)。一项对比紫杉醇与多西他赛作为晚期胃癌一线化疗的随机Ⅱ期试验显示,PFS 分别为3.6 个月和 4.2 个月 (P=0.92),OS 分别为 9.9 个月和 9.3个月(P=0.42)[11]。在V325 的研究报告中,DCF 组的中位 TTP 显著长于 CF 组 (5.6 个月,95%CI:4.9 ~5.9 ;3.7 个月,95%CI:3.4 ~ 4.5,HR=1.47,P<0.01) ;DCF 组的中位 OS 显著长于 CF 组 (9.2 个月,95%CI:8.4 ~ 10.6 ;8.6 个月,95%CI:7.2 ~ 9.5,HR=1.29,P< 0.02)。在中国进行的 DCF 改良版的多中心Ⅲ期研究中,与CF 方案相比,mDCF 方案显著改善了PFS 和OS :中位PFS 分别为4.9 个月和 7.2 个月 (HR=0.58,P=0.001),中位 OS 分别为 8.5 个月和 10.2 个月 (HR=0.71,P=0.032)[12]。研究报告,多西他赛+ 替吉奥胶囊组的无进展生存期为 5.3 个月 (HR=0.77,95%CI:0.65 ~ 0.90,P<0.001),总生存期为 12.5 个月 (HR=0.84,95%CI:0.71 ~ 0.99,P=0.032)[13]。PFS 差异的原因可能是上述研究入组患者数量较少和( 或) 临床试验患者的化疗耐受性更好( 排除了病情较差患者)。上述试验中,其他治疗方案的PFS 优于本研究,但本研究的OS 更长,可认为nab-PTX 联合治疗可影响后期缓解。因此,需要进行进一步的前瞻性研究来验证。本研究患者的客观缓解率40.9% 低于mDCF方案的 48.7%(95% CI :39.5 ~ 58.1),但不能得出它们有显著差异的结论[12]。
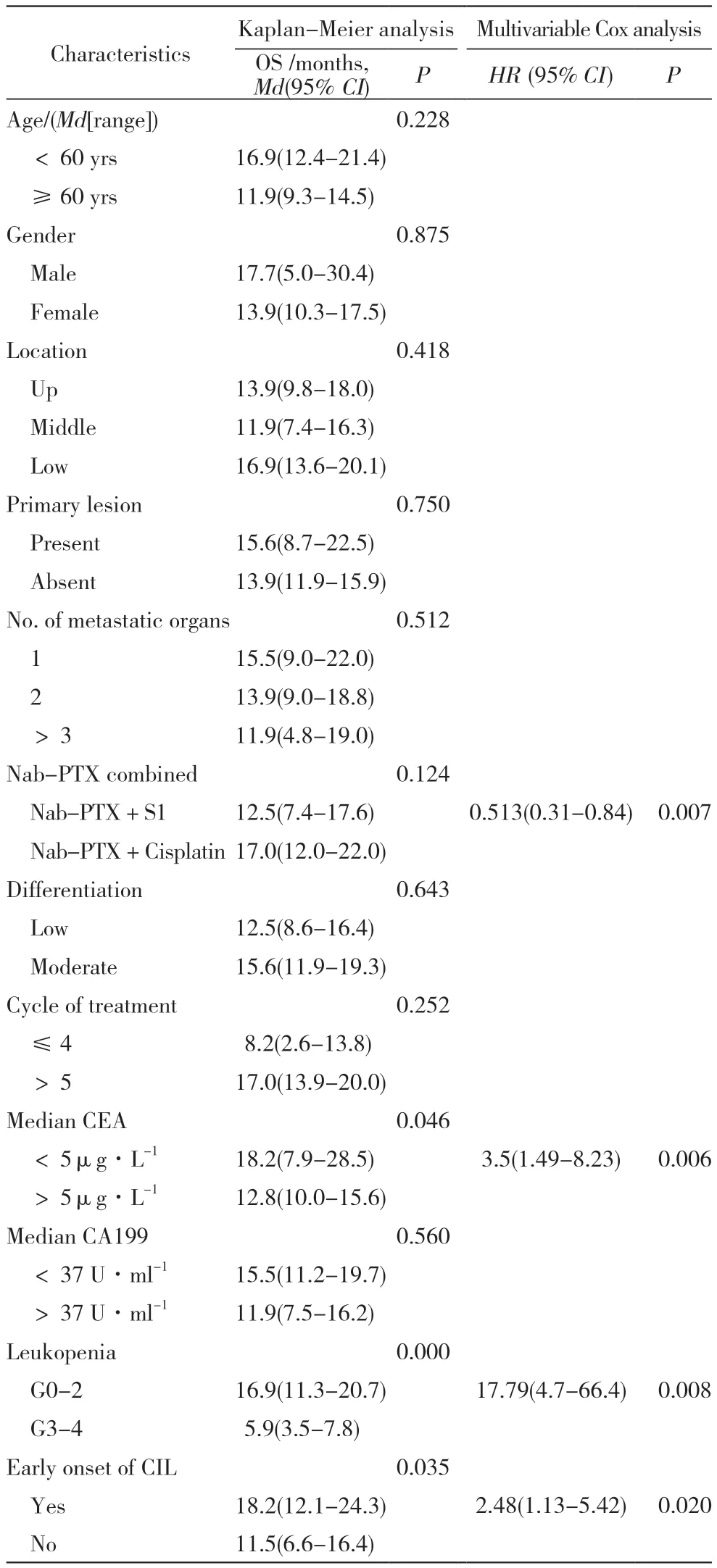
表5 Nab-PTX 一线治疗晚期胃癌患者的OS 的影响因素分析Tab. 5 Influencing factors of OS in the patients with advanced gastric cancer treated by nab-PTX
本研究发现,不同的年龄、性别、肿瘤部位、手术与否、转移器官数量、组织学类型患者的PFS 无统计学差异,与少于4 个治疗周期的患者相比,接受4 个以上周期治疗的患者PFS 获益显著 (HR=0.19,95% CI :0.08 ~ 0.42,P < 0.01)。该PFS 结果与nab-PTX 二线治疗晚期胃癌的前瞻性研究相似,但OS 与之相比没有改善[5]。本研究数据还表明,早发CIL 和CIL 的程度与预后改善相 关 (HR=2.48,95% CI :1.13 ~ 5.42,P=0.023 和HR=17.79,95% CI :4.7 ~ 66.4,P < 0.01)。众所周知,化疗诱发的中性粒细胞减少症是化疗药物最重要的剂量限制性毒性之一,通常需要降低初始剂量[14]。因此,监测接受化疗患者的中性粒细胞减少症可能有助于改善药物疗效和生存期[15]。根据本研究结果,0 ~ 2 级CIL 和早发CIL 预示疗效更好。
在Cox 分析中,nab-PTX+ 顺铂方案组总生存期大于nab-PTX+ 替吉奥胶囊组(HR=0.513,95%CI=0.31 ~ 0.84,P < 0.01),而 PFS 无统计学差异 (5.3个月vs 5.1 个月,P=0.931)。目前尚无这两种方案治疗晚期胃癌的Ⅲ期研究。此外,nab-PTX+ 顺铂组患者为11 例,明显少于nab-PTX+S1 组,这可能导致偏倚。本组中位CEA <5μg/L 意味着更好的总生存期。Meta 分析显示,治疗前血清CEA 水平升高与胃癌预后不良以及胃癌患者死亡风险有关[16]。Nab-PTX 方案可使 CEA < 5μg/L 患者获益。
本研究中,最常见的1 ~ 2 级毒性为白细胞减少症,发生率为72.7% ;3/4 级白细胞减少症发生率为15.9%,低于mDCF 研究中的3/4 级不良反应发生率65%[17];未发现贫血和血小板减少症等3/4级毒性反应,表明nab-PTX 方案在疗效不受影响的情况下减少了血液学毒性。其他不良反应为恶心和呕吐、厌食症、脱发、疲乏、周围神经病,与mDCF 方案相比发生率较低。本研究报告1 例3 ~ 4级感觉神经病。在乳腺癌中,标准紫杉醇175 mg/m2方案引起的3 级感觉神经病的发生率与nab-PTX相 似 ( 分 别 为 2% 与 2.3%)[7]。22 例 接 受 白 蛋 白结合型紫杉醇治疗的晚期胰腺癌患者中有9 例(40.9%) 出现感觉神经病[18]。在白蛋白结合型紫杉醇作为胃癌二线化疗的研究中,感觉神经病的发生率高于本研究,该研究有34 例(91.9%) 患者出现 1 ~ 2 级感觉神经病,2 例 (5.4%) 患者出现 3 级感觉神经病变[5]。
本研究存在一些局限性。首先,本研究为回顾性研究,仅纳入有限数量的患者。因此,还须前瞻性随机大样本研究中确认nab-PTX 的安全性和有效性。其次,随访时间不足。
综上,我们认为nab-PTX 方案使得更多晚期胃癌患者有更好的临床OS 获益。

