局部进展期中低位直肠癌患者术前同期加量调强放疗联合化疗的疗效观察
曾铭玥,冯林春,贾宝庆,杨咏强,刘其腾,陈 静,王运来
1 解放军总医院第一医学中心 放射治疗科,北京 100853 ;2 解放军总医院第一医学中心 普通外二科,北京 100853 ;3 苏州大学附属第二医院 放射治疗科,江苏苏州 215004 ;4 首都医科大学附属潞河医院放射治疗科,北京 101149
局部进展期直肠癌标准治疗模式为术前同步放化疗或短程术前放疗+ 全直肠系膜切除术(total mesorectal excision,TME)+ 辅助化疗。 该治疗模式改善了直肠癌的局部控制率,5年局部复发率降至5% ~ 10%,然而未能显著提高总生存(overall survival,OS) 和 无 病 生 存 (disease-free survival,DFS)。目前常规长程同步放化疗在临床应用的放疗剂量分割模式:直肠肿瘤原发病灶及高危复发区域和区域淋巴引流区45.0 ~ 50.4 Gy,分25 ~ 28次 (1.8 ~ 2.0 Gy/ 次,5 次 / 周 )。近年来国内外多项研究表明,提高肿瘤局部照射剂量,可获得更高的病理完全缓解(pathological complete response,pCR) 率,达到pCR 患者与未达pCR 患者相比提高了总生存率、无病生存率,且局部复发率明显降低[1-6]。调 强 放 疗(intensity-modulated radiation therapy,IMRT) 技术可提高靶区的适形性,在减轻不良反应的同时可实现肿瘤局部同期加量照射(simultaneous integrated boost intensity-modulated radiation therapy,SIB-IMRT)。相关研究显示SIB-IMRT 技术在直肠癌术前同步放化疗的不良反应完全可耐受[7-9]。本团队前期开展的直肠癌术前同期加量与不加量静态调强放疗的研究结果表明,直肠癌术前SIBIMRT 56.25 Gy 和IMRT 50 Gy 计划的靶区处方剂量和危及器官剂量限制要求均可满足,两者的计划靶区(planning target volume,PTV) 适形指数、小肠及骨盆受量情况均无统计学差异,SIB-IMRT 56.25 Gy计划的膀胱V40 和股骨头V30、V40 较IMRT 50 Gy计划略高,但可以满足临床要求[10]。本研究对局部进展期中低位可手术切除直肠癌患者应用SIBIMRT 技术放疗联合希罗达同步化疗,放化疗结束后6 ~ 10 周患者接受全直肠系膜切除术。通过临床观察及随访,探讨直肠癌新辅助放化疗后的pCR 率、保肛率、OS、不良反应及安全性等。
对象和方法
1 研究对象 选取 2012 年 2 月 - 2013 年 5 月解放军总医院第一医学中心确诊为局部进展期中低位可手术切除直肠癌患者。纳入标准:1) 年龄18 ~75 岁;2) 肿瘤下缘距离肛缘<10 cm ;3) 盆腔MRI检查经临床分期为T3-4/N+M0 ;4) 活检病理确诊为直肠腺癌;5) 无严重合并症;6)KPS 评分≥70,预计生存期>6 个月;7) 无既往腹、盆腔放疗史及化疗史。所有患者均签署临床试验知情同意书。至2013 年5 月共纳入19 例符合入组标准患者,年龄34 ~ 70 岁,中位年龄为57 岁,其中女性3 例,男性16 例。肿瘤下缘距肛缘3 ~ 8 cm,中位距离4.42 cm。病理诊断为中分化腺癌11 例,未分类6例,中- 低分化腺癌、高分化腺癌各1 例。T2 期1 例,T3 期 16 例,T4 期 2 例。N0 期 8 例,N1 期7 例,N2 期 4 例。见表 1。
2 同步放化疗方案 放疗方案:1) 做膜定位:定位前1 h 要求患者排空膀胱,喝1 000 ml 水充分充盈膀胱,定位时采用仰卧位,热塑体模固定,行增强CT 扫描,扫描层厚为5 mm,CT 定位机为荷兰Philips Brilliance。2) 靶区勾画:参照ICRU 50号和62 号报告[11-12]。大体肿瘤靶区(gross tumor volume,GTV) 定义为影像学上可见的直肠原发病灶及盆腔阳性淋巴结,计划大体肿瘤靶区(planning gross tumor volume,pGTV) 定义为GTV 前后、左右均匀外扩5 mm,头脚方向外扩5 ~ 10 mm。临床靶区(clinical target volume,CTV) 定义为原发肿瘤高危复发区域和区域淋巴引流区。PTV 定义为CTV 前后、左右方向均匀外扩5 mm,头脚方向外扩10 mm。3) 危及器官勾画:包括膀胱、小肠、骨盆、股骨头。4) 治疗计划设计:应用Pinancle8.0m 计划系统,逆向设计SIB-IMRT 计划,5 野共面照射。5) 处方剂量(95% 靶区达到的剂量) :PTV 给予50 Gy(2.0 Gy/次 ),pGTV 给予 56.25 Gy(2.25 Gy/ 次 ),共 25 次。整个放疗过程为5 周,5 d/ 周,1 次/d。6) 限制危及器官剂量:小肠V30 <40%,膀胱V40 <45%,骨盆V40 <50%,股骨头V40 ≤5%。同步化疗方案:放疗日口服希罗达825 mg/(m2·次),2 次/d,5 d/ 周,共5 周同步化疗。
3 手术方案 新辅助放化疗结束后6 ~ 10 周行TME 根治术,术前复查盆腔MRI,根据MRI 检查结果结合查体情况选择手术方式,术式包括腹会阴联合直肠癌根根治术、低位直肠癌前切除术。
4 术后化疗 根据术后病理结果决定是否化疗及化疗方案,19 例中5 例完成术后6 周期化疗,3例完成4 周期化疗,2 例完成2 周期化疗,2 例完成1 周期化疗后拒绝后续化疗。
5 不良反应评估 所有患者同步放化疗期间每周行血常规、血生化( 包括电解质及肝、肾功能) 检验,门诊就诊时进行急性放射反应评分(RTOG)。同步放化疗期间发生2 ~ 3 级非血液学不良反应或≥3 级血液学不良反应时希罗达用量减半。4 级非血液学不良反应停用希罗达。如为4 级腹泻,则同时暂停放疗,待腹泻恢复2 ~ 3 级后恢复放疗。
6 围术期并发症观察 观察有无吻合口瘘、切口延迟愈合、肠梗阻绞痛、术后出血、脓肿等并发症。7 随访及研究终点 首次放疗时间为开始随访时间,末次随访时间为2020 年6 月30 日。患者失访、拒绝访问、中途退出、其他原因死亡定义为删失。术后随访方法包括门诊、住院及电话随访,评估方案按照2012 版NCCN 指南建议进行:术后2 年内每3 ~ 6 月进行1 次病史询问、体格检查、CEA检测,第 3 ~ 5 年每 6 个月随访 1 次,5 年以后每年随访1 次。手术切除后1 年左右进行结肠镜检查。3 年后肠镜检查,后每5 年检查1 次。行低位前切除术患者每6 个月行1 次直肠镜检查,连续5 年,检查吻合口是否复发。术后至少每年行胸/ 腹/ 盆腔CT/MRI 检查。主要研究终点为pCR,保肛率及 3 年、5 年、7 年的 OS、 局部复发率(local recurrence rate,LRR)、 远处转移率 (distant metastasis rate,DMR)、DFS。次要终点为降期率、不良反应及围术期并发症。急性及后期放射评分按RTOG 标准进行,肿瘤消退分级按Mandard 标准进行,手足综合征分级按NCI 分级进行。
8 统计学处理 应用SPSS24.0 统计软件进行统计学分析。计量资料不符合正态分布以中位数( 范围)表示。计数资料以例数表示,年龄以Md(IQR) 表示,Kaplan-Meier 法绘制生存曲线。
结 果
1 同步放化疗完成情况 19 例患者均按计划顺利完成同步放化疗,中位放疗时间35(31 ~ 42) d,未发生因严重不良反应导致放化疗中断或剂量调整的情况。

表1 19 例局部进展期直肠癌患者基本特征(n)Tab. 1 Baseline characteristics of the 19 locally advanced rectal cancer patients (n)
2 急性及晚期不良反应 同步放化疗期间发生的1 ~ 2 级急性不良反应包括:血液学不良反应,白细胞或血小板下降1 级6 例(31.6%),白细胞或血小板下降2 级5 例(26.3%) ;下消化道反应,1 级19 例 (100%) ;泌尿系反应,1 级 8 例 (42.1%) ;手足综合征,1 级 2 例 (10.5%) ;放射性皮炎,1 级19 例 (100%)。无 3 ~ 4 级不良反应发生。14 例存活患者中下消化道1 级不良反应3 例,2 级不良反应4 例;泌尿系2 级不良反应伴术后勃起功能障碍1 例。未见晚期放射性皮炎,未见3 ~ 4 级严重不良反应发生。见表2。
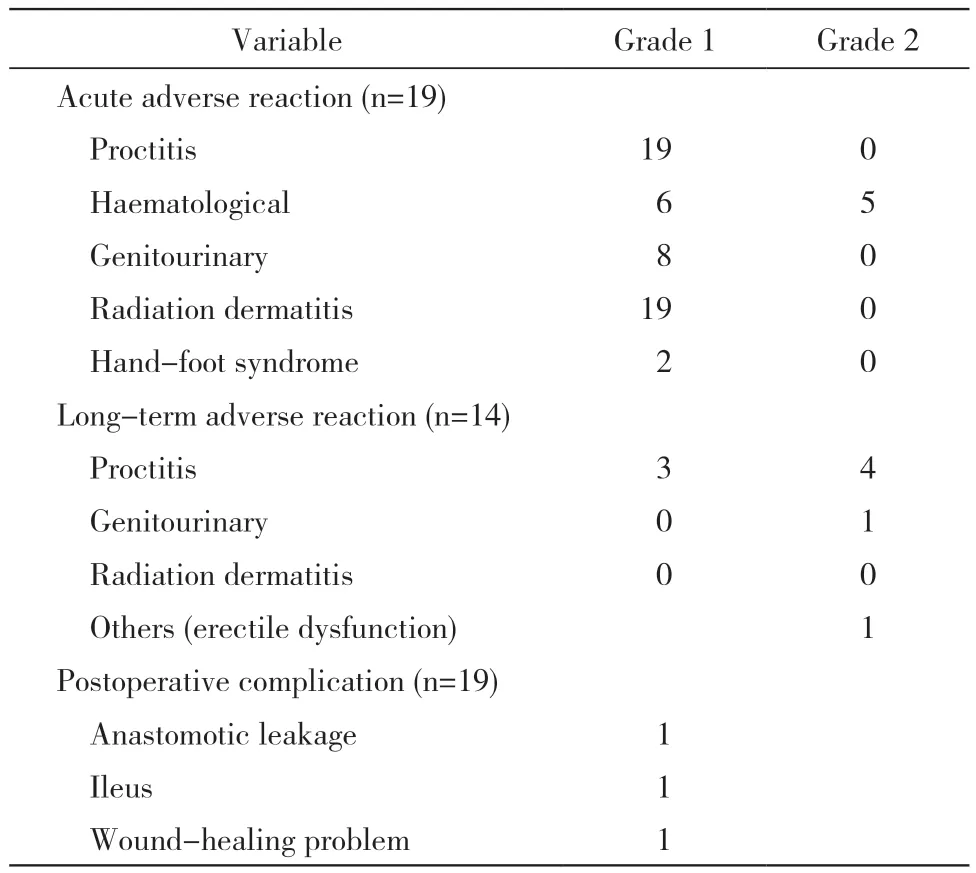
表2 同步放化疗早、晚期不良反应及围术期并发症情况 (n)Tab. 2 Short-term and long-term adverse reactions and postoperative complications of chemoradiotherapy (n)
3 围术期并发症 19 例同步放化疗结束至手术的等待时间为45 ~ 77 d,中位时间为57 d。所有患者均顺利完成TME 根治术,14 例行直肠癌低位前切除术,其中行横结肠、横结肠双腔、回肠预防性造瘘术各1 例;5 例行腹会阴联合直肠癌根治术,其中1 例行结肠造瘘术。无围术期死亡病例。19例均R0 切除,14 例保肛,其中低位直肠癌6 例保肛。3 例发生围术期并发症,分别为粘连性肠梗阻、结扎线脱落、直肠阴道瘘各1 例,手术干预/ 保守治疗后评估生活质量不受影响。见表1、表2。
4 术后病理反应 19 例术后均行病理反应评估:pCR 率21.1%(4/19),其中低位直肠癌患者pCR 率18.2%(2/11) ;TN 总 降 期 率 66.7%(20/30), 其中 T降期率 66.7%(12/19),N 降期率 72.7%(8/11) ;按Madard 标准进行术后病理TRG 分级:TRG 1 级4例,TRG 2 级 7 例,TRG 4 级 8 例。见表 3。
5 生存情况 19 例患者中位随访时间为89(28 ~100) 个月,14 例随访至少7 年。随访期间4 例死亡:1 例术后28 个月因脑出血死亡;其余3 例与直肠癌相关,均发生局部复发,发生时间分别为31 个月、58 个月、68 个月;其中2 例合并远处转移,发生时间分别为43 个月、75 个月,1 例出现远处转移时间早于局部复发;死亡的3 例患者中有2 例发生围术期并发症。1 例随访46 个月后失联。截 至 2020 年 6 月 30 日,3 年 OS、LRR、DMR、DFS 分 别 为 94.4%(17/18)、5.1%(1/18)、0、94.4%(17/18) ;5 年 OS、LRR、DMR、DFS 分别为 88.2%(15/17)、10.5%(2/17)、5.3%(1/17)、88.2%(15/17) ;7 年 OS、LRR、DMR、DFS 分别为 82.3%(14/17)、15.8%(3/17)、10.5%(2/17)、82.3%(14/17)。 见 表 4及图1、图2。

表3 术后病理反应 (n)Tab.3 Postoperative pathological reaction (n)

图 1 19例患者OS和DFS曲线图Fig. 1 Overall survival and disease-free survival among the 19 patients
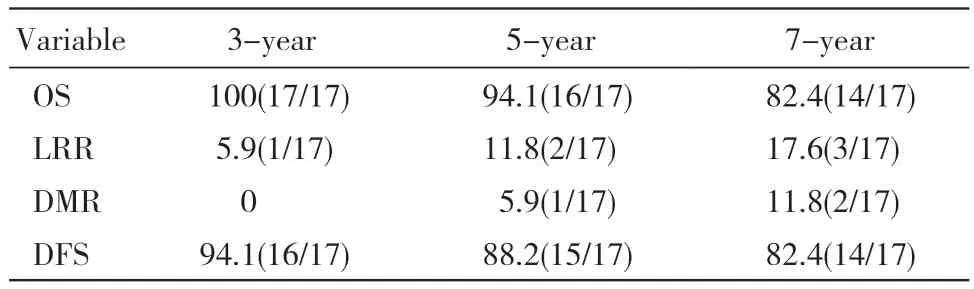
表4 19 例局部进展期直肠癌患者长期生存情况 (%,n/N)Tab. 4 Long-term survival of 19 patients with locally advanced rectal cancer (%, n/N)
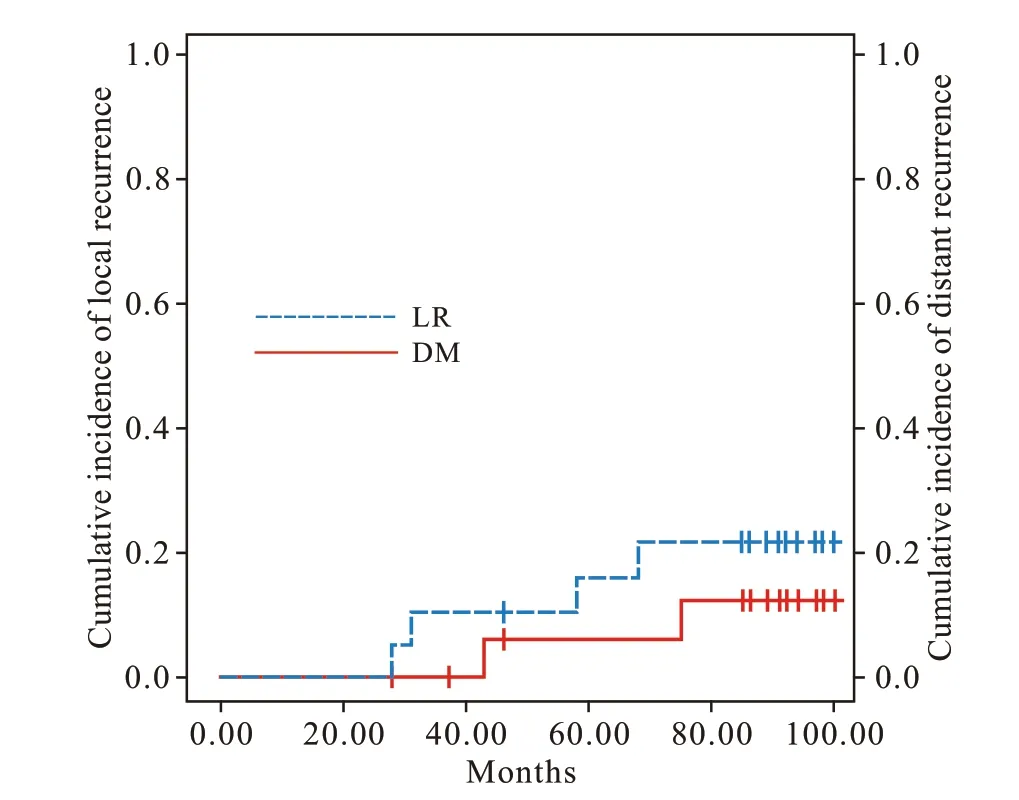
图 2 19例患者LRR和DMR曲线图Fig. 2 Cumulative incidence of local recurrence (LR) and distant recurrence (DR) among the 19 patients
讨 论
德国CAO/ARO-94 临床随机对照研究是比较Ⅱ~Ⅲ期直肠癌术前同步化放疗和术后同步化放疗的里程碑式研究。该研究结果显示术前同步放化疗组与术后同步放化疗组的保肛率为39%、19%(P=0.004),早期3 级或4 级不良反应发生率为27%、40%(P=0.001) ;长期不良反应发生率为14%、24%(P=0.32)[7]。2012 年该研究的 11 年随访结果显示术前同步放化疗显著提高了保肛率,降低局部复发率及早晚期不良反应发生率,且未增加吻合口瘘、术后出血、肠梗阻的发生率,但未改善长期生存[8]。
为了进一步提高疗效、降低不良反应及并发症发生率,近年来国内外广泛开展了直肠癌新辅助治疗模式的研究。多项研究表明照射剂量是肿瘤退缩程度的重要影响因素,增加放疗剂量可得到更好的肿瘤消退,甚至获得更长的生存期。同步放化疗期间如应用常规放疗技术提高局部放疗剂量,易损伤小肠、膀胱、股骨头等,应用SIBIMRT 技术在直肠癌术前同步放化疗的Ⅱ期研究结果显示放疗反应可接受,近期疗效pCR 率明显提高[9-10,13-14]。But-Hadzic 等[15]的Ⅱ期临床研究共纳入51 例Ⅱ~Ⅲ期可手术切除直肠腺癌患者,盆腔给予41.8 Gy,肿瘤局部加量至46.2 ~ 48.4 Gy,共22 次,同步卡培他滨825 mg/m2/12 h 每日化疗,低位直肠癌保肛率为62%,pCR 率25.5%,不良反应可耐受,2 年 LRR、DFS 和 OS 分别为 0、90%和92.2%。Lupattelli 等[16]发表了一项多中心回顾性研究,对76 例局部进展期直肠癌患者给予盆腔45 Gy,局部肿瘤加量至52.5 ~ 57.5 Gy,共25 次,近期结果显示 pCR 率为 27.8%,3 ~ 4 级不良反应发生率为10.5%,手术并发症发生率为18.1%。Tey 等[17]进行了一项纳入23 例患者的Ⅱ期试验,局部肿瘤加量至55 Gy,共25 次,同步卡培他滨标准化疗,pCR 率达35%,2 年总生存率和DFS分别为90% 和90%。
本研究团队2012 年开展局部进展期直肠癌术前同期加量调强放疗临床研究,入组13 例患者采用SIB-IMRT 技术给予PTV( 盆腔高危复发区域及相应淋巴引流区)50 Gy,pGTV( 直肠病灶及盆腔阳性淋巴结)56.25 Gy,共25 次,同时口服卡培他滨(825 mg/m2,2 次 /d,5 d/ 周 ×5 周 ) 同步化疗。同步放化疗结束后4 ~ 8 周行TME 根治术。初步结果显示安全可行,放化疗期间不良反应全部为1 ~2 级,提高了T/N 降期率、pCR 率及保肛率[18]。
在此研究基础上于2015 - 2016 年入组低位局部晚期直肠癌患者26 例,应用SIB-IMRT 技术,进一步提高肿瘤局部剂量至58.75 Gy/25 次(2.35 Gy/ 次),同步放化疗结束后1 周予卡培他滨(1 250 mg/m2,2 次/d,连续14 d) 巩固化疗1 周期,放化疗结束后6 ~ 8 周行直肠癌TME 根治术。术后pCR 率达32%,保肛率为60%,TN 总降期率为92%,R0 切除率为100%。放化疗期间24 例患者出现l、2 级不良反应,2 例出现3 级放射性皮炎,未见≥4 级急性不良反应。术后输尿管损伤1 例,肠梗阻1 例[19]。
本研究团队在上述13 例患者的临床研究基础上继续收集入组病例,根据纳入和排除标准,最终入组19 例。从入组开始对19 例患者进行长期随访,观察疗效及不良反应。19 例患者均顺利完成放化疗及手术治疗,结果显示应用SIB-IMRT 技术实现肿瘤局部放疗剂量加量,并未增加急性期及晚期不良反应,早、晚期不良反应均为1 ~ 2 级,未发生3 ~ 4 级不良反应,围术期并发症发生率15.8%(3/19),与已发表的其他使用SIB-IMRT 进行同步放化疗的研究一致[1,3,20-24]。对比本团队所开展的同步加量放疗研究结果,提高肿瘤局部放疗剂量,可进一步提高肿瘤降期率及pCR 率,同时急性不良反应可接受,我们的结果证实了该治疗模式的良好耐受性及顺从性。
本研究治疗病理反应有关的数据令人鼓舞,T降期率和N 降期率分别为66.7%(12/19) 和72.7%(8/11),pCR 率为21.1%(4/19),其中低位直肠癌患者pCR 率为18.2%(2/11),保肛率73.7%(14/19),其中低位直肠癌保肛率达54.5%,R0 切除率100%。本研究与其他SIB-IMRT 研究( 剂量范围47.5 ~57.5 Gy) 报告的 pCR 率 13% ~ 31% 相似[1,3,21-24]。早期及近期相关研究表明同步化疗中加入奥沙利铂可提高pCR 率,但同时出现更多的3 ~ 4 级腹泻及伤口延迟,从而提示IMRT-SIB 与多药化疗的可行性受到潜在限制[4,24-27]。M.D.ANDERSON 癌症中心一项研究结果表明距肛缘距离<6 cm 直肠癌患者,术前新辅助放化疗后保肛手术率约40%,该研究共入组117 例,照射剂量为45 Gy/25 次,5-FU[300 mg/(m2·d)] 同步化疗,其中69 例低位直肠癌患者中29 例患者(42%) 行保肛切除术[28],可见对于低位Ⅱ、Ⅲ期直肠癌,可通过同步提高肿瘤照射剂量,使肿瘤退缩,可提高手术保肛率,获得临床肿瘤完全缓解且保肛意愿强的患者可选择等待与观察的策略。
CAO/ARO-94 研 究 的 5 年 OS、LRR、DMR、DFS 分别为76%、6%、36%、68%,10 年OS、LRR、DMR、DFS 分别为59.6%、7.1%、29.8%、68.18%[1]。本研究 3 年 OS、LRR、DMR、DFS 分别为 94.4%(17/18)、5.3%(1/19)、0、94.4%(17/18) ;5 年 OS、LRR、DMR、DFS 分 别 为 88.2%(15/17)、10.5%(2/19)、5.3%(1/19)、88.2%(15/17) ;7 年 OS、LRR、DMR、DFS 分 别 为 82.3%(14/17)、15.8%(3/19)、10.5%(2/19)、82.3%(14/17)。本研究长期生存结果与术前未同步加量调强放疗相关研究相仿,但本研究的局限性主要为样本量少,未设置对照组,因此不可避免会出现选择性偏倚。
综上所述,局部进展期中低位可手术切除直肠癌患者行术前SIB-IMRT 联合希罗达化疗,不良反应发生率低,安全可行,取得了较满意的保肛率、pCR 率、T/N 降期率及 3 年、5 年、7 年 OS、LRR、DMR、DFS。

