多聚六铌酸盐的结构特征与电化学性能研究
严 军,胡丽芳,何 杰①
(安徽理工大学 化学工程学院,安徽 淮南232001)
0 引言
随着社会的发展,科技的进步,对各种材料的研究也越来越透彻,作为功能材料的多聚铌酸盐一直以来都备受科研人员的重视. 而K4Nb6O17作为最早被报道[1]的层状多聚铌酸盐材料之一. 其结构主体是由NbO6八面体单元通过共用氧原子而形成的具有两种不同的层间交错而形成的二维层状结构,K+离子位于层之间以维持电荷平衡. 正是因为这样的层状结构,因此,它有着独特的化学、光学[2]、和电学[3]等特性,常用作光催化剂[4-6].
随着能源问题的加剧,电极材料的研究[7]也越发深入,因为电极材料是组成电池的重要成分. 近年来,很多研究者将多聚铌酸盐材料制成电极材料[8-10],研究它们的电化学性质. WANG 等[11]合成掺碳K4Nb6O17纳米片材料并在高功率的锂离子电池中进行测试,结果表明该电极材料具有良好的稳定性.MAO等[12]通过一步固态反应法成功制备高性能TiNb6O17/C复合材料,电化学测试结果表明TiNb6O17/C复合材料在不同扫描速率下显示出相当好的循环稳定性. 到目前为止,已有很多多聚铌酸盐作为电池的电极材料的文献被报道. 然而,对不同结构的多聚铌酸盐电极材料却鲜有报道. 层状H4Nb6O17电极材料因其特殊的层状结构以及氢离子的特殊迁移方式和氢离子的高导电性,有望在不久的将来能够在电池领域占有一席之地.
本文以五氧化二铌(Nb2O5)和碳酸钾(K2CO3)为原料,通过高温烧结法制备层状K4Nb6O17,离子交换后得到层状H4Nb6O17,再通过插层—剥离—卷曲的方法制备出铌酸盐纳米管H4Nb6O17-NT. 将它们制成ITO电极后,对其进行循环伏安和电化学阻抗测试,比较3种电极材料的优劣.
1 实验部分
1.1 试剂及仪器
五氧化二铌(Nb2O5)、碳酸钾(K2CO3)和硝酸(HNO3)均为AR,购自国药集团化学试剂有限公司. 25%的四丁基氢氧化铵水溶液(TBAOH)购自兰州雨陆精细化工有限公司,实验过程中所用的去离子水均为自制. X射线粉末衍射光谱(XRD)在日本Rigaku公司SmartLab SE型X射线粉末衍射仪上表征,Cu靶,Kα射线,Ni滤波片,λ=0.154 06 nm,扫描范围2θ=4°~60°,管压50 kV,管流40 mA;激光拉曼光谱(LRS)是在英国Renishaw公司inVia+Plus型号的激光拉曼光谱仪上进行,激光波长532 nm;材料形貌与分析分别由扫描电子显微镜(SEM,日本Hitachi 公司Flex-SEM-1000 型号的场发射扫描电子显微镜,操作电压为15 kV)和透射电子显微镜(TEM,日本JEOL 公司JEM-2100Plus 型的透射电子显微镜,操作电压为200 kV)完成.
1.2 材料的制备
按摩尔比2.2:3 称取K2CO3(样品事先于120 ℃下干燥6 h)和Nb2O5,于研钵中充分研磨,之后用坩埚装好夯实,于马弗炉中从室温升至1 100 ℃并恒温煅烧24 h,程序降温后取出,研磨,去离子水充分洗涤后于80 ℃下干燥10 h,即得K4Nb6O17样品.
称取2 g上述样品于锥形瓶,加入150 mL的HNO3溶液(2 mol·L-1)于40 ℃下进行振荡7 d,每天更换一次酸液. 酸化后,在低速下离心,去掉上清液,充分洗涤下层固体至中性,干燥后即得离子交换样H4Nb6O17.
称取1 g 酸化样H4Nb6O17于锥形瓶,加入150 mL 去离子水,以TBAOH 溶液调节pH 至9.5 ~10.0,于40 ℃下进行振荡3 d. 剥离后,将混合溶液在7 000 r/m下离心10 min,收集上层清液. 以0.02 mL·min-1的滴速滴加HNO3溶液(0.2 mol·L-1)于上清液中,待清液中出现大量絮状物沉淀时,停止滴酸,陈化2 d. 充分洗涤絮状物至中性,干燥后即得纳米管样品H4Nb6O17-NT.
1.3 ITO电极的制备及测试
将ITO电极进行超声清洗,洗净干燥后备用.
分别称取10.0 mg K4Nb6O17、H4Nb6O17和H4Nb6O17-NT于3个样品管中,分别移取450 μL的无水乙醇和50 μL 的全氟磺酸溶液分别加入到上述样品管. 密封后超声分散1 h 并静置1 h 后移取20 μL 溶液滴在ITO电极上,涂覆面积0.5 cm2,自然风干,于300 ℃下煅烧30 min. 样品的电化学测试在AUTOLAB型号的电化学工作站上进行,以制作的ITO电极、铂丝(Pt)电极和银/氯化银(Ag/AgCl)电极分别作为工作电极、对电极和参比电极. EIS 测试范围为100 kHz~0.1 Hz,交流电压幅值为10 mV. CV 测试电压窗口为-0.6 V~0.8 V,扫描速率70 mV·s-1. 测试所采用的电解液均为铁氰化钾与氯化钾混合溶液.
2 结果与讨论
2.1 XRD分析
为研究样品的物相结构,对K4Nb6O17,酸化样H4Nb6O17和纳米管H4Nb6O17-NT 样品进行XRD 测试,结果如图1所示. 图1 中K4Nb6O17的主要峰出现在2θ=4.8°、9.5°和14.2°,这分别对应于(020)、(040)和(060)晶面,其中9.5°为最主要晶面的特征峰,结果与文献一致[13-14]. 根据布拉格方程λ=2dsinθ,主晶面(040)的晶面距为0.93 nm. 酸化后,(020)和(060)晶面峰强度显著降低,而(040)晶面峰仍然存在,表明离子交换未改变层状结构. 但是与K4Nb6O17相比,主晶峰衍射角出现向高角度方向偏移,由原来的9.5°偏移至11.1°,层间距减小至0.88 nm. 由布拉格方程可知,氢离子半径比钾离子半径小,离子交换后,层间距变小,因此主晶峰向高角度方向移动. 剥离重组后,层状结构的特征峰消失,表明纳米管样品已不具有层状结构性质. 该样品XRD谱图与参考文献上的H4Nb6O17纳米管谱图基本一致[15-16],可以推测合成的样品为H4Nb6O17-NT.

图1 K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT样品的XRD图
2.2 SEM及TEM分析
为观察样品的形貌特征,对K4Nb6O17、酸化样H4Nb6O17和H4Nb6O17-NT纳米管样品进行SEM和TEM测试,结果如图2所示. 图2a 和2b显示的是K4Nb6O17和H4Nb6O17的SEM 图片,图中看出,K4Nb6O17有明显的层状结构,经硝酸酸化后,其层状结构并未发生改变. 剥离重组后的TEM图片如图2c所示,图中可以直观观察到管状物质的存在,管径大多在20 nm 左右,结合XRD 表征结果,可以证明H4Nb6O17-NT 被成功合成.
2.3 LRS分析
为研究样品的骨架特征,对K4Nb6O17、酸化样H4Nb6O17和H4Nb6O17-NT 纳米管样品进行LRS 测试. 由图3可知,在800~1 000 cm-1范围内,K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT都有强的拉曼峰,这归属于高度扭曲的NbO6八面体中的短Nb—O键的伸缩振动. 500~700 cm-1范围内的拉曼峰归属于高度扭曲的NbO6八面体中的长的Nb—O键伸缩振动. 在200~480 cm-1范围内拉曼峰归属于NbO6的Nb—O键弯曲振动[17-19]. 对3种样品在800~1 000 cm-1范围内进行拉曼分峰,由图4可知,与K4Nb6O17相比,氢离子交换样品H4Nb6O17在940 cm-1处有一个新的弱拉曼峰,这是因为NbO6八面体中短的Nb—O伸向层间,与H+作用形成氢键,因而形成Nb—O···H键,降低Nb—O键的键序和相应的振动频率[20]. 离子交换后,拉曼峰由原来的880 cm-1偏移至883 cm-1,这可能是氢键比静电力相互作用大,键强增大,向高波数移动. 卷曲成管后,Nb—O键的拉曼峰位于878 cm-1,这可能是因为层状结构转变成管状结构后,使得Nb—O键受到结构应力有所变化.
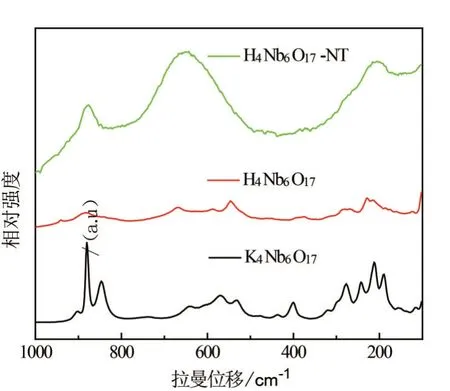
图3 K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT样品的LRS图
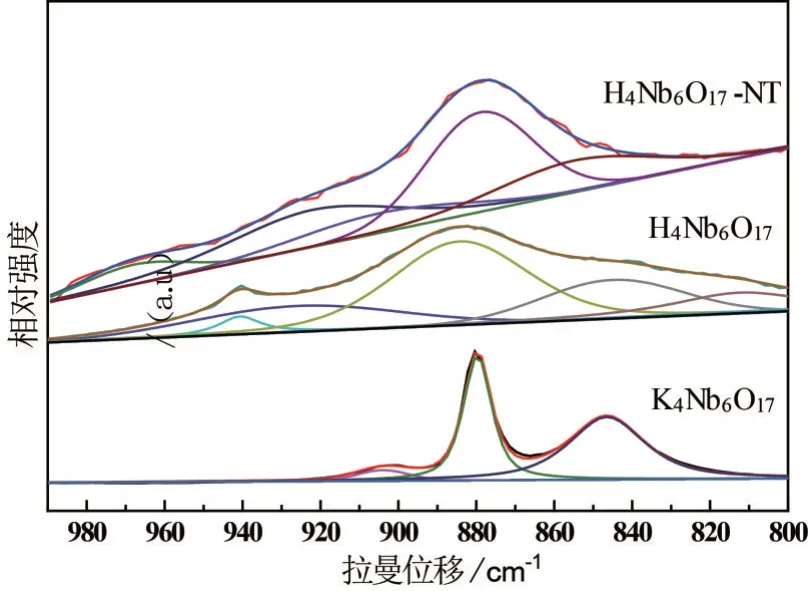
图4 K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT样品的LRS分峰图
3 电化学测试分析
3.1 CV分析
为研究K4Nb6O17、酸化样H4Nb6O17及纳米管H4Nb6O17-NT样品的循环可逆性,对其进行CV测试,结果如图5所示. 图5中每条曲线均有明显的阴极峰与阳极峰,这表明3种样品电极材料具有良好的电活性.阴极峰与阳极峰所对应电势分别为~0.15 V 和~0.31 V(vs Ag/AgCl),这是因为存在Nb5+/Nb4+氧化还原对,它会发生Nb5++e-→Nb4+和Nb4+→Nb5++e-的电子转移. 从可逆性来看,3条曲线均属于准可逆体系,介于完全不可逆体系与可逆体系之间. 比较不同电极材料的阴极峰与阳极峰所对应电势的差值ΔEp大小,K4Nb6O17样品、酸化样H4Nb6O17和纳米管H4Nb6O17-NT的ΔEp分别为0.17 V、0.13 V和0.20 V,其中酸化样电极材料的ΔEp值最小,反映更快的动力学性能,与文献[8,21]相比,ΔEp值要小,这说明H4Nb6O17电极材料具有良好的耐极化性,因此该材料具有良好的稳定性. 管状结构的H4Nb6O17-NT 电极材料表现较大的ΔEp值,这可能是因为管状结构在循环过程中会吸附要反应的离子,降低反应速度,而层状结构有特殊的通道,能加快离子的传输.
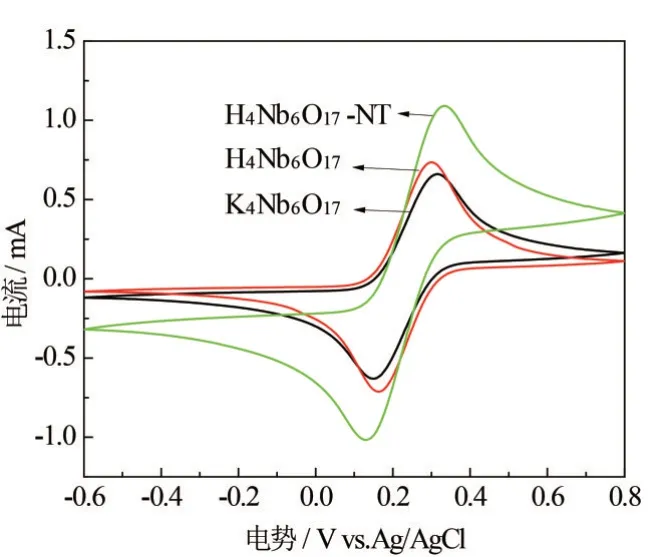
图5 K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT样品的CV图
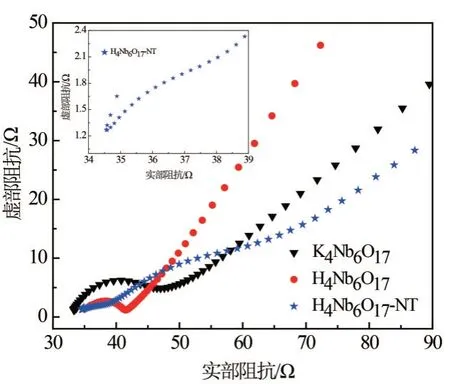
图6 K4Nb6O17、酸化样H4Nb6O17和纳米管H4Nb6O17-NT样品的EIS图
3.2 EIS分析
为进一步研究K4Nb6O17、酸化样H4Nb6O17及纳米管H4Nb6O17-NT样品的电荷转移与离子扩散性质,对其进行EIS测试,测试结果如图6所示. 由图6可知,所有曲线均由半圆弧(位于高频区)和直线(位于中低频区)组成. 不同的是,纳米管样品电极材料在高频区却有2个半圆弧,第1个半圆弧代表的是电极材料表面的一层SEI膜[22-23],第2个半圆弧代表电荷转移. 半圆弧半径大小与电荷转移有关,一般而言,半圆弧的半径与电荷转移的阻力呈正相关,即半径越大,阻力越大;而直线的斜率与离子扩散有关,斜率越大,离子扩散越快. 比较3条曲线的半圆弧半径大小,可以发现,酸化样品电极材料的半圆弧半径最小,K4Nb6O17样品曲线次之,纳米管H4Nb6O17-NT样品曲线的半圆弧半径最大,这表明酸化样品电极材料在3者之中具有最小的电荷转移阻力,电荷转移快. 与文献[9,24]相比,这3种样品电极材料的半圆弧都较小.比较3条曲线低频区的斜率,可以发现,酸化样的斜率最大,K4Nb6O17样品次之,纳米管样品最小,说明酸化样离子扩散最快. 因此,结合电荷转移和离子扩散,可以说明酸化样电极材料具有良好的电化学动力性能. 酸化样H4Nb6O17电极材料的良好电化学性能可能归因于特殊的二维结构,这为离子扩散提供路线[11].
3.3 电化学性能影响因素分析
3.3.1 层间阳离子对电化学性能的影响
比较K4Nb6O17和酸化样H4Nb6O17,可以发现它们具有同样的层状结构(SEM已证实),不同的是层间阳离子. 与K4Nb6O17样品相比,H+交换后的样品H4Nb6O17电化学性能好的原因可能是,K+被H+取代后,层间距变小(XRD中已证明),在电化学循环过程中结构要稳定. 另外,K+半径比H+大,在溶液中扩散有较大的阻力,又由于H+在溶液中的特殊迁移(质子传递)方式要快于K+在溶液中的扩散. 因此,H4Nb6O17电极材料比K4Nb6O17电极材料电化学性能要优越.
3.3.2 结构对电化学性能的影响
层状H4Nb6O17与管状H4Nb6O17-NT相比,主要是结构的不同(SEM和TEM已证明). 纳米管结构是通过对层状结构的剥离,然后在酸的作用下卷曲成管,因而与层状结构相比具有更大的比表面积,在电化学过程中与离子接触面积大,可能会对离子(如H+)有吸附作用,影响电化学性能. 正是由于吸附作用,纳米管样品的含水量要比层状样品的要多,使其在扩散过程中有较大的阻力,不利于离子扩散,降低扩散速度;另外,纳米管的管径,长短都会影响电化学性能,管短的则有利于离子的嵌入和脱嵌,而管长的则会阻碍离子扩散[25],而H4Nb6O17-NT具有较长的管长,不利于离子扩散,因此表现出较差的电化学性能.
4 结论
本文采用高温固相法成功合成K4Nb6O17,经氢离子交换后得到酸化样H4Nb6O17,再经剥片、卷曲得到管状H4Nb6O17-NT. 循环伏安测试结果表明,酸化样H4Nb6O17电极材料在3种电极材料中具有良好的稳定性;同时,电化学阻抗谱结果说明酸化样H4Nb6O17电极材料具有较小的电荷转移阻力和较快的离子扩散速度,具有良好的电化学性质. 这表明层状结构比管状结构在电化学过程更有优势. 本文通过离子交换制备H4Nb6O17电极材料,为寻找更优越的电极材料开辟一条新的道路.

