水热法制备质子化钛纳米管的影响因素及其应用研究进展
周硕林,赖金花,游高林,刘贤响,尹笃林
(1 长沙师范学院基础实验中心,湖南长沙 410100;2 湖南师范大学化学化工学院,石化新材料与资源精细利用国家地方联合工程实验室,湖南长沙 410081)
钛纳米管是TiO2纳米材料中一类重要的低维材料。相对钛纳米颗粒而言,钛纳米管具有较规整孔道结构、更高的比表面积,保证了相对较高的活性位密度,有利于表面反应的发生和进行。TiO2纳米管的制备方法主要包括模板合成法、电极氧化法和水热合成法等。相对模板合成法和电极氧化法而言,水热合成法具有操作简单、条件温和、成本低等特点,可调变水热条件及后处理等工艺制备形貌均一、结晶度高的钛纳米管[1]。这种方法所得到的钛纳米管具有开放的管道结构、比表面积大、稳定性好、离子交换容易。
水热法制备钛纳米管得到了研究者越来越多的关注和青睐,国内外围绕水热法钛纳米管的制备与应用取得了丰富的研究成果[2-4],展现极具诱人的工业化前景。本文主要综述了水热制备钛纳米管的影响因素及其在载体、光催化、酸催化、吸附等领域的应用研究进展,并对钛纳米管材料未来研究方向进行展望。
1 水热法制备钛纳米管的机理
1998年,Kasuga 等[5]采用水热法将钛纳米颗粒分散在氢氧化钠溶液中,在高压釜中控制一定的温度和时间反应后,经酸和水洗涤等后处理得到钛纳米管(TNTs)。Kasuga 等[6]认为酸处理过程可以去除样品中的Na+,从而重新形成Ti—O—Ti 化学键。另一方面,酸处理后会引起表面电荷的变化并卷曲,从而形成钛纳米管,因此酸处理过程是制备钛纳米管的关键。然而,Du 等[7]通过透射电镜(TEM)表征证实纳米管的形貌在氢氧化钠水热过程中已经形成,在无盐酸的后处理条件下也可得到钛纳米管结构,这一观点多数研究者认同。随后Wang等[8]进一步研究发现,钛纳米管的形成经历了从3D→2D→1D 转变的过程,见图1,并且二维层状结构对钛纳米管的形成至关重要。Yao 等[9]认为TiO2晶体在碱性溶液中会剥离成单层结构的纳米片,并随后沿[001]方向发生卷曲,并且结合其他纳米片从而形成纳米管,见图2。Bavykin等[10]认为在水热过程中结晶/溶解过程产生的机械力是钛纳米管片弯曲包裹的驱动力。TiO2纳米粒子在水热处理过程中形成单层或多层纳米片是形成纳米管状形貌的关键步骤[11]。

图1 TiO2纳米管形成经历3D→2D→1D过程[8]

图2 TiO2晶体在碱性溶液中形成单层纳米管并沿[001]方向卷曲形成钛纳米管[9]
尽管钛纳米管的形成过程仍然存在争议,目前关于水热法制备钛纳米管可被接受的形成机理是:在水热初始阶段钛纳米颗粒在强碱溶液中溶解,Ti—O—Ti 键发生断裂从而形成钛酸盐纳米片,钛酸盐纳米片生长和剥离,沿特定的晶轴卷曲或折叠形成钛纳米管[12],见图3。采用先进的表征手段特别是原位表征技术的使用,辅以理论计算,对深入认识水热合成钛纳米管的形成机理会愈渐清晰。科学研究者结合不同前体、水热条件、后处理等参数进行研究,试图揭示影响制备TiO2纳米管的关键因素。

图3 钛纳米管形成过程中纳米片的剥离及卷曲机理[12]
2 水热法制备钛纳米管的影响因素
水热法制备钛纳米管的影响因素主要有前体材料、水热反应条件(如碱的种类及浓度、温度、时间)和后处理过程(如酸洗种类及浓度、焙烧温度等)[1,13-14]。认识制备工艺参数对钛纳米管结构及性能的影响,对实现钛纳米管可控制备具有重要意义。
2.1 前体材料
水热合成钛纳米管的前体多样,如金红石型TiO2[15]、锐钛矿型TiO2[16-19]、混合晶型的商业二氧化钛(P25)纳米粒子[20-22]、无定形等,在一定程度上会影响钛纳米管的结构与性质(表1)。在众多前体物中,使用锐钛矿型TiO2和P25纳米粒子居多。使用不同方法所制备的锐钛矿型TiO2前体水热合成钛纳米管的结构也不尽相同。Li等[19]利用锐钛矿TiO2纳米粉末为前体,水热条件下转化为钛纳米管的反应时间只需3~6h,与P25粒子相比大大缩短了制备时间。P25 是最典型的商业化钛纳米粒子,具有金红石和锐钛矿混合晶型,被广泛用于水热法制备钛纳米管的前体材料,其在不同水热合成条件下所得到的钛纳米管的结构差异非常明显,说明水热合成条件对钛纳米管结构的影响显著。最近,Ota等[23]以无定形TiO2为前体,在10mol/L氢氧化钠溶液中室温反应48h,可得到比表面积高达735m2/g 的钛纳米管。这种无定形的TiO2材料制备使得钛纳米管的条件更温和、更简单,是一种非常具有应用潜力的前体材料。水热法制备钛纳米管的前体材料多样化,为该方法的广泛使用提供了极大的便利。另一方面,同种前体材料通过调控水热条件,得到结构各异的钛纳米材料,也可以满足不同应用领域的需要。
2.2 水热反应条件
2.2.1 碱的种类及浓度
碱的种类及浓度、水热温度、反应时间等参数是水热条件的主要因素,对钛纳米管的形成起到决定性的作用,也是调控钛纳米管结构与性质的关键因素。目前,文献所报道的碱主要是以氢氧化钠为介质的无机碱。氢氧化钠溶液浓度在10~15mol/L范围,水热温度在100~150℃,所制钛纳米管的收率可达80%~90%[24]。当氢氧化钠浓度低于5mol/L或者高于20mol/L 左右,几乎得不到钛纳米管[24]。另一方面,随着TiO2与氢氧化钠摩尔比的增加,钛纳米管的平均孔径逐渐增加,比表面积降低[10]。Vu等[25]也报道了相类似的结果,当氢氧化钠浓度分别为5mol/L、7mol/L、10mol/L时,所得钛纳米管的电镜图见图4。但Hinojosa-Reyes 等[26]研究结果表明,钛纳米管的平均孔径随TiO2与氢氧化钠摩尔比的增加呈先降低后增加的趋势,比表面积却呈先增加后降低的趋势。
当用氢氧化钾代替氢氧化钠,得到的是纳米线[24]或者钛纳米管夹杂纳米棒或纤维状的混合形貌[27]。值得注意的是,氢氧化钠和氢氧化钾组成的混合碱溶液可在100℃水热温度下反应48h,获得高产率的钛纳米管[28]。
2.2.2 水热温度及反应时间
水热温度是形成纳米管的重要因素,一般而言水热温度越高、时间越长,往往钛纳米管的产率会高。水热温度过低(<100℃),获得钛纳米管的收率较低;但水热温度过高(>180℃),无论是结晶型还是无定形的TiO2为前体,得到的均是钛纳米带[10,24]。目前,所报道的水热温度大多在130~150℃范围,所得到的纳米管具有大的孔径以及高的比表面积。
水热反应时间是形成纳米管的关键因素,水热反应时间短,钛纳米管还未完全形成,导致产率较低;反之,水热反应时间过长,可能导致钛纳米管转变成其他形貌。关于水热反应时长对钛纳米管结构与性质的影响,De Carvalho等[18]对比考察了水热时间分别为24h、48h和72h时,所得钛纳米管的比表面积分别为234m2/g、313m2/g、182m2/g,并且表面所形成的酸位点数目也有所差异。Subramaniam等[22]对比了水热时间为10h、24h和48h对钛纳米管结构的影响,如图5所示。研究发现,水热时间为24h时,制备的钛纳米管比表面积最大,光催化活性最优。
2.2.3 其他因素
水热合成与超声、微波等技术耦合可缩短水热反应时间,提高钛纳米管制备效率[29]。Chiang 等[29]对比考察了微波功率辅助水热对合成钛纳米管的影响,在氢氧化钠溶度10mol/L、水热温度130℃、微波功率为400W、反应时间3h时,所获钛纳米管的比表面积可达367m2/g。
搅拌能促使水热反应溶液混合,有助于加快反应速率,从而缩短水热反应时间。Toorente-Murciano 等[30]考察了搅拌速度对形成钛纳米管的影响,研究发现,相比静置条件下,当搅拌速度达到20r/min 时会产生更多长的纳米管(>1000nm),并且随着搅拌速度的增加,纳米管会自组装成线性的二级结构。
Song 等[31]将水热反应釜旋转以辅助水热合成,可得到具有15 层或者更多层壁厚的钛纳米管,并且在空气氛围中焙烧至400℃仍保持良好的孔结构和比表面积。最近,Sallem 等[15]使用晶型稳定的金红石型纳米粒子为前体,在180℃、2h条件下,机械转动水热反应釜可快速得到钛纳米管,大大缩短了水热反应时间。但是,在150℃下较长的旋转周期(超过10min/h)和16h 的反应时间,得到的是钛纳米带。
值得注意的是,水热合成与超声、微波等技术耦合大大提高水热合成效率,但同时也会受到诸多条件的限制,适合实验室小批量生产。在搅拌或旋转水热反应釜等动态水热环境下,可获得不同长度、壁厚的钛纳米管,并且能将稳定的金红石型TiO2纳米粒子快速转化为钛纳米管结构,进一步发展了水热合成调控方法。
2.3 后处理过程
2.3.1 酸洗
酸洗过程是将水热形成的钛酸盐纳米管(Na-TNTs)与酸中的氢离子进行交换,从而形成质子化钛纳米管。酸洗是获得高收率、高纯度钛纳米管的重要步骤[32]。Qamar 等[33]在后处理过程中仅用水洗,样品中Na含量为7.08%,然而用0.1mol/L盐酸洗后样品中钠含量仅为0.06%。表2 对比了酸洗种类及浓度对钛纳米管结构的影响。盐酸浓度从0.025mol/L 增至0.1mol/L,钛纳米管中Na 含量显著下降,但对钛纳米管比表面积和孔体积的影响不大[16]。而盐酸处理浓度分别为0.1mol/L、0.5mol/L、1mol/L时,钛纳米管的比表面积出现先增加后减少的趋势,所得钛纳米管比表面积分别为307m2/g、392m2/g、333m2/g[34]。

图4 NaOH浓度对钛纳米管结构的影响[25]

图5 水热合成时间对钛纳米管结构的影响[22]
Camposeco等[35]比较了盐酸、硝酸、硫酸这3种不同的无机酸处理对钛纳米管结构的影响,研究发现,采用硫酸处理所得到的钛纳米管比表面积最高达422m2/g,不同酸处理对表面形成的酸位点种类也不同,盐酸处理后在钛纳米管上形成Lewis 酸位点,硝酸处理则有利于形成Brønsted酸位点。除此之外,采用0.1mol/L乙酸用于水热合成过程后处理也能起到交换钠离子的效果[36]。
2.3.2 焙烧
焙烧被认为是影响钛纳米管晶型和结构的重要因素。Bavykin等[37]认为在120~500℃的热处理过程中,钛纳米管的结构会经历如下变化:H2Ti3O7→H2Ti6O13→H2Ti12O25→单斜晶TiO2(B)→锐钛矿。Yang 等[11]发现当热处理温度超过400℃,多层钛基纳米管则会塌陷,失去空心的管道结构,比表面积会急剧下降。而López等[20]报道了焙烧温度在400~600℃还能较好地维持钛纳米管形貌,但焙烧温度超过600℃,钛纳米管会向不规则的颗粒结构转变。
3 水热法制备钛纳米管的应用领域
3.1 载体
水热法制备的钛纳米管具有两端开口的空心管道结构,比表面积大,稳定性高,是优良的载体材料。利用水热合成可以一步将活性物质负载在钛纳米管上,这种制备方法条件温和、制备过程简单,受到研究者广泛青睐。Kukovecz等[38]采用一步合成法将硫化镉负载钛纳米管上,负载CdS 的粒径小,并且钛纳米管可以均匀地被CdS包覆。活性物质也可通过浸渍-焙烧法引入钛纳米管中[39],在焙烧过程中甚至还能在钛纳米管表面掺杂形成独特的活性位点[40]。另一方面,金属离子如Ru(III)[41]可利用水热合成法制备的钛纳米管离子交换的性质,从而制备新的功能材料。此外,还可通过光原位还原、光或电化学处理等方式将活性组分较好地负载在钛纳米管表面。
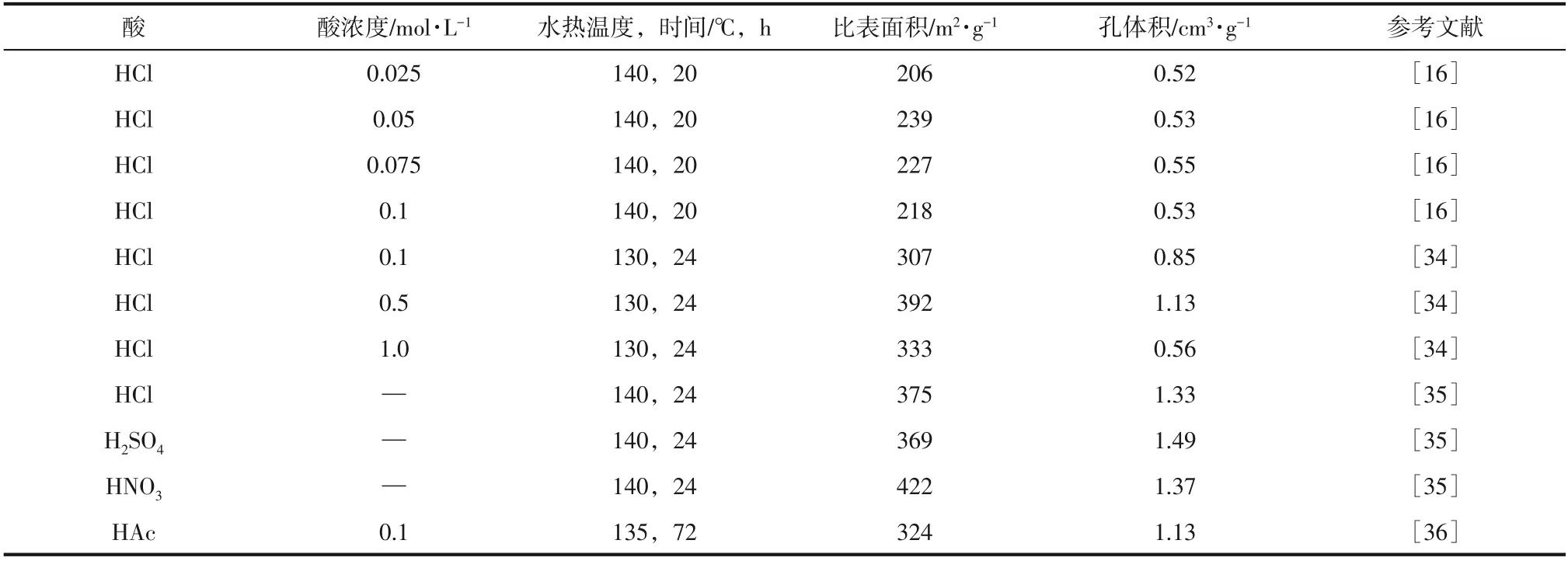
表2 酸处理类型及浓度对钛纳米管结构的影响
3.2 光催化
水热条件下获得的钛纳米管其光催化活性明显高于钛纳米纤维和钛纳米线[42]。Sandoval 等[16]采用商业锐钛矿型纳米粒子在水热法条件下制备的钛纳米管对亚甲基蓝初始碳矿化率达65%,相同条件下P25对亚甲基蓝的矿化率仅41%。Subramaniam等[22]以P25 为原料水热制备的钛纳米管,在120min 内亚甲基蓝的降解率达90%,其光催化降解效果明显高于P25。
为进一步提升水热法制备的钛纳米管的光催化活性,近年来采用金属或非金属杂化或染料敏化等策略制备的改性钛纳米管,在光催化降解有机物、光解水制氢、选择性氧化等方面表现出良好的应用前景(表3)。已报道的金属如Fe[43-44]、La[45]、Co[46]、Mo[47]、Sn[48-49]、Cu[50]、Mn[51]、Ag[52]等通过一步水热合成、浸渍-焙烧、离子交换或光还原沉积等多种途径掺杂在钛纳米管结构中或负载在钛纳米管表面,有效地提升了光催化活性。除了单一金属组分外,多种金属组分共同杂化钛纳米管,可促进光催化过程中电子-空穴的分离,提高光催化性能[53-54]。非金属元素如C[55]、N[56]或多种非金属[57-58]杂化或修饰水热制备的钛纳米管,可将催化剂吸收光延伸至可见光区域,有效地拓展了钛纳米管基材料应用范围。Doong 等[59]采用Cu、N 共掺杂钛纳米管,将吸收光由紫外光延伸至可见光区域,并且产生含氧自由基的时间至少延长了5min,其在紫外光和可见光下对双酚A的降解速率分别是P25的4.3倍和1.5倍。发展金属、非金属同钛纳米管制备成复合光催化剂材料将是今后研究的热点。

表3 钛纳米管材料在光催化中的应用
此外,通过一步水热合成、浸渍等方法制备石墨烯/钛纳米管[60-61]、碳纳米管/钛纳米管[62]、碳量子点/钛纳米管[63]、卟啉/钛纳米管[64-65]等复合材料,在增强吸附底物能力、提高光催化活性方面表现出优异的性能。
3.3 酸催化
经酸处理后得到的钛纳米管具有Lewis 和Brønsted酸位点,是一种典型的固体酸催化剂,用于多种类型的酸催化反应(表4)。2010年,Kitano等[66]报道了质子化钛纳米管催化甲苯与苄基苯的傅克反应,室温反应3h,产物的收率达90%。Li等[67]报道在相同反应条件下,质子化的钛纳米管催化2-甲基呋喃与正丁醛的羟烷基化反应,其酸催化活性明显高于SO42-/ZrO2、SO42-/Al2O3、H-ZSM-5 等固体酸催化剂。De Carvalho等[18]利用水热法合成质子化钛纳米管催化甘油与丙酮缩合反应,水热合成时长72h所制得的质子化钛纳米管催化效果最佳,甘油转化率为45.5%,缩合产物的选择性达98%。Reddy 等[68,75]采用质子化钛纳米管催化多组分一锅合成α-氨基膦酸酯,催化剂循环使用7次后,产物的收率仍保持81%以上。Sluban等[36]对比研究了水热法合成的钛纳米管和钛纳米带在苯甲醛与环己酮的醛醇缩合反应中的催化性能,研究发现,钛纳米管和钛纳米带均有中等强度的Lewis 和Brønsted 位点,但只有钛纳米管具有强酸位点。钛纳米管在苯甲醛与环己酮的醛醇缩合反应中循环使用5次后仍表现出优异的催化性能。TiO2纳米管的酸催化性能主要依赖于表面上未配位的Ti4+和大量的羟基官能团,前者为Lewis 酸位点,后者为Brønsted 酸位点[76-77]。钛纳米管的酸量可通过氢氧化钠浓度[78]、水热时间[18]、酸处理类型及焙烧温度[35]等多个水热合成参数进行调变,然而钛纳米管表面由于自身有限的酸量和酸强度,在实际应用中还存在一定限制。

表4 钛纳米管材料在有机合成中的应用
为调变钛纳米管表面酸催化位,可用金属掺杂钛纳米管[79]。Wada 等[69]以已杂化Nb 的TiO2粒子为前体,制备得到Nb/TNTs,其在甲苯与苯甲醇的傅克烷基化反应中展现良好的酸催化性能,认为Nb的引入(增强了Brønsted酸酸度)和扭曲的纳米管结构,有利于反应的进行。此外,通过离子交换的方法可在水热反应法制备的TiO2纳米管中引入金属离子,从而实现对表面酸性能的调控。Dos Santos等[70]利用金属离子的交换反应制备了金属离子插层的钛纳米管催化剂,研究发现,Ce/TNT 和La/TNT催化剂在Knoevenaguel缩合反应合成α,β-不饱和酯中表现出良好的催化性能。Gomes 等[71]利用离子交换法制备掺有Co、Ni、Pt 的TiO2纳米管,也能改善酸催化活性。
原位水热合成金属掺杂的钛纳米管,为调控钛纳米管表面酸种类和酸强度提供了最为直接的方法。Camposeco 等[80]采用原位水热合成法引入Ag、Au、Ce、La、Fe、Mn、Pd、Pt、V 和W 等金属,研究发现,引入Pt、Mn 和W 能增加Lewis 酸数量,而Mn、V、Au 和Pd 能增加Brønsted 酸数量。尽管引入金属元素能提高纳米管表面酸催化初活性,然而表面离子键结合的部分金属组分在反应体系中容易流失,导致催化剂失活,在实际应用中仍然受限。
本文作者课题组[72-74]利用水热制备的TNTs为载体,先用硅烷偶联剂实现表面功能化修饰,后引入或衍生酸催化位,构筑无机-有机杂化固体酸催化剂,并在乙酰丙酸酯化为代表的酸催化反应中获得了一些有益的结果。利用纳米管均匀开放的孔道结构和高的比表面积,采用后合成策略枝接催化位,为发展纳米管基固体酸催化剂及其拓展钛纳米管基催化剂在酸催化中的应用提供了参考。
3.4 吸附剂
3.4.1 吸附金属离子
水热法合成的钛纳米管具有高的比表面积及丰富的羟基,能通过离子交换有效地吸附阳离子,在吸附水体溶液中金属离子方面展现出潜在的应用前景(表5)。水热合成的钛纳米管对Zn(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)等金属离子表现出优异的吸附性能[21,81]。Wang 等[82]采用钛纳米管吸附Cd(Ⅱ),吸附能力达239.8mg/g,值得注意的是,采用低浓度的氢氧化钠溶液再生后,循环使用6次后仍具有较好的吸附性能。Zheng等[83]考察了不同天然有机物及pH条件下钛纳米管对Cu(Ⅱ)吸附的影响,疏水性碱浓度为0.5mg/L、溶液pH 为5 时,钛纳米管对Cu(Ⅱ)吸附的能力可提升15%,达到120mg/g。Chiang 等[29]采用微波辅助水热合成的钛纳米管,所制备的钛纳米管具有高的比表面积,其对Cu(Ⅱ)的吸附量达160mg/g。Liu 等[84]将水热合成的钛纳米管用于水体中U(Ⅵ)的去除,并考察了无机离子、碳水化合物和有机物对U(Ⅵ)吸附能力的影响,钛纳米管对U(Ⅵ)的最大吸附能力可达333mg/g。质子化钛纳米管对多种金属离子均表现出较好的吸附效果,普适性强,但吸附能力可能受溶液pH、无机物或有机物浓度等内外因素的影响较大。

表5 钛纳米管材料对金属离子的吸附性能比较
为进一步改善对金属离子的吸附性能,常见的做法是对水热制备的钛纳米管材料加以修饰。Yuan等[85]利用植酸(PA)修饰钛纳米管,在pH为5时,对U(Ⅵ)的最大吸附量达276.1mg/g。Ma 等[86]通过一步水热合成法制备得到负载粉末活性炭的钛纳米管(TNTs-PAC),在高浓度自然有机物存在的条件下,其对Pb(Ⅱ)的吸附能力达318.5mg/g。Wang等[88]利用三乙醇胺(TEOA)修饰水热合成的钛纳米管制得吸附材料(TEOA-TNTs),尽管比表面积低,但对Ag(Ⅰ)吸附表现出优异的吸附性能,吸附量最高可达396mg/g。通过对钛纳米管的化学改性,有效地提升了在复杂环境甚至苛刻条件下对金属离子的吸附能力,为在实际中的应用提供了方向。
3.4.2 吸附染料等有机物
钛纳米管除了对金属离子吸附外,对染料等有机物也表现出一定的吸附能力(表6)。Subramaniam等[22]利用水热合成钛纳米管吸附亚甲基蓝,其吸附率最高可达70%,最大吸附量达21.4mg/g。而Xiong 等[89]以P25 为前体,经水热及焙烧处理后制得钛纳米管,对亚甲基蓝的吸附动力学符合朗格缪尔吸附曲线,最大吸附量可达133.33mg/g。Hinojosa-Reyes 等[26]对比考察了不同Ti/NaOH 浓度下所得钛纳米管对碱性品红的吸附性能,结果表明,当氢氧化钠溶液浓度为8mol/L 时,所制钛纳米管的比表面积最高(392.3m2/g),对碱性品红的吸附量最高达68.6mg/g。

表6 钛纳米管材料对染料等有机物的吸附性能比较
钛纳米管表面带负电荷和亲水性特性,使其对电中性有机物的吸附能力较弱。为改善水热合成的钛纳米管的吸附性能,Orona-Návar 等[90]采用十六烷基三甲基氯化铵(CTAC)修饰,发现对2,4,6-三氯苯酚、土霉素、2,4-二氯苯酚、托拉酰胺、卡托普利和二甲双胍等有机物具有良好的吸附性能。Hu 等[91]对比研究了十二烷基二甲基苄基溴化铵(DDBAB)和十六烷基三甲基溴化铵(HTAB)两种表面活性剂分别修饰钛纳米管后对苯酚的吸附性能,研究发现,DDBAB 和HTAB 修饰的钛纳米管材料具有亲油性,对苯酚吸附效果较好,其中TNTs-DDBAB 复合材料吸附能力可达226.24mg/g。Patowary 等[92]采用水热合成法制得磁性钛纳米管,进而利用十八胺(ODA)修饰,得到超疏水磁性钛纳米管(MTNTs-ODA),对柴油、原油、煤油、硅油、发动机油和石蜡油的吸附能力均大于150mg/g。
由此可见,水热合成的钛纳米管表面通过表面活性剂修饰改性,可以改善对中性有机物分子的吸附性能,为拓展到多种有机物的吸附提供了思路。
3.4.3 CO2吸附
尽管水热法制备的钛纳米管对CO2的吸附量较低[93],但经表面修饰后在CO2吸附领域展现出潜在的应用前景(表7)。Song 等[94]对比考察了乙醇胺(MEA)、乙二胺(EDA)、三亚乙基四胺(TETA)和四亚乙基五胺(TEPA)这4 种有机胺修饰钛纳米管后的CO2吸附性能,钛纳米管上负载TEPA 对CO2的吸附效果最佳,当TEPA与TNTs的质量比为69%时,在吸附温度为60℃条件下,CO2的吸附量约192.28mg/g。Liu等[95-96]通过湿式浸渍法用聚乙烯二胺修饰水热合成的钛纳米管,当聚乙烯二胺负载质量为50%、吸附温度为100℃条件下,CO2的吸附量可达130.8mg/g,这有望在电厂烟气中得以应用。Sim等[97]对比了N-[3-(三甲氧基甲硅烷基)-丙基]乙二胺(TPEDA)分别修饰水热制备的钛纳米管和钛纳米棒两种材料后对CO2的吸附性能,研究发现,在25℃、3h 条件下,TPEDA 修饰的钛纳米管对CO2的吸附量达52.8mg/g,而相同条件下修饰的钛纳米棒对CO2的吸附量仅为18.92mg/g。值得注意的是,TPEDA修饰的钛纳米管在循环使用9次后仍然保持较好的CO2吸附性能。最近,Ota 等[23]采用水热法制备比表面积高达735m2/g 的钛纳米管,其表面用乙二胺(EDA)修饰后,在0℃、100kPa条件下对CO2的吸附量达50cm3/g。针对CO2性质,采用有机胺分子修饰钛纳米管表面,显著提升了其对CO2的吸附能力,为改善钛纳米管材料的性能及拓展钛纳米管材料应用范围提供了有益借鉴。

表7 钛纳米管材料对CO2吸附性能比较
4 结语
目前,水热法作为制备钛纳米管较为广泛的使用方法已取得积极进展,其优异的物理化学性质,在载体、光催化剂、酸催化剂、吸附剂方面展示出广阔的应用前景。水热合成方法和钛纳米管及其改性材料的理论认识与实际应用仍然还有一些问题需要深入研究。
(1)目前大多采用单因素实验法探讨水热法制备钛纳米管的影响因素,对于多个制备因素间相互作用规律对钛纳米管结构与性质的影响规律还需探明。寻求操作更简单、条件更温和、效率更高的途径仍是该方法的发展方向。
(2)水热法与超声、微波等技术耦合有效地缩短了水热反应时间,提高了钛纳米管产率,甚至可获得结构各异的钛纳米管材料,但协同调控机制还不明晰。
(3)以水热法制备的钛纳米管为载体,通过离子交换、浸渍-焙烧等方法制备改性的钛纳米管基材料,有效地改善了钛纳米管性能,如何优化负载或掺杂策略,增强活性组分在钛纳米管中的稳定性还值得进一步研究。另一方面,金属元素、非金属元素及其他材料同钛纳米管制得的复合材料在调变性能机理上还有待深入探讨。
(4)通过调变水热合成法参数获得表面富含羟基的钛纳米管,并以此实现钛纳米管表面功能化修饰,为改善钛纳米管性能、拓宽钛纳米管应用领域提供了重要思路。

