紫色红曲霉的微波诱变及其产红曲色素发酵条件的优化
武金霞,王琰,谭政浩,刘爽,隋思强 ,张贺迎
(1.河北大学 生命科学学院,河北 保定 071002;2.河北大学 生物技术研究中心,河北 保定 071002)
紫色红曲霉(Monascuspurpureus)属于真菌界Fung,子囊菌门Ascomycota,散囊菌纲Eurotiomycetes,曲霉目Eurotiales,曲霉科Aspergillaceae,红曲霉属(Monascus)[1].红曲是红曲霉属菌株发酵大米制成,为药食两用传统中药[2],红曲色素是由红曲霉属菌株产生的聚酮类混合物[3-5],主要分为红、橙、黄3大类,并且色素之间会随着pH值的变化发生可逆性转换[6-7],耐热性较强,熔点为160~190 ℃[8].红曲色素作为天然色素,其传统应用多为染色[9-10],尤其是食品着色[11],但越来越多的文献报道红曲色素具有多种生物活性[12],如抑菌[13]、抗氧化[14]、降血脂[15]以及抑制癌细胞增殖、促使其凋亡等[16].因此,高产红曲色素的红曲霉菌株选育及发酵研究具有重要意义,是进一步开发红曲色素的基础.
本研究以微波诱变紫色红曲霉S1(Monascuspurpureus),筛选高产红曲色素的突变株,通过优化固态发酵条件大大提高了其产红曲色素的水平.
1 材料与仪器
1.1 菌种
紫色红曲霉S1 (Monascuspurpureus),本实验室保存.
1.2 培养基
大米豆粕斜面及平板培养基:大米 70 g、豆粕 30 g 于500 mL 水中煮0.5 h,沥出液体加水至500 mL,添加琼脂使其质量分数为2%,pH 5~6.
种子培养基:大米粉4 g,蛋白胨6 g,硫酸镁0.4 g,磷酸氢二钾0.3 g,蒸馏水100 mL.
色素发酵基础培养基:大米 20 g 装入 250 mL 三角瓶中,加水24 mL,封口,于121 ℃灭菌20 min.
1.3 实验仪器
HWS恒温智能培养箱(宁波东南仪器有限公司);722 型分光光度计(上海第三分析仪器厂);数显恒温水浴锅 HH-4(金坛市杰瑞尔电器有限公司);恒温智能振荡器(上海智城分析仪器制造有限公司);微波炉;细胞计数器.
2 实验方法
2.1 微波诱变
将紫色红曲霉S1在斜面培养基上培养至长满孢子,以无菌生理盐水制备孢子悬液,稀释至105~106个/mL,分装至无菌试管中,装液量5 mL,于微波炉(输出功率700 W)中进行诱变处理0、40、80、120、160、200 s,每处理5 s将试管取出,冰浴去除热效应,诱变时间为微波处理的累加时间.以处理0 s的孢子悬液为对照组,涂布平板培养后计算致死率.
2.2 菌株的初筛与复筛
将培养3 d后平板上长出的菌落每4个点接于同一平板上培养,比较平板上菌落的生长情况,从中挑选色素圈较大,且颜色较深的菌落,转接斜面培养,纯化.
将初筛菌株接种于种子培养基,32 ℃摇床培养 3 d后,以 5%接种量接种于色素发酵培养基培养 12 d,依据 GB4926—2008测量红曲色素值(以每g干基多少个U表示,即U/g),比较不同红曲霉菌株的产红曲色素能力.
2.3 红曲霉突变菌株的遗传稳定性实验
将复筛得到的突变菌株连续传代 5代,考查其产色素能力是否稳定.
2.4 不同基质对发酵的影响
将紫色红曲霉S1-29分别接种于粳米、香米、糯米为发酵基质的色素发酵培养基,在32 ℃下发酵 12 d,测量红曲色素值,比较其在不同发酵基质上的产红曲色素能力.
我们离开六渡桥,走进一个胡同,再转入一个胡同,弯弯转转,到达一幢多层楼前。我以为到了地方,一路奔波,我双膝酸软,急需休息。李大头依然领着我们走。我们进了一个更为狭小、更为隐秘的胡同。这让我感觉像是在干什么坏事,比如毒品贩子送货或取货。幸好我身后还跟着一个王幸福。他的存在,让我少了恐惧。
2.5 单因素实验
2.5.1 碳源对紫色红曲霉S1-29发酵产红曲色素的影响
在色素发酵基础培养基中分别添加葡萄糖(质量分数为1%、2%、3%、4%、5%)和甘油(质量分数为0.1%、0.2%、0.3%、0.4%0.5%),pH自然,32 ℃下恒温培养12 d.
2.5.2 氮源对紫色红曲霉S1-29发酵产红曲色素的影响
在色素发酵基础培养基中分别添加酵母粉、蛋白胨(质量分数分别为1%、2%、3%、4%、5%)和氯化铵(质量分数分别为0.1%、0.2%、0.3%、0.4%、0.5%),pH自然,32 ℃下恒温培养12 d.
2.5.3 无机盐对紫色红曲霉S1-29发酵产红曲色素的影响
在色素发酵基础培养基中分别添加硫酸镁、磷酸氢二钾、硫酸锌,使其质量分数分别为0.2%、0.3%、0.4%、0.5%、0.6%,pH自然,32 ℃下恒温培养12 d.
2.6 正交实验
根据以上单因素实验结果,在基础培养基中添加葡萄糖、蛋白胨、硫酸镁、磷酸氢二钾(A、B、C、D),设计4因素3水平正交实验,确定不同添加物的最佳复合配比.
3 结果与分析
3.1 紫色红曲霉S1孢子的微波诱变时间的选择

图1 不同微波诱变时间对紫色红曲霉S1孢子的致死率Fig.1 Fatality rate of Monascus purpureus S1 spores in different time of microwave mutagenesis
3.2 微波诱变菌株的筛选
紫色红曲霉S1经紫外线照射200 s后共得菌株1 000株,挑取其中长势较好的199株点接于平板培养基,培养7 d,从中挑取9个菌落大、色素圈大的突变株.9个突变株复筛红曲色素值结果见表1.
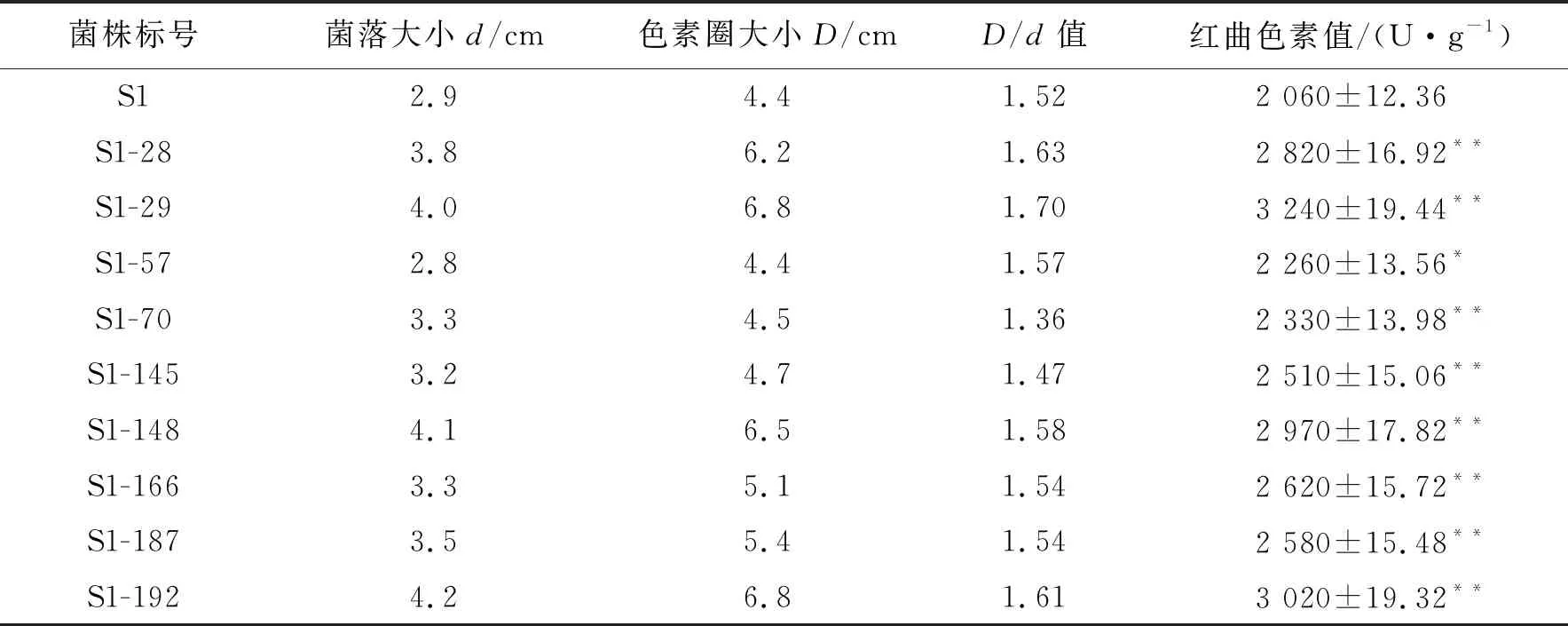
表1 9株紫色红曲霉突变株的红曲色素值
由表1可见,紫色红曲霉突变株S1-29和S1-192产红曲色素值较高,较出发株分别提高57.3%和56.3%.后续研究以紫色红曲霉S1-29为实验对象.
3.3 紫色红曲霉S1-29的遗传稳定性实验
将紫色红曲霉S1-29连续传代5代,每传1代都进行产色素发酵实验,红曲色素值分别是3 250、3 260、3 160、3 170、3 140 U/g,平均值(3196±55.05)U/g,表明该菌株有较好的遗传稳定性.
3.4 紫色红曲霉S1-29在不同基质中的产红曲色素能力
不同种类的米营养成分差别较大,主要区别在于直链淀粉和支链淀粉含量不同,实验结果(表2)表明,紫色红曲霉 S1-29 在粳米基质中产色素能力最强.

表2 紫色红曲霉S1-29在不同基质中的产红曲色素能力
3.5 单因素实验结果
3.5.1 添加不同碳源对紫色红曲霉S1-29产红曲色素的影响
以粳米基质培养紫色红曲霉S1-29时,需发酵12 d红曲色素值才能达到最大值.添加葡萄糖和甘油可缩短其发酵周期到11 d.添加葡萄糖质量分数为4%时,其红曲色素值达到3 360 U/g,添加葡萄糖质量分数为5%时, 红曲色素值有所提高,但差异不显著.添加甘油质量分数为0.4%时产红曲色素值最高,达3 310 U/g,继续增加甘油添加量,红曲色素值反而降低.结果见图2.
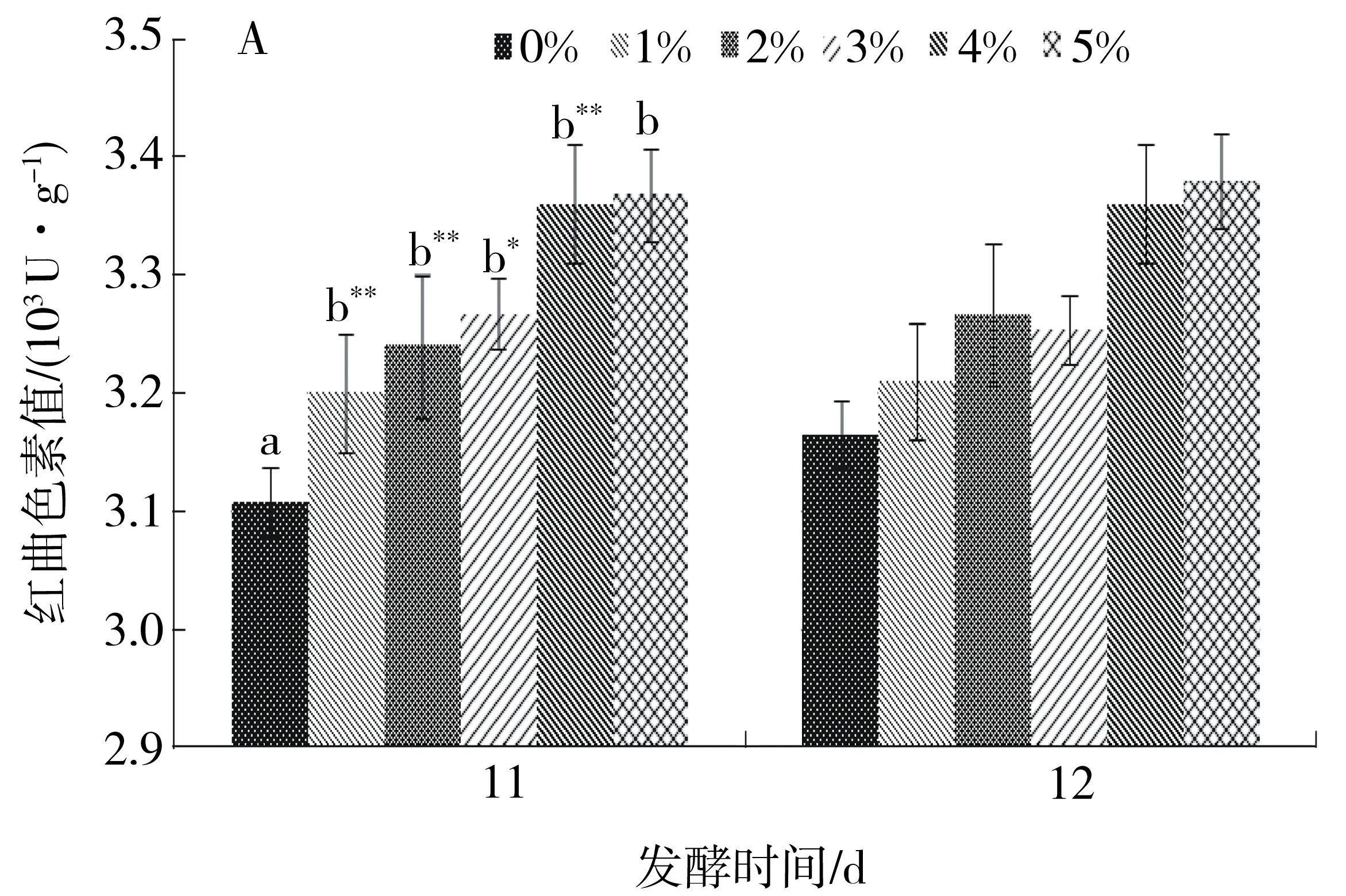
A.葡萄糖;B.甘油.
3.5.2 添加不同氮源对紫色红曲霉S1-29产红曲色素的影响
添加不同质量分数的蛋白胨、酵母粉、氯化铵对紫色红曲霉S1-29的发酵周期没有影响,但均能提高其产红曲色素水平,其中添加5%蛋白胨时紫色红曲霉S1-29产色素能力最大,红曲色素值可达3 453 U/g,其次为3%的酵母粉(3 356 U/g)以及0.3%的氯化铵(3 322 U/g).结果提示有机氮源对其产红曲色素具有较大的促进作用,见图3.
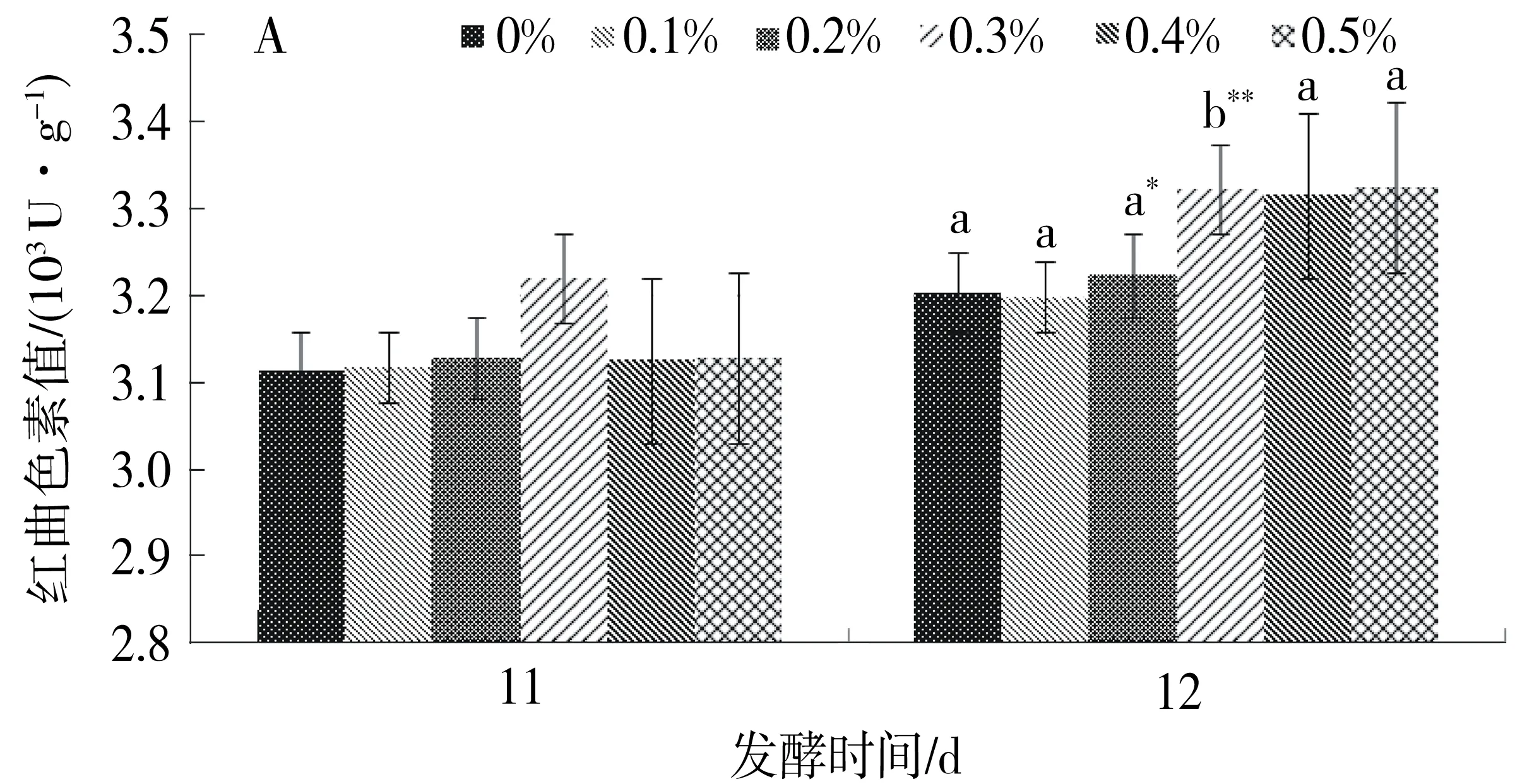

A.氯化铵;B.酵母粉;C.蛋白胨. 发酵12 d与发酵11 d比较: a.差异极显著(P<0.01);b.差异显著(P<0.05).
3.5.3 添加不同无机盐对紫色红曲霉S1-29产红曲色素的影响
图4结果显示,基质中添加硫酸镁和磷酸氢二钾质量分数分别为0.4%时,紫色红曲霉S1-29产红曲色素的能力极显著提高,红曲色素值可分别达3 408 U/g和3 360 U/g,添加硫酸锌能小幅提高色素产量,添加量影响不显著(图略).
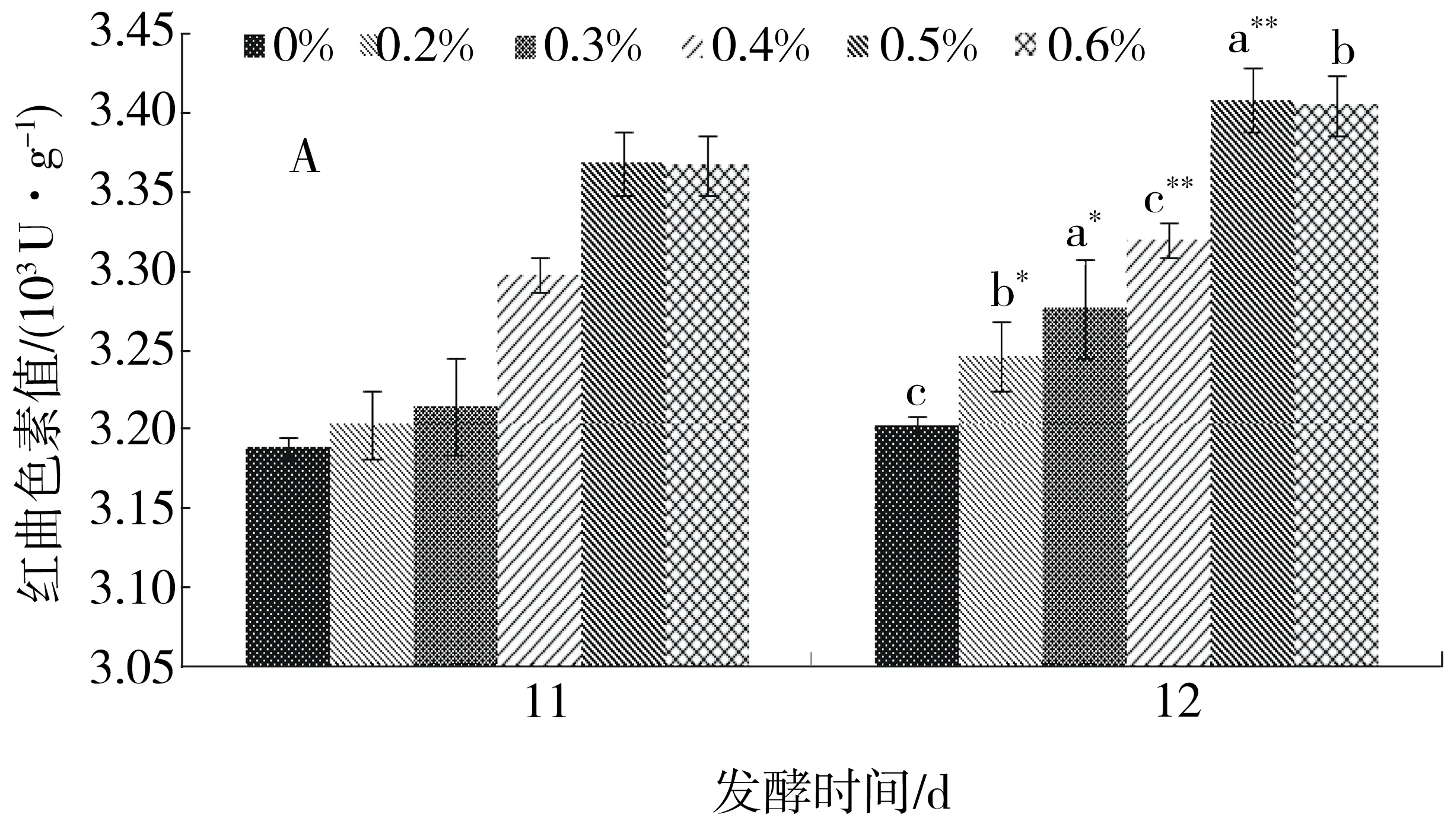
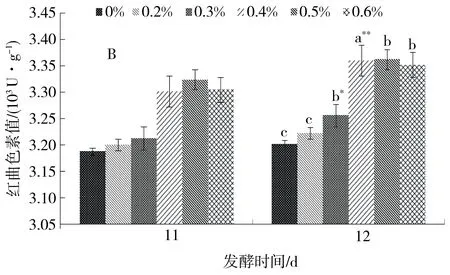
A.硫酸镁;B.磷酸氢二钾. 发酵12 d与发酵11 d比较: a.差异极显著(P<0.01);b.差异显著(P<0.05);c.差异不显著.
3.6 正交实验结果
依据单因素实验结果,选择对紫色红曲霉S1-29产红曲色素提高较明显的4个因素做正交实验,结果见表3.
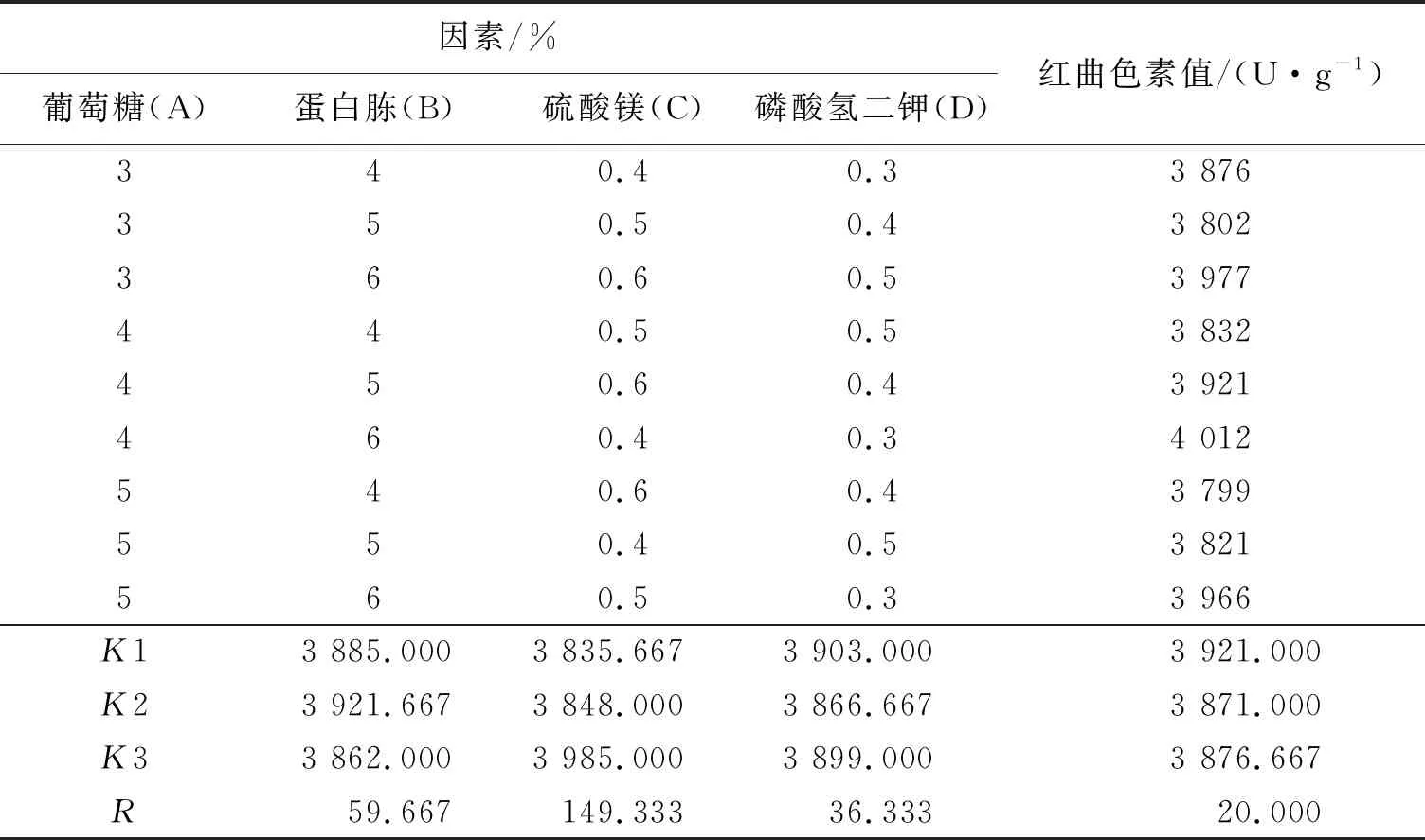
表3 正交实验结果与分析
由直观分析可知,对于产红曲色素的影响大小是B>A>C>D,氮源对产红曲色素影响最大.确定紫色红曲霉S1-29固态发酵的添加物最佳配比为A2B3C1D1,即葡萄糖、蛋白胨、硫酸镁和磷酸氢二钾添加量(质量分数)分别为4%、6%、0.4%和0.3%.为考察上述发酵条件的稳定性,按该实验条件实验3次,分别测得紫色红曲霉S1-29发酵产红曲色素值为4 006、4 013和3 991U/g,平均值(4 003.33±11.24)U/g,说明该条件稳定可行.
4 讨论
近年来红曲色素越来越多的生物学活性被发现,如何提高红曲霉产红曲色素的水平也成为研究的热点.邓加聪等[17]研究发现添加一定量硫酸亚铁和维生素B1能提高发酵红曲色素值,液态摇瓶发酵时红曲色素值可达714.80U/mL.Agboyibor等[18]发现在偏酸性初始pH5.0条件下,以含有10g/L蛋白胨和1.5g/L丙酮酸的培养基发酵,红曲黄色素和红色素可达(574.76±6.18)U/mL和(570.98±7.66)U/mL.Patrovsky等[19]发现pH2.5添加8.8g/L蛋白胨可以提高红曲色素的黄色素和橙色素产量,两者之和达1 138mg/L.童爱均等[20]通过响应面优化在添加果糖(质量分数,下同)0.54%、氯化铵0.06%和初始含水量46.00%时固态发酵得到红曲红、橙、黄3种色素之和为6 684.16U/g.
通过红曲霉育种也能较大幅度地提高红曲色素产量,如常聪等[21]采用紫外-氯化锂复合诱变方法诱变育种得到红曲霉菌株QH12,其红曲红色素值达到2 450U/g.Liu等[22]利用等离子体诱变技术得到紫色红曲霉菌株M183,固态发酵红曲色素值达8 460U/g.本研究将微波诱变与固态发酵条件优化相结合,紫色红曲霉S1-29产红曲色素值平均达4 003U/g.
目前大规模的红曲霉发酵还是以液态发酵为主.目前市场上还没有自动化控制程度较高的固态发酵装置,无论实验室规模,还是生产规模,多采用筛框进行分批固态发酵,劳动强度大,生产效率低.与液态发酵相比,固态发酵具有无废水排放、无污染的优点,因此研究红曲霉大规模固态发酵工艺,如发酵装置的改进及其自动化控制、通风通氧条件优化等,对于提升红曲色素及其他固态发酵产物的生产水平具有重要意义.

