花椒碳点荧光探针的制备及对牛奶中溴代乙酰胆碱的检测
李志英,段亚琴,张慧,雷嘉昕
(忻州师范学院 化学系,山西 忻州 034000)
碳量子点(CDs)是近几年新发展起来的一种新型的碳纳米材料,是荧光碳纳米材料中最重要的一种,也称为碳纳米点、碳纳米晶和碳点[1],是尺寸在 10 nm 以下、单分散、几何形状近乎球型的碳纳米功能材料.相对于传统的半导体量子点与有机染料,CDs粒径小,水溶性好,化学惰性高,易于功能化,耐光漂白,低毒性,并且具有良好的生物相容性[2].正是因为CDs的这些优越的性质,所以在生物以及药物领域中的应用才越来越广泛[3-4].
溴代乙酰胆碱(ACH)是一种化学物质,在神经系统中担当信使[5],与睡眠、运动、学习记忆有着密不可分的联系,广泛分布于中枢神经系统,对ACH的测定,常采用电化学检测法[6-7],此外还有放射免疫法、荧光分光光度法、高效液相色谱法和离子选择性微电极法等[8].本实验以食用花椒制备的CDs为荧光探针,考察了不同条件下ACH对CDs荧光的增强作用,这种方法操作简单,结果准确,稳定性好,可用于制备快速检测生物体内ACH的传感器.
1 实验部分
1.1 仪器与试剂
电热恒温鼓风干燥箱(上海捷呈实验仪器有限公司);岛津UV2550紫外可见光谱仪(岛津公司,苏州);岛津RF-5301PC荧光分光光度计(日本岛津有限责任公司);Tecnai G2 F205-TWIN透射电子显微镜(美国FEI公司)
溴代乙酰胆碱(ACH)溶液(上海抚生实业有限公司):准确称取 0.022 6 g的ACH固体,用少量蒸馏水溶解,定容到100 mL的容量瓶中,得1×10-3mol/L的溶液备用;硫酸奎宁(上海跃腾生物科技发展有限公司):称取0.04 g硫酸奎宁于100 mL干燥的烧杯中,用0.050 mol/L硫酸溶解,定容至100 mL容量瓶得1×10-3mol/L硫酸奎宁以备用.牛奶、酸奶原液(蒙牛纯牛奶,北京通州食品工业区),花椒(购于忻州市华美超市),实验所用其他试剂为分析纯,水为二次蒸馏水.
1.2 实验方法
1.2.1 CDs的制备
准确称取0.1 g研磨后的食用花椒粉放入坩埚中,然后控制烘箱温度在200 ℃,加热20 min,冷却后用1 mol/L的NaOH溶液溶解,用蒸馏水定容至100 mL.
1.2.2 CDs的表征
将CDs溶液干燥后,用Tecnai G2 F205-TWIN透射电子显微镜进行检测.取制备好的CDs溶液 0.3 mL定容于25 mL比色管中.设定狭缝宽度为10 nm,荧光比色皿厚度为1 cm,于λex、λem分别为315、429 nm处测定荧光光谱.并以蒸馏水为空白对照,在200~400 nm下测定紫外光谱.
1.2.3 CDs荧光量子产率的计算[9]
取2支25 mL的比色管,1支加入0.3 mL CDs,另1只加入1×10-7mol/L的硫酸奎宁1 mL,定容,以蒸馏水为空白,利用紫外光谱仪,在波长320 nm下测定溶液的吸光度.然后调整荧光光谱仪狭缝宽度为10 nm,荧光比色皿厚度1 cm,于λex、λem分别为315、429 nm处分别测定溶液的荧光光谱.
所获各参数代入量子产率公式中进行荧光产率的计算,计算公式为
Yu=Ys×Fu/Fs×As/Au.
Yu——待测未知样品的量子产率;Ys——标准物质的荧光量子产率;Fu、Fs——待测样、标准物稀释液的积分荧光强度;As、Au——标准物、待测样在激发波长处最大吸光度值.
1.2.4 CDs对ACH的检测
取2支10 mL比色管,分别加入制备好的CDs 1 mL,β-环糊精(β-CD)溶液1 mL,其中1支试管加入适量一定浓度的ACH,加蒸馏水稀释至10 mL,狭缝宽度10 nm,λex/λem=315/429 nm,利用荧光分光光度计测定CDs的荧光强度F0以及加入ACH体系的荧光强度F,并计算ΔF(ΔF=F-F0)值.
2 结果与讨论
2.1 CDs的表征
用普通微栅支持膜浸渍在CDs溶液中,放在红灯下烘干后扫描CDs直径的大小.分别配制1×10-4mol/L的ACH、CDs和CDs+ACH溶液,利用紫外可见光谱仪,石英比色皿厚度1 cm,在200~400 nm测定紫外吸收光谱.用荧光分光光度计,将狭缝宽度设为10 nm,在激发波长为315 nm和发射波长为429 nm处测定荧光光谱.
图1可以看出制备的CDs为球形,粒径大小为2~10 nm,碳点平均直径为4.2 nm.从图2中可以看出CDs和ACH在260 nm处没有紫外吸收,二者混合后有紫外吸收,由图3可知,ACH没有荧光,CDs中加入ACH,体系的荧光会增强,表明ACH对CDs荧光具有增敏作用.

图1 透视电子显微镜图Fig.1 TEM images of CDs
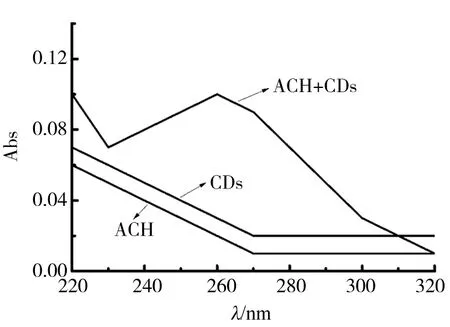
图2 ACH和CDs作用的紫外吸收光谱Fig.2 UV spectra of interaction of ACH and CDs
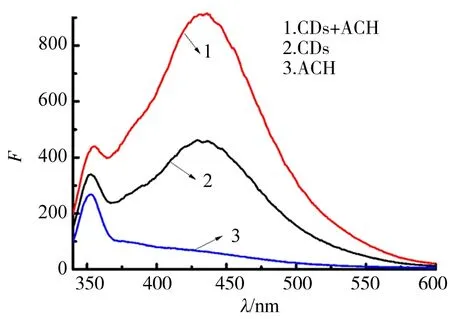
图3 ACH和CDs作用的荧光光谱Fig.3 Fluorescence spectra of interaction of ACH and CDs
2.2 制备温度和时间的选择
称取0.1 g食用花椒粉5份,置于烘箱中,将温度分别控制在180、190、200、210、220 ℃,加热20 min,冷却后用1 mol/L的NaOH溶液溶解,用蒸馏水稀释定容至100 mL.控制时间分别为5、10、15、20和25 min,按1.2.1的方法测定发射波长为429 nm时CDs荧光强度F0,确定CDs的制备温度和时间,结果见图4、5.
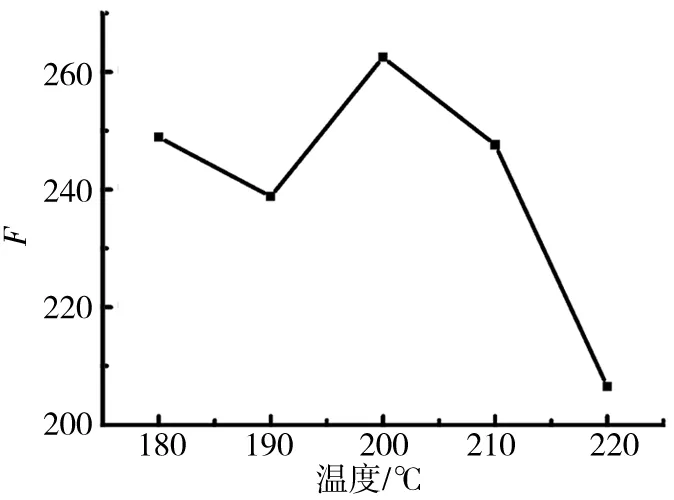
图4 烧灼温度对CDs荧光的影响Fig.4 Effect of cautery temperature on fluorescence of CDs
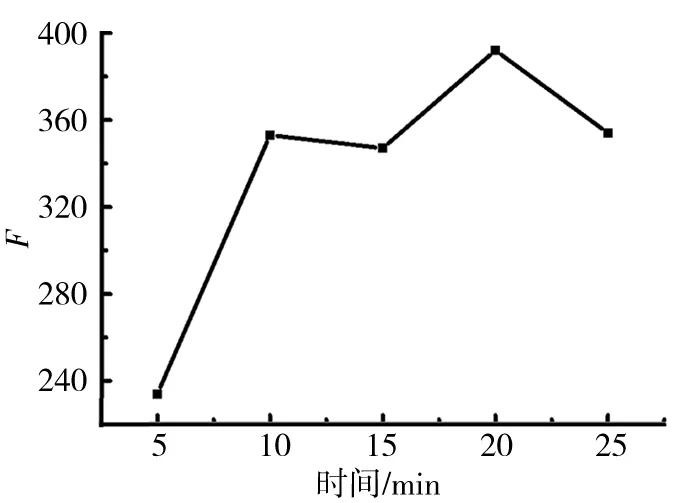
图5 烧灼时间对CDs荧光的影响Fig.5 Effect of time of cautery on fluorescence of CDs
从图4中可以看出,在200 ℃时,CDs的荧光强度最大,因此,200 ℃为CDs制备的最佳温度.从图5中可以看出,在200 ℃下加热20 min时,荧光强度最大,所以20 min为最佳制备时间.
2.3 pH值和放置时间及修饰剂对量子点荧光强度的影响
取5支10 mL的比色管,分别依次加入制备好的CDs 和β-CD溶液各0.1 mL,加蒸馏水稀释至10 mL,分别考察放置时间及修饰剂和pH值对CDs荧光强度的影响,结果见图6、7.
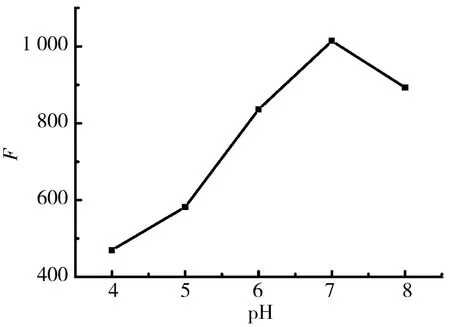
图6 pH值对CDs稳定性的影响Fig.6 Effect of pH on the fluorescence intensity of CDs
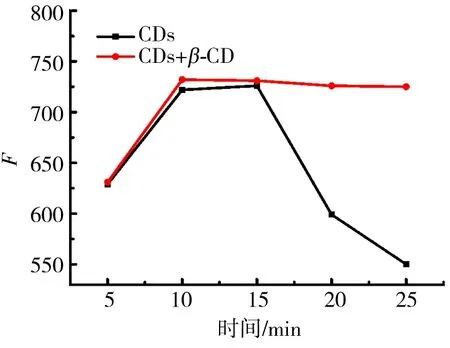
图7 时间对CDs稳定性的影响Fig.7 Effect of placement time on the fluorescence intensity of CDs
由图6可知,pH值为4~7时,CDs的荧光强度逐渐增强.原因可能是酸性条件下β-CD水解,保护作用减弱,荧光猝灭,且从数据可以看出pH在偏酸性时对体系影响较大,因此CDs的最佳pH值为7.从图7可知,加入β-CD溶液0.1 mL后,放置时间对CDs的荧光强度的影响不大,比较稳定.
2.4 CDs荧光量子产率的测定.
按1.2.3的方法测定,将测定的各参数代入量子产率计算公式,计算CDs荧光量子产率,计算结果见表1.

表1 荧光碳点的量子产率
2.5 CDs和不同物质的响应
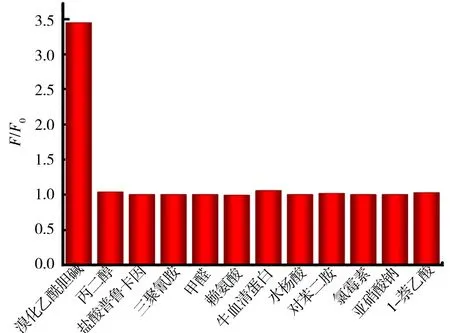
图8 CDs对不同物质的响应Fig.8 Response of CDs to different compounds
取13支10 mL的比色管,均加入CDs原液0.1 mL,除1号管外,其他各管加入1 mL,1×10-4mol/L各响应物质溶液(ACH,丙二醇,盐酸普鲁卡因,三聚氰胺,甲醛,赖氨酸,牛血清蛋白,水杨酸,对苯二胺,氯霉素,亚硝酸盐,1-萘乙酸),加蒸馏水稀释至10 mL,室温下反应5 min,摇匀.将荧光分光光度计狭缝宽度设为10 nm,在λex/λem=315/429 nm处测定荧光强度.结果如图8所示.由图8可知,F/F0的巨大差异表明CDs对ACH具有良好选择性.
2.6 测定体系的pH值和反应时间的选择
取5支10 mL的比色管,5支比色管中分别加入制备好的CDs 0.1 mL,将pH值调为4.0、5.0、6.0、7.0、8.0,再分别依次加入1×10-3mol/L ACH 1 mL,定容,测定CDs 以及反应体系的荧光强度F,试剂空白(未添加ACH)荧光强度为F0,计算ΔF(ΔF=F-F0)值.结果如图9.同条件下测定反应时间分别为5、10、15、20、25 min时的ΔF,结果见图10.
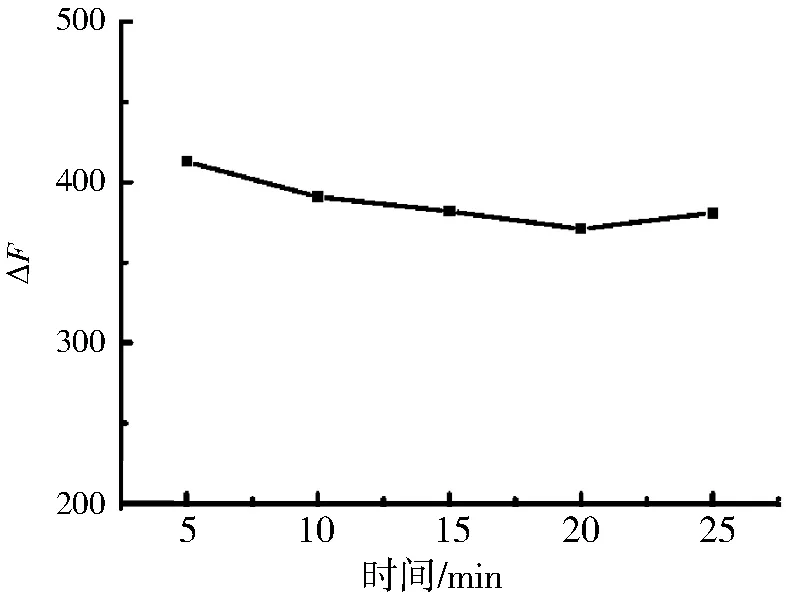
图10 反应时间对荧光光谱的影响Fig.10 Effect of reaction time on fluorescence spectra
实验表明,调节pH值为7时,ΔF最大,从数据可以看出,pH偏酸性时对体系影响较大,而混合液本身的pH值为7,所以本实验选择不加缓冲溶液.反应时间为5 min ΔF最大,在20 min内基本不变,体系比较稳定.
2.7 工作曲线及检出限
取10 mL的比色管,分别依次加入1×10-5mol/L ACH 0 、 0.08、0.2、0.3、0.8、1.0、1.1 、1.2、1.3 、1.4 、1.6 、1.7 mL,再加入CDs 和β-CD溶液各0.1 mL,定容至10 mL,反应5 min后,测定各溶液的荧光强度F0和F,并计算ΔF(ΔF=F-F0).结果见图11、12.取11支10 mL的比色管,依次加入制备好的CDs 0.1 mL,加蒸馏水稀释至10 mL,测定荧光强度F,求得其标准偏差(σ)为1.75×10-6mol/L,相对标准偏差为0.37%,利用3σ/K公式求得检出限为1.62×10-8mol/L.
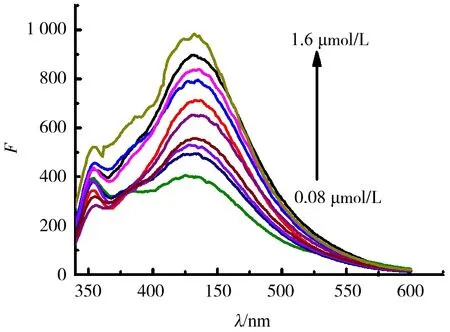
图11 ACH与CDs作用的荧光光谱Fig.11 Fluorescence spectra of CDs with ACH
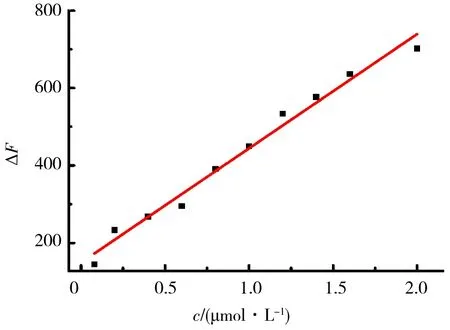
图12 ACH 和 ΔF的工作曲线Fig.12 Work curve of ACH and ΔF
实验结果表明,当ACH浓度在0.08~1.6 μmol/L时与ΔF呈良好的线性关系.绘制工作曲线,其线性回归方程为ΔF=314.72c+134.54,r=0.997 9.
2.8 干扰离子的测定

2.9 样品测定
量取5 mL牛奶于25 mL比色管中,加入8 mL的乙腈溶液,震荡混匀后用超声波提取,设定温度60 ℃,功率为280 W,时间为20 min,抽滤后转移到25 mL离心管中,常温下沉降蛋白质10 min,以1 000 r/min高速离心5 min.平行3次实验,并计算相对标准偏差和回收率,结果见表2.
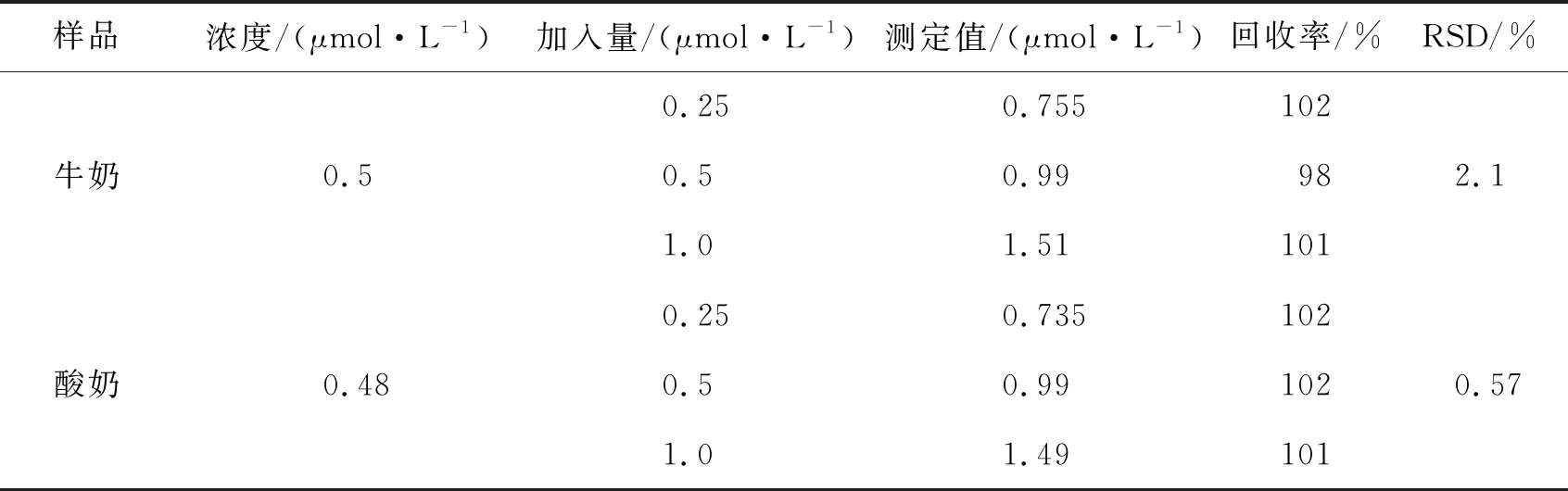
表2 样品的测定及回收率
3 结论
实验用花椒为碳源制备了CDs,并探讨了制备CDs的最佳条件,以及考察了pH值和时间对CDs稳定性的影响.建立了CDs检测乙酰胆碱的新方法,该方法操作简便,无毒无害,并且检出限低.在最佳条件下,该方法的线性为0.08~1.6 μmol/L,线性方程为ΔF=314.72c+134.54,相关系数r=0.997 9,检出限(3σ/K)为1.62×10-8mol/L,并对样品进行了测定,回收率为98%~102%.

