一株硫酸铵耐性菌株的分离鉴定及其特征研究
龙婉婉,王金凤,廖永辉,贺根和
(1.井冈山大学生命科学学院,江西,吉安343009;2.江西省红壤丘陵区农业环境污染防治重点实验室,江西,吉安343009)
0 引言
离子型稀土矿是我国重要的战略资源,主要分布在南方的江西、广东、福建等省份,其中以江西省赣州市开采时间最早、开采量最多。由于早期采用的池浸、堆浸工艺较为落后,稀土冶炼过程中使用了大量的硫酸铵、碳酸氢铵等化学试剂,堆场土壤中残留的氨氮不仅会通过渗滤作用进入地下水体,而且在雨水的冲刷和地表径流的作用下经沟渠汇入附近的河流,造成矿区附近土壤及水体严重的氨氮扩散性污染[1-2]。因此,赣南稀土矿区堆场土壤氮污染的修复已刻不容缓。
矿区污染土壤修复已成为世界普遍关注的环境问题之一。矿区废弃地的修复方法有很多,有使用一定的固体材料,对矿业开采留下的矿坑或沦陷区进行充填的物理填充恢复技术和表土转换、物理隔离等物理修复方法技术[3],以及利用施加化学物质对氨氮的控制、人工控制其酸碱度的化学修复方法技术。近年来,微生物修复方法由于成本较低,环境友好等特征在矿区废弃地污染治理中得到广泛应用[3-4]。越来越多的研究表明,将微生物与载体(有机肥、黏土矿物、生物碳、磷灰石、硅藻土等)结合做成的生物有机复合材料是微生物修复技术最为有效的方式[5-6]。然而针对赣南稀土矿区氨氮污染场及酸性环境场的微生物修复技术的研究鲜见报道,微生物种质资源及相关的基础理论研究也不够深入,这极大限制了微生物修复技术在稀土矿区氨氮高污染土壤中的研究。
赣南稀土尾矿土壤长期被高浓度硫酸铵胁迫,必然让更多的本土微生物具有适应该胁迫的进化趋势(微生物的一些基因可能被诱导表达或DNA序列发生特定的改变),使微生物更具有稳定耐性基因资源,从而通过形态,生理生化的适应性来增强细胞对硫酸铵的适应性[7]。本研究从赣南稀土矿区高浓度硫酸铵污染的稀土尾矿土壤中,筛选硫酸氨耐受性微生物,研究其对硫酸铵耐性的生理生化特性。研究结果可为稀土矿区土壤的生态环境修复提供科学依据,同时对促进矿区及周边农业可持续发展和生态保护、实现国家生态文明建设和赣南苏区振兴发展战略具有重要的理论意义和现实意义。
1 材料与方法
1.1 供试土壤样品采集及处理
供试土壤样品取自江西省赣州市龙南县足洞稀土钇矿区(24°51'46"N,114°50' 35" E)2~20 cm的土层。土壤样品的部分理化性质如下:pH 为4.4,总氮2 g/Kg,总磷0.033 g/Kg,TOC2.08 g/Kg,Yi 3.4 mg/Kg,Nd 0.52 mg/Kg,氨氮380.56mg/Kg,硫酸根离子45.33mg/Kg,土壤样品硫酸铵含量较高。样品取好后用封口袋封装带回实验室,风干、磨碎并过2 mm 筛后,取土壤10 g 加入90 mL 无菌去离子水中,摇床震荡2小时后静置30 min,取上清备用。
1.2 硫酸铵耐性菌株的培养与分离
取新鲜的土壤溶液1 mL加入到9 mL含硫酸铵浓度为0.1 mol/L的新鲜LB 培养基中(葡萄糖5 g/L,蛋白胨10 g/L,酵母提取物2 g/L,NaCl2g/L,制霉菌素50 mg/L,pH 7.0),37℃摇床振荡24 h。静置后取1mL 溶液,加入含硫酸铵浓度为0.2 mol/L 的LB液体培养基中,28℃摇床振荡培养约24 h。用同样的驯化方法,直到LB培养液中硫酸铵浓度提高至1.0 mol/L。取最后一次驯化的培养液用稀释平皿法涂布于固体培养基平板上,每个浓度设置3个平板,于28℃恒温培养箱倒置培养24~48 h 后形成单菌落。随机挑取培养基上单个独立长势较好的菌落,置于1.5 mL 离心管并编号,管中加入30μL的LB液体培养基置于摇床,28℃、200 r/min 进行富集培养1 h 后,加甘油于−20℃保存备用。
1.3 菌株PCR-RFLP分析及种属鉴定
运用巢式PCR(nested-PCR)完成分离菌的16 S rDNAs 的扩增。第一轮反应(体积25 µL)含1 µL(大约1 ng)DNA 为模板,0.5 µL 引物(10 µM),2µL的dNTP混合物(2.5 mM),1.5µLMgCl2(25 mM),2.5 µL10×PCR 反应缓冲液和0.2 µL Taq DNA 聚合酶(5 U/µL,Takara)。在第一轮反应的引物为:27f (5'- AGAGT TTGAT CCTGG CTCAG -3')和1492r (5'-TACCT TGTTA CGAC TT- 3')。PCR反应程序:94℃预变性5 min,94℃30 s,55℃40 s,72℃1 min,共10个循环,最后72℃延伸10 min。第二轮反应以第一轮反应的PCR 产物为模板,引物为:63f(5'-CAGGC CTAAC ACATG CAAGT C-3')和1389r(5'-ACGGG CGGTG TGTAC AAG-3')。在这一轮反应中,设置30个循环,反应条件同第一轮反应。PCR 结束后,产物用含1%溴化乙锭的琼脂糖凝胶电泳、检测(大约1500 bp 长度的片段为目标片段)。
将PCR 产物分别用限制性内切核酸酶HhaI 和RsaI 消化(37℃,1 h)。酶切DNA 片段用2%的琼脂糖凝胶电泳分离,经溴化乙锭染色和凝胶成像系统成像后,所得DNA 带型图谱在GIS 凝胶分析软件辅助下进行人工比较分析。以基因片段多态图谱为基础进行聚类,聚合到一起的具有相同图谱的克隆视为相同的基因型。每一个基因型作为一个分类操作单位(OTU, Operational Taxonomic Unit)或称为唯一基因型[7]。将16 S rDNA PCR 产物用1%的琼脂糖凝胶电泳分离并用琼脂糖凝胶分离纯化试剂盒进行纯化。通过TA 克隆技术将纯化后的16S rDNA 片段转化到E.coliDH5α 中,氨苄青霉素及蓝白斑筛选挑取阳性克隆子送上海生工进行序列测定。测序结果与GenBank 数据库中的16 S rDNA 序列进行比对分析,获得最相近菌株的16 S rDNA 序列。通过MEGA5.0 软件,用Neighbor-joining 构建系统发育进化树。
1.4 菌株的形态特征
将耐性菌株接种到LB固体培养基,28°C培养48 h 后进行生理生化检测,检测内容包括:革兰氏染色、V.P.测定、吲哚的产生、硝酸盐还原反应、水解反应(脲素、山梨醇)和碳源利用情况(葡萄糖、精氨酸、甘露醇、麦芽糖、苹果酸、苯乙酸)。测定方法参照《伯杰氏系统细菌学手册》。
1.5 菌株对硫酸铵胁迫的响应特征
挑取纯化后的菌株于LB液体培养基中,28℃,200 rpm/min 过夜培养,取该菌液1 mL接种于100 mL 的LB液体培养基中,并向培养基中添加硫酸铵,使其终浓度分别为0.1、,0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mol/L,28℃,200 rpm/min摇床培养,每隔相同时间进行取样,测定其OD600值,并在24 h 测定菌株的FDA 水解酶[8]、蛋白酶、脱氢酶和过氧化氢酶的活性[9]。
1.6 菌株对pH变化的响应特征
挑取纯化后的菌株于LB 液体培养基中,28℃,200 rpm/min 过夜培养,取该菌液1mL 接种于100 mL的不同pH 值(2.5~8.5)的LB 液体培养基中,28℃,200 rpm/min 摇床培养,每隔相同时间进行取样,测定其OD600值,同时测定菌株的FDA 水解酶、蛋白酶、脱氢酶和过氧化氢酶的活性。
1.7 菌株对不同抗生素的响应特征
取1 mL 活化的菌液接种于LB培养基,分别添加氨苄青霉素、四环素、硫酸链霉素和氯霉素四种抗生素,同时添加终浓度为0.5 mol/L的硫酸铵,每个实验设置3个平行重复,28℃,200 rpm/min摇床培养24 h,测定其OD600值。同时,测定非敏感性培养液中FDA 水解酶、蛋白酶、脱氢酶和过氧化氢酶的活性。
1.8 菌株对氨氮和硫酸盐的降解效果
挑取纯化后的菌株于LB液体培养基中,28℃,200 rpm/min 过夜培养,取该菌液1 mL 接种于100 mL的LB液体培养基中,并向培养基中添加硫酸铵,使其终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mol/L,28℃,200 rpm/min 摇床培养,每隔相同时间进行取样,测定溶液中氨氮和硫酸盐的浓度[10]。
1.9 数据分析
用Excel 软件对数据进行分析处理。
2 结果与分析
2.1 硫酸铵耐性菌株的分离
在含硫酸铵的LB富集培养基上驯化分离获得5个菌株。经过对5个菌株进行划线分离后挑取单菌落保存备用(标记为1~5)。
2.2 菌株的PCR-RFLP分析
运用巢式PCR(nested-PCR)对菌株1~5进行16 S rDNAs 扩增。PCR 扩增产物分别用限制性内切核酸酶RsaI 和HhaI 消化(37℃,1 h),酶切后的电泳图谱见图1。图中DNA 酶切的结果显示为同一种基因型。

图1 菌株16S rDNA PCR-RFLP结果图Fig. 1 Strain of 16S rDNA PCR-RFLPproduct
2. 3菌株的形态和生理生化特征
在LB固体平板上,菌株LNa 菌落不透明、乳白色、小而扁平、圆形、菌落中间厚,向四周逐渐变薄(图2a)。革兰氏反应阳性,杆状(图2b)。菌株LNa 的生理生化特性见表1。
图2 菌株LNa 菌落形态及革格兰氏染色Fig. 2 Colony morphology and Gram's staining results of Strain LNa
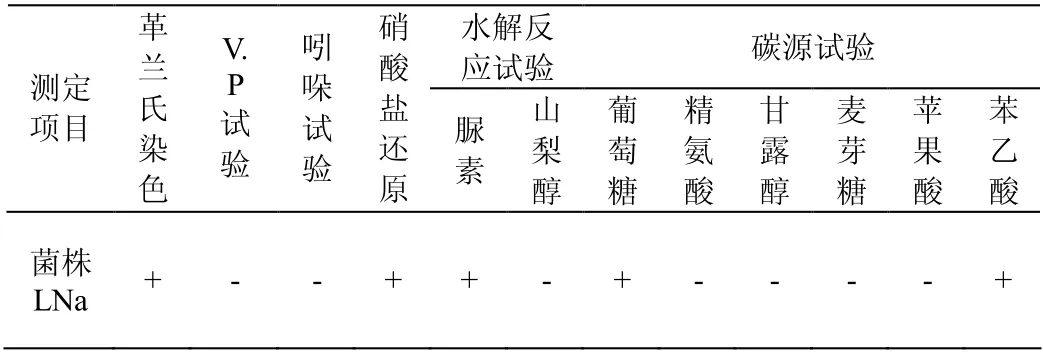
表1 菌株LNa 的生理生化测定Table 1 Physiological and biochemical characteristics of strai n LNa
2.4 硫酸铵耐性菌的种属特征
选取菌株LNa 的16 S rDNA 序列,经TA 克隆、测序测定后在GenBank 数据库中进行Blast 序列比对分析,确定了其种属分类地位(图3)。RDP聚类分析表明菌株LNa 属于短波单胞菌属(Brevundimonassp.),相似性为99%,菌株命名为Brevundimonassp. LNa。

图3 菌株LNa 系统进化树图Fig. 3 Phylogenetic tree derived from 16S rDNA sequence of the Brevundimonas sp. strain LNa
2. 5菌株对硫酸铵胁迫的响应特征
由图4可知,在低于1 mol/L 硫酸铵的条件下,菌株均能正常生长。当硫酸铵的浓度为0.1 mol/L时,在接种6 h 后,菌株开始进入对数期生长,18 h后生长速度减慢,进入稳定期。随着硫酸铵浓度的升高,菌株进入对数期的时间有所延后,说明硫酸铵对菌株的生长有一定的抑制作用,而且会随着硫酸铵的浓度升高而增强(图4a)。同时,这种生长抑制作用也影响菌的FDA 水解酶、蛋白酶、脱氢酶和过氧化氢酶的活性,使其呈现不同程度的下降,其中降幅最大的是蛋白酶。此外,当胁迫浓度上升到0.5 mol/L后,菌株过氧化氢酶活性维持在一定水平后几乎不再发生变化(图4b)。

图4 菌株LNa 对硫酸铵胁迫的响应特征Fig.4 Response characteristics of strain LNa to ammonium sulfate stress
2.6 菌株对不同pH值的响应特征
菌株的最适生长pH 在6~7.5之间,在最适pH条件下,接种6 h 后,菌株生长速率最快,12 h 后生长速度减慢。在pH 低于5.0 或高于8.0 的条件下,菌株几乎不生长(图5a)。测定不同pH 条件下菌液中FDA 水解酶、蛋白酶、过氧化氢酶、脱氢酶的酶活力发现,在0.5 mol/L硫酸铵胁迫浓度下,菌株的蛋白酶、脱氢酶和过氧化氢酶活性随pH的升高变化不明显,但FDA 水解酶活性随着pH 升高呈显著上升趋势(图5b)。

图5 菌株LNa 对不同pH值的响应特征Fig. 5 Response characteristics of strain LNa to different pH values stress
2.7 菌株对不同抗生素的响应特征
为测试菌株的抗生素敏感性,将菌株分别接种到含有氨苄青霉素、氯霉素、硫酸链霉素和四环素及相同浓度的硫酸铵的培养基中过夜培养,发现菌株对氨苄青霉素、氯霉素和四环素敏感,而对硫酸链霉素不敏感。
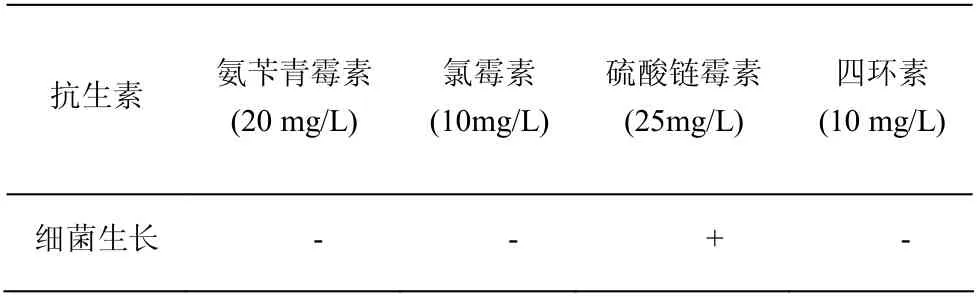
表2 菌株LNa 的抗生素敏感性试验Table 2 Antibiotics sensitive tests of strain
在相同硫酸铵浓度(0.5 mol/L)不同浓度的硫酸链霉素的处理条件下,LNa 菌株酶活性如图6所示。在硫酸链霉素胁迫下,菌液中的FDA 水解酶、蛋白酶、脱氢酶、过氧化氢酶相比没加硫酸链霉素的菌液中酶活力低,FDA 水解酶活力整体上表现为先上升后下降,最后趋于稳定的变化趋势,在胁迫浓度为30 μg/ml 时达到最大值,增幅达42.3%。

图6 不同浓度硫酸链霉素对菌株LNa 酶活力的影响Fig.6 Effects of different concentrations of streptomycin sulfate on the enzyme activity of LNa strain
2.8 菌株对氨氮和硫酸盐的降解效果
菌株LNa 接种6 h 后,菌株LNa 能不同程度地降低培养基中氨氮和硫酸盐浓度,在0.7 mol/L硫酸铵胁迫下降解效果最好,氨氮浓度能降低约29%(图7a),硫酸盐浓度降低约36.7%(图7b)。

图7 菌株对氨氮和硫酸盐的降解效果Fig. 7 Degradation effects of strain LNa to ammonia nitrogen and sulfate
3 讨论
赣南稀土矿由于硫酸铵、碳酸氢铵等富含NH4+和SO42-药剂的大量使用,土壤遗留大量NH4+和SO42-,这些离子不易被富集,导致矿山周边土壤和水环境受到了严重的污染,对生态环境安全造成了极大的威胁[5]。按照“矿山池浸工艺”,每生产1吨稀土氧化物将产生1000~1200吨废水,破坏160~200 m2的地表植被,剥离表土300 m3,大量废水伴随着尾砂使土壤退化、水源和农田受到污染,矿山周围的生态环境日趋恶化[6]。因此,对稀土的开采不单要改进开采方式和工艺,还要治理已经被污染和即将被污染的土壤和水体。大量研究表明利用微生物治理被污染的土壤和水体是一种经济且有效的方法手段[11-14]。然而,目前稀土矿区利用微生物进行堆场土壤污染治理与修复的研究并不多见。
本研究利用传统微生物分离方法并结合分子生物学技术从富含稀土钇的赣州龙南稀土矿区土壤中分离硫酸铵耐受菌株[15]。通过富集驯化、酶切、PCR-RFLP分析、基因测序及NCBI 序列比对,确定了一株短波单胞菌属(Brevundimonassp)硫酸铵耐受菌株LNa,该菌株对硫酸铵的最高耐受浓度可达0.9 mol/L,表现出对硫酸铵较强的耐受性。Tsubouchi 等[16]在海底发现一株好氧异养型的短波单胞菌,表现出较强的反硝化脱氮作用。Naqqash等[17]发现了一株短波单胞菌,发现该菌在植物根际具有较强的固氮作用。通过以上分析并结合我们的研究结果可知,短波单胞菌属细菌可能对硫酸铵具有较好的转化效果。
然而,高咪等[18]通过运用Illumina Mi Seq 高通量测序技术研究了稀土堆场土壤微生物群落结构的变化,发现优势微生物种群中存在假单胞杆菌属细菌,但却没有发现Brevundimonas细菌。该种菌在其它有关硫酸铵抗性微生物的研究中也鲜有报道。可见,Brevundimonas sp. LNa 是一株新发现的硫酸铵耐受菌株,对研究稀土堆场土壤硫酸铵的转化有着非常重要的意义。
微生物对环境胁迫因子的耐受性容易受溶液pH、初始胁迫浓度、生物量及吸附时间等因素的影响[19-20]。本研究发现酸影响菌株LNa 对硫酸铵的耐受性,菌株最适生长pH在6-7之间。pH 低于5.0或高于8.0的条件下,菌株几乎不生长。在低于1 mol/L 硫酸铵的条件下,菌株生长正常,随着硫酸铵浓度的升高,菌株进入对数期的时间延后,并且会随着硫酸铵的浓度升高抑制作用显著增强,表现出明显的双胁迫现象,这与大多数文献报道的结果是一致的。
微生物对外界环境胁迫的抗性机制主要有二种方式。第一种是体外方式,即当微生物体受到胁迫时,通过合成分泌一些螯合物与胁迫因子结合,阻止其被细胞所吸收[21];第二种是体内方式,将被吸收至细胞内的胁迫因子与某些蛋白结合形成复合物,通过一些酶促反应解除毒害,使细胞能够正常地生存下去[22-23]。我们对菌株LNa 培养过程对硫酸铵、酸及抗生素等胁迫因子响应的研究发现,菌株的抗性与蛋白酶、水解酶等代谢酶的活性变化有关,但其分解利用高浓度硫酸铵的机制还需进一步的深入研究。
4 小结
本研究发现了一株硫酸铵耐受菌株Brevundimonassp. LNa,该菌株在高浓度的硫酸铵下能正常生长,表现出极强的抗性,并对硫酸盐和氨氮都有较强的分解或转化能力。菌株的发现可望给自然状态下难以修复的被NH4+和SO42-离子污染的稀土矿区土壤和水体的治理开辟了新思路。

