HS-GC法测定依鲁替尼原料药中6种残留溶剂
*何文胜,程伟青,陈 忠
(1.福建生物工程职业技术学院,福建,福州350007;2.福建省微生物研究所,福建,福州350007)
依鲁替尼(Ibrutinib,也称伊布替尼)是一种罕见侵袭性血癌——套细胞淋巴瘤(MCL)[1-4]的治疗药,美国FDA 授予其突破性治疗药物资格,是突破性药物+优先审评+加速批准+孤儿药,于2013年11月13日由FDA 加速批准上市(Pharmacyclics公司和Johnson &Johnson 公司)。2015年1 月,其新的适应症被扩大至非霍奇金淋巴瘤——巨球蛋白血症(WM)的治疗,成为首个治疗该疾病的药物,2017年8月该专利药在我国正式获批上市(亿珂),价格昂贵约3万元人民币/月。目前,孟加拉生产的依鲁替尼是全球唯一获得政府监管机构批准合法生产的仿制药。由于专利保护,我国还不能合法生产该药,但鉴于该药对治疗MCL的优异表现,我国学者对依鲁替尼的合成研究表现出极大的关注[5-6]。由于合成路径不同,各自所用的有机溶剂也不同。本课题组在依鲁替尼合成过程[7]中用到的有机溶剂主要有异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、甲苯、DMF 等。
为保证用药安全,《中国药典》和《药品注册的国际技术要求》对各有机溶剂的限量均有规定。药品残留溶剂的检测方法有多种[8-9],如干燥失重测定法快速简便,但一般只能测定溶剂残留的总量,专属性较差;分光光度法通过不同溶剂的特征吸收峰值强度的差异来检测药物中残留溶剂,灵敏度较低。易挥发物质一般采用气相色谱法[10-11],而顶空气相色谱法(HS-GC)是许多国家药典检测药品有机残留溶剂的首选方法[12],该技术前处理步骤简单,将固态或液态样品中的挥发性组分加热挥发后,直接导入气相色谱仪进行分离和检测,且顶空进样体积大于直接手动进样体积,灵敏度得到了大幅的提高。鉴于此,本研究中参考了相关文献,建立了HS-GC测定本课题组合成依鲁替尼原料药中残留溶剂量的方法,快速、简便,结果准确可靠,以期为依鲁替尼原料药的质量控制及监测提供质控基础。同时,也为其他药品合成中使用异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、甲苯、DMF 作为溶剂的药品,进行有机残留溶剂检测提供参考借鉴。
1 仪器与试剂
Agilent7820A 气相色谱仪,配FID检测器、Agilent7697A 顶空自动进样器;载气为高纯氮(99.999%),Agilent GC ChemStation 色谱工作站;电子天平(METTLER AE240,十万分之一)。Milli-Q超纯水仪。
依鲁替尼原料药为药化研究室自制(批号:EBR031116,EBR031118,EBR031120)。二氯甲烷、乙酸乙酯、四氢呋喃、甲苯、N、N-二甲基乙酰胺(DMA)、DMF、异丙醇均为色谱纯(纯度>99.8%)。
2 方法与结果
2.1 色谱条件
色谱柱:DB-624(30m×530μm×3μm,美国Agilent 公司);升温程序:初始温度40 ℃(3 min),升温至70 ℃(10 /min℃ ),70 ℃(2 min),升温至200 ℃(20 /min℃ ),200 ℃(5 min);检测器:FID(300℃);载气:氮气;柱流速5 mL/min;进样口温度250 ℃;分流方式进样;分流比:8:1;顶空平衡温度:110 ℃,平衡时间:30 min;进样量:1 mL。
2.2 溶液的制备
对照储备液的制备:分别精密称取5000 mg 异丙醇、600 mg 二氯甲烷、5000 mg 乙酸乙酯、720 mg四氢呋喃、890 mg 甲苯、880mgDMF,置于同一100 mL 容量瓶中,DMA 定容至刻度,即得(4 ℃保存)。
系列对照品溶液的制备:分别精密移取对照储备液适量,稀释,即得。
供试品溶液的制备:称取依鲁替尼原料药样品约0.5 g,精密称定,置于顶空瓶(20 mL)中,加入DMA 5 mL 溶解,密封,即得。
2.3 系统适用性试验
取“2.2”项下方法配制对照品溶液、溶剂空白液,按“2.1”项下方法测定,记录色谱图(图1)。空白溶剂不干扰各残留溶剂的检测,且各残留溶剂的分离度>1.5,满足检测要求。

图1 专属性试验气相色谱图Fig.1 GC chromatograms
2.4 线性范围、定量限、检测限
取“2.2”项下的系列对照品溶液,按“2.1”项下方法测定。以溶剂的质量浓度(X, μg/mL)为横坐标,对应的峰面积(Y)为纵坐标进行线性回归。6种溶剂的线性相关系数(r)均大于0.998。各溶剂的检测限(S/N=3)、定量限(S/N=10)结果见表1。
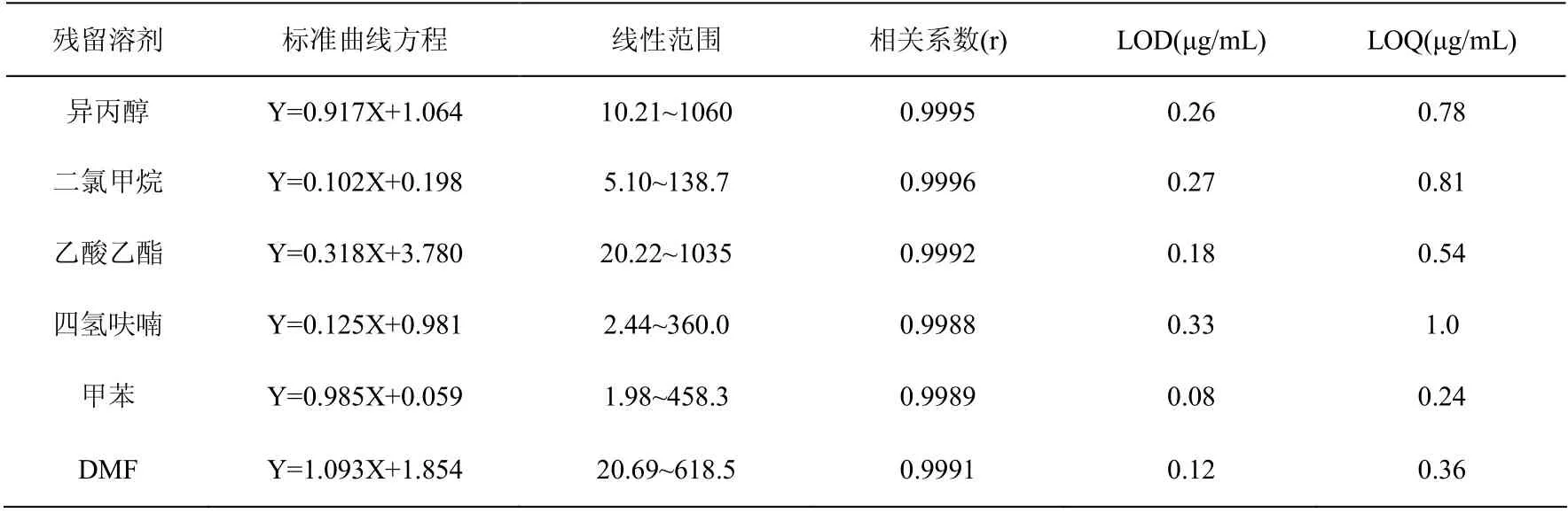
表1 6种残留溶剂的线性范围、相关系数、检测限和定量限Table 1 Equations of linear range,correlation coefficients,LOD and LOQ of 6 residual solvents
2.5 精密度
精密量取“2.2”项下对照品混合溶液5 mL,按“2.1”项下方法测定,平行6 份,计算RSD。各有机残留溶剂异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、甲苯和DMF的峰面积的RSD分别为2.2%,1.8%,1.9%,1.8%,2.0%,2.1%,表明仪器精密度良好。
2.6 重复性
精密称取样品(批号:EBR031116)0.5 g,平行制备供试品溶液6份,按“2.1”项下方法测定,计算RSD。异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、甲苯和DMF的RSD分别为2.3%,1.7%,1.9%,1.9%,2.1%,2.0%,表明本法重复性良好。
2.7 加标回收率试验
《中国药典》中异丙醇、二氯甲烷、乙酸乙酯、四氢呋喃、甲苯和DMF 6种有机残留溶剂的限值分别为0.5%、0.06%、0.5%、0.072%、0.089%、0.088%。在样品(批号:EBR031116)中按各有机残留溶剂限值的80%,100%,120%进行加标试验,计算加样回收率。结果见表2。

表2 回收率试验结果(n=3)Table 2 Results of the recovery tests
2.8 样品的含量测定
取3批样品(批号:EBR031116,EBR031118,EBR031120)样品按“2.2”线下方法制备供试品溶液,再按“2.1”顶空气相色谱条件进样测试,外标法计算各有机溶剂的残留量。结果显示:3批样品均未检出各有机残留溶剂。
3 讨论
3.1 原料药中残留溶剂考察的意义
化学原料药的合成过程中不可避免会使用各种有机溶剂溶解各种反应原料,有时选择合适的溶剂还可在产品精制过程提高产量、决定药物的纯度、晶型。然而,有机溶剂残留在药物中,如果超出安全阈值时,就会对人体产生危害。
本课题组涉及的有机溶剂二氯甲烷、四氢呋喃、甲苯和DMF均为中国药典(四部0861)规定应限制使用的二类溶剂,限量规定分别为0.06%、0.072%、0.089%和0.088%,异丙醇和乙酸乙酯为中国药典(四部0861)规定的药品GMP或其他质量要求限制使用的三类溶剂,限量规定分别为0.5%,因此应该对这六类溶剂进行残留量检测。
按本方法进行的试验结果表明,本课题组在合成工艺过程中所用的有机溶剂均未检出,满足《中国药典》对有机残留量的规定。作为该新药研究质量控制的一个关键环节,为药品将来的生产上市提供有效技术支持。
3.2 色谱柱的选择
本次测定的6种有机溶剂极性相差较大,根据相似相容的原理,选择非极性色谱柱(DB-1、SE-54)或极性色谱柱(FFAP)均不能使极性待测物或弱极性待测物得到有效分离。选择中等极性的色谱柱(如DB-624),可最大地兼容各种极性的待测溶剂,使检测的理论塔板数(n)、拖尾因子(T)和分离度(R)最优化。因此在检测有机溶剂极性跨度大时,选择中等极性的色谱柱为宜。
3.3 顶空平衡温度和平衡时间的选择
顶空进样一般将样品置于密闭容器(顶空瓶),在受控的温度下加热,至挥发性物质在气液两相中的浓度达到平衡,因此顶空色谱分析的灵敏度和准确度取决于平衡温度和平衡时间。平衡温度太低则导致平衡时间长,而且溶剂回收率低;平衡温度高则会缩短顶空进样设备的使用寿命,并可能导致溶剂发生部分分解。为于兼顾效率和灵敏度,一般选择被测有机溶剂沸点偏高的温度作为平衡温度,如本实验6种有机溶剂,沸点约在40~153 ℃之间,我们选择了110 ℃作为平衡温度;而平衡时间则选择所有溶剂峰面积增加趋于平缓时即可。

