独活寄生汤对内质网应激下软骨细胞钙稳态和凋亡的影响
林 晴,王文义,潘丹虹,黄艳峰,付长龙,叶锦霞*
1 福建中医药大学中西医结合研究院,福建 福州350122;2 福建省中西医结合老年性疾病重点实验室,福建 福州350122
* 通信作者:叶锦霞,E-mail:xiaoyezi1203@126.com
骨关节炎(osteoarthritis,OA)是一种严重影响患者生活质量的慢性、退行性关节疾病。 随着我国人口老龄化趋势加重,该病发病率显著增高,预计到2020 年将成为第4 大致残性疾病[1]。其发病的中心环节是关节软骨退变和继发性骨质增生,主要表现为关节疼痛、肿胀晨僵、活动不利、甚者关节畸形等[2-3]。现代研究发现骨关节炎的发病与内质网应激(endoplasmic reticulum stress,ERS)介导的软骨细胞凋亡有着密切关系[4]。内质网是Ca2+主要储存场所,Ca2+作为细胞凋亡信号之一,当细胞受到外源性化合物影响时,内质网内的Ca2+稳态破坏,代谢紊乱,继而激发ERS 出现细胞凋亡[5]。 毒胡萝卜素(Thapsigargin,TG)是Ca2+-ATP 酶抑制剂,可使未折叠或异常折叠的蛋白在软骨细胞内蓄积或使内质网内Ca2+稳定失衡,常被用来制作软骨细胞ERS 模型[6]。前期临床试验及动物实验研究表明,独活寄生汤通过缓解关节软骨退变对膝骨关节炎有良好疗效[7-9]。目前对于骨关节炎的治疗手段颇多,主要以减轻症状,延缓病程进展为主要目的,但仍缺乏特效疗法[10]。本研究通过观察独活寄生汤在ERS 下对Ca2+平衡及软骨细胞凋亡的影响,以期探讨其防治骨关节炎的作用机制。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠20 只,雄性,4 周龄,体质量90~100 g,由上海斯莱克实验动物有限责任公司提供,动物合格证号:SCXK(沪)2017-0005。 本实验的开展已获得福建中医药大学伦理委员会审批(批准文号:〔2019〕福中医伦理审字第007 号)。
1.2 实验药物
独活寄生汤购自福建省第三人民医院,全方由独活9 g,桑寄生、杜仲、牛膝、细辛、秦艽、茯苓、肉桂、防风、川芎、人参、甘草、当归、芍药、干地黄各6 g 组成。 采用70%乙醇回流提取的方法制备,合并滤液,浓缩、干燥。 将独活寄生汤提取物用含10%胎牛血清的培养基配制成64 mg/mL 溶液,置于-20 ℃冰箱储存备用。 使用前用含10%胎牛血清的培养基配成所需浓度,并用0.22 μm 的无菌型微孔滤膜过滤。
1.3 主要实验试剂和设备
见表1。

表1 主要试剂及设备Table 1 Main reagents and instruments
1.4 实验方法
1.4.1 软骨细胞体外培养体系的建立及鉴定 用1%戊巴比妥将2 只SD 大鼠麻醉后脱颈处死,用75%酒精浸泡5 min,用骨剪截取膝关节,用75%酒精浸泡10 min 后带入超净工作台操作:先用磷酸盐缓冲液(phosphate buffered saline,PBS)充分漂洗,刮除关节周围附着的组织如肌肉、骨膜、滑膜。 用手术刀片削取每个关节表面的软骨,以不渗血为度。 PBS充分漂洗软骨小块3 次。 用手术刀片切碎至1 mm大小,PBS 冲洗2 次后,置入含8 mL 0.2%Ⅱ型胶原酶的玻璃瓶中,置于37 ℃,100 r/min 水浴摇床消化,每2 h 吸取1 次上清液,120 目尼龙网筛过滤,所得滤液1 000 r/min,离心5 min,弃上清液,收集细胞沉淀,重复3 次。 用含10%胎牛血清的细胞培养基(Dulbecco's modified eagle media,DMEM)重悬细胞,吹打混匀后接种至培养瓶中培养。 37 ℃、5%CO2培养箱原代培养,48 h 后倒置显微镜下观察细胞贴壁情况,以后2~3 d 更换培养液1 次,直到长成细胞单层,选第2 代软骨细胞,0.25%胰蛋白酶消化备用。 第3 代软骨细胞采用甲苯胺蓝染色法鉴定并进行后续实验。
1.4.2 CCK-8 法检测软骨细胞的存活率 第2 代软骨细胞以1.0×105个/mL 的密度接种于96 孔板,每孔100 μL,24 h 后观察细胞生长,至50%~60%时,将细胞分为空白组,模型组,独活寄生汤低、中、高剂量组,每组设置5 个复孔。
1.4.2.1 空白组 孔中加入含10%胎牛血清培养基100 μL。
1.4.2.2 模型组 孔中加入剂量为25 μmol/L TG(DMEM 完全培养基配制)100 μL 作用4 h[11]。
1.4.2.3 独活寄生汤低、中、高剂量组 孔中加入剂量为25 μmol/L TG 的含血清培养基100 μL 作用4 h后,吸弃培养基换成100、200、400 μg/mL 不同浓度的独活寄生汤(DMEM 完全培养基配制)。 作用24 h后,每孔直接加入CCK-8 溶液10 μL,37 ℃、5%CO2,孵育4 h,终止培养,在450 nm 波长的酶联免疫检测仪上测定各孔光吸收值[12-13]。
1.4.3 Hoechst 33342 检测软骨细胞凋亡情况 各组干预后,弃除培养基,用PBS 洗1 次,加入4%多聚甲醛,固定15 min。 弃除固定液,用PBS 洗3 次,每次摇晃3 min,加入10 μg/mL Hoechst 33342 染色液1 mL,染色30 min,期间摇晃几次使其染色充分均匀,去染色液,用PBS 洗3 次,每次摇晃3 min,最后加入200 μL PBS,用共聚焦显微镜观察软骨细胞的凋亡情况。
1.4.4 双转盘激光共聚焦显微镜观察细胞内Ca2+浓度实时动态变化 采用Ca2+敏感荧光探针Fluo-3/AM 进行细胞内Ca2+荧光标记,配制终浓度为50 μmol/L Fluo-3/AM 和10 μg/mL Hoechst 33342混合液(DMEM 培养基配制),加于培养的软骨细胞样品上,置于5% CO2孵箱中孵育30 min。PBS 液漂洗1 次,双转盘激光共聚焦显微镜进行观察,选择适当的参数对细胞进行动态扫描(Fluo-3/AM:激发波长488 nm,发射波长526 nm;Hoechst 33342:激发波长350 nm,发射波长460 nm),每组选取5 个细胞,采用系统自带软件,根据荧光强度变化-时间的曲线图,得出反映细胞内游离Ca2+浓度动态变化的曲线。
1.5 统计学方法
应用SPSS 22.0 统计软件,计量资料以(±s)表示,数据服从正态分布使用单因素方差分析,若方差齐则使用LSD-t检验,若方差不齐则采用Gams-Howell 检验;数据不服从正态分布,采用Kruskal-WallisH检验。P<0.05 为差异具有统计学意义。
2 结 果
2.1 软骨细胞的形态结构及鉴定
2.1.1 甲苯胺蓝染色鉴定 接种后,细胞呈圆形,漂浮于培养液中,24 h 后,大多数软骨细胞开始贴壁,伸展并形成伪足样突起。 培养第7 天,软骨细胞增殖逐渐融合成单层,呈不规则“铺路石”样。 第2 代、第3 代软骨细胞形态规则、大小一致,边界清晰。 第4 代开始软骨细胞逐渐呈长梭形,分化为成纤维细胞。 选取第3 代软骨细胞进行甲苯胺蓝染色,可见细胞内蓝紫色异染颗粒,细胞周围可见异染颗粒。见图1。

图1 甲苯胺蓝染色鉴定(×200)Figure 1 Identification using toluidine blue staining (×200)
2.1.2 软骨细胞形态变化 倒置显微镜下观察各
组软骨细胞的形态,空白组呈单层铺路石状生长;
模型组和独活寄生汤各剂量组细胞形态由铺路石
状呈现多角形增加,伪足变长,细胞呈皱缩状态、细胞间隙变大、数量变少,悬浮死细胞增多。 独活寄生汤各剂量组与模型组比较,细胞数量明显增多,细胞胞质均匀。 见图2。

图2 第3 代软骨细胞形态(×100)Figure 2 Morphological observation of the third chondrocytes (×100)
2.2 CCK-8 法检测独活寄生汤对软骨细胞存活率的影响
与空白组相比,模型组的存活率较低,差异具有统计学意义(P<0.05),而独活寄生汤各剂量组的存活率均比模型组高,差异具有统计学意义(P<0.05),其对软骨细胞的保护作用随剂量的升高而增高,具有一定的量效关系(P<0.05)。 见表2。
2.3 Hoechst 33342 检测软骨细胞凋亡情况
共聚焦显微镜下观察,空白组细胞核出现弥散均匀的低密度亮蓝色荧光,凋亡细胞较少。 模型组的凋亡细胞数量显著增多,其细胞核固缩、呈颗粒状荧光,部分呈半月形增加。 独活寄生汤各剂量组的细胞凋亡数比模型组明显减少,只有少量凋亡细胞呈高密度的亮蓝色或半月形,且独活寄生汤各组的细胞凋亡数量伴随剂量增高而减少,呈现一定量效关系(P<0.05)。 见图3、图4。
表2 5 组软骨细胞活性比较(±s)Table 2 Comparison of the activity of chondrocytes in five groups (±s)

表2 5 组软骨细胞活性比较(±s)Table 2 Comparison of the activity of chondrocytes in five groups (±s)
注:与模型组比较,1) P<0.05。Note: Compared with the model group, 1) P<0.05.
细胞活性(吸光值)3.68±0.051)1.91±0.13 2.50±0.061)2.64±0.081)2.76±0.101)组别空白组模型组独活寄生汤低剂量组独活寄生汤中剂量组独活寄生汤高剂量组n 5 5 5 5 5剂量/(μmol/L)—25 100 200 400

图3 Hoechst 33342 检测软骨细胞凋亡情况(×400)Figure 3 Detection of chondrocyte apoptosis by Hoechst 33342 staining (×400)
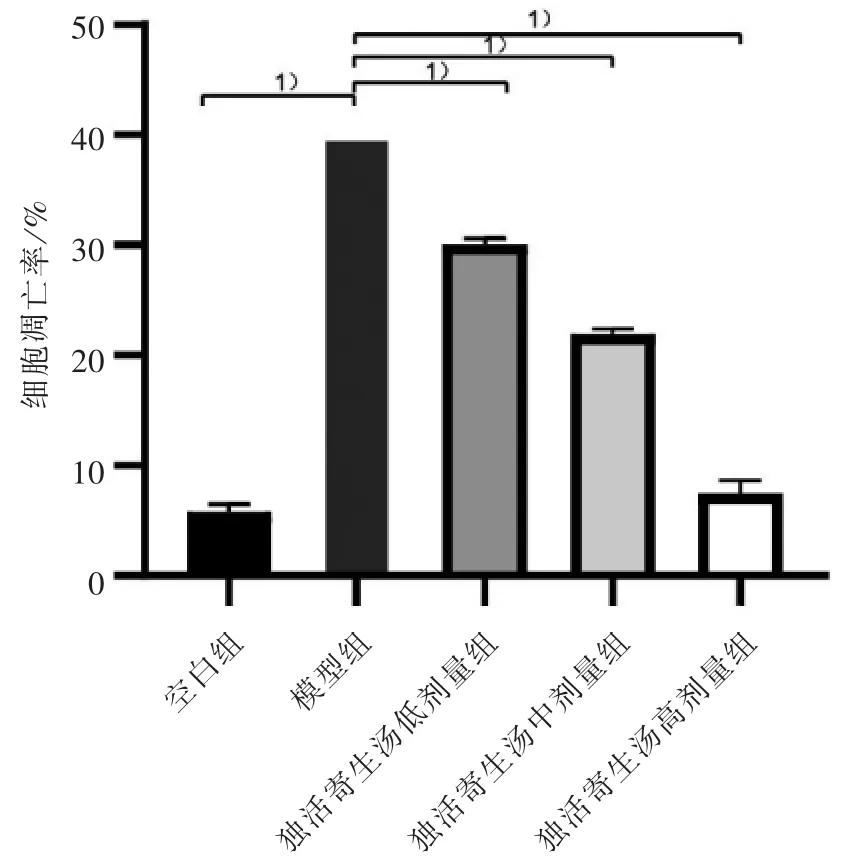
图4 5 组软骨细胞凋亡率Figure 4 The apoptosis rate of chondrocytes in five groups
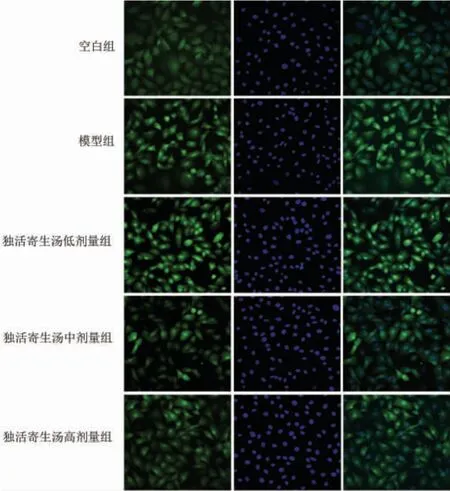
图5 双转盘激光共聚焦显微镜观察细胞内Ca2+荧光强度(×400)Figure 5 Observation of Ca2+ fluorescence intensity in cells by double rotary laser confocal microscope (×400)
2.4 双转盘激光共聚焦显微镜观察细胞内Ca2+浓度实时动态变化
空白组Ca2+荧光强度较弱且均一,观察30 min后,仍处于稳定的状态。 与空白组比较,模型组中Ca2+释放明显增多,荧光强度显著增强,荧光波谱显示Ca2+火花较频繁,差异具有统计学意义(P<0.05)。与模型组比较,独活寄生汤中、高剂量组(200、400 μg/mL)软骨细胞Ca2+火花明显减少,且能较快恢复到Ca2+稳态,独活寄生汤低剂量组(100 μg/mL)虽然仍有部分Ca2+火花,但荧光强度明显比模型组弱,荧光强度-时间的动态变化曲线趋于平缓。 见图5、图6。

图6 5 组Ca2+浓度动态变化Figure 6 Dynamic changes of Ca2+concentration in five groups
3 讨 论
3.1 TG 可建立稳定的软骨细胞ERS 模型
本研究采用机械-0.2%Ⅱ型胶原酶消化法获取大量软骨细胞, 甲苯胺蓝染色可见细胞内蓝紫色异染颗粒, 证实本研究建立了稳定的软骨细胞体外培养体系[11]。 课题组前期研究发现,在OA 患者的软骨细胞中存在ERS, 且内质网过载会诱导软骨细胞的凋亡,导致软骨细胞外基质合成和降解代谢失衡,从而加速OA 的病理进程[12]。
本实验运用Ca2+-ATP 酶抑制剂TG 建立软骨细胞ERS 模型[13]。ERS 可通过激活未折叠蛋白反应触发细胞凋亡[14-15]。 实验结果表明,25 μmol/L TG作用于软骨细胞4 h,显微镜下可观察到软骨细胞变形、间隙变大、数量变少,CCK-8 检测结果显示软骨细胞存活率显著降低,Hoechst 33342 染色可见明显的细胞核固缩、碎裂,或呈月牙状等细胞凋亡现象,故25 μmol/L TG 干预第3 代软骨细胞4 h 即可建立合适而稳定的软骨细胞ERS 模型。 TAKADA 等[16]研究结果亦证实了ERS 相关蛋白与OA 软骨细胞变性及凋亡均呈正相关。
3.2 独活寄生汤可维持软骨细胞内Ca2+平衡
过度的ERS 会刺激Ca2+通道活化,Ca2+作为凋亡过程中重要的信号,可通过调节Ca2+敏感的关键酶诱导细胞凋亡[17-19]。研究表明,独活寄生汤含药血清可抑制因ERS 反应引起的软骨细胞凋亡[20],但尚未深入探索其是否通过维持细胞内Ca2+平衡而发挥作用。 本研究采用双转盘激光共聚焦显微镜实时观察发现,模型组细胞内Ca2+释放增多、火花出现频繁、荧光强度显著增强,与空白组相比差异具有统计学意义,可见在TG 诱导的软骨细胞ERS 模型中存在Ca2+稳态失衡现象。 谢文斌[21]在进行人膝关节OA 原位软骨细胞自发性Ca2+信号特征分析时亦证实了人膝关节原位软骨深层细胞自发性Ca2+信号与软骨退变程度呈负相关。 当加入独活寄生汤中、高剂量进行干预时,细胞内Ca2+火花释放减少,荧光强度减弱,荧光强度-时间的动态变化曲线趋于平缓,能很快地恢复到钙平衡状态。Hoechst 33342染色可见独活寄生汤干预时软骨细胞凋亡数量减少,CCK-8 检测亦提示独活寄生汤组细胞存活率较模型组高。 这提示,独活寄生汤可维持软骨细胞内钙平衡,减轻ERS 反应和软骨细胞凋亡。
4 小 结
在OA 的病理过程中,Ca2+介导的软骨细胞凋亡在骨性关节炎发病中起重要作用。 由于关节软骨中Ca2+稳态失衡,ERS 持续激活,进而引起软骨细胞凋亡,导致软骨合成和降解代谢失衡,最终造成软骨细胞外基质和关节软骨破坏。 本研究证实,独活寄生汤可通过维持关节软骨内钙平衡,减轻ERS,减少软骨细胞凋亡,从而对关节软骨产生保护作用,但是目前独活寄生汤如何通过调控相关蛋白表达以及信号通路维持钙稳态尚未完全阐明,未来可基于以上研究进一步深入探讨独活寄生汤的作用机制,为OA 的早期预防及治疗提供新思路。

