电针预处理对兔脊髓缺血再灌注损伤后炎性因子的影响
姚梦莉,陈向华,陈朝晖*,王 海
1 安徽中医药大学研究生院,安徽 合肥230038;2 安徽中医药大学针灸推拿学院,安徽 合肥230038;3 徐州市中医院,江苏 徐州221000
* 通信作者:陈朝晖,E-mail:czhn007@163.com
脊髓缺血再灌注损伤(spinal cord ischemic reperfusion injury,SCII)是脊髓组织经历一段时间缺血再次恢复血供后,脊髓组织功能结构损伤加重,甚至脊髓神经元发生不可逆性损伤[1]。 它是一种严重的继发性损伤,是临床上造成主动脉瘤、脊柱骨折、骶管肿瘤等手术术后截瘫的最主要原因,其发生率可达10%~40%,对患者的身心健康造成严重危害。SCII 与脊髓组织的原发性损伤不同,其属于二次损伤,具有可预见性,因此早预防、早治疗十分必要。已有研究证实,炎症反应是影响SCII 病理进程的重要因素[2],因此抑制炎症反应是治疗SCII 的可行策略之一。 目前电针广泛应用于脊髓损伤的临床治疗,疗效显著,对于其在SCII 的应用多集中于基础研究[2-3]。有研究表明,电针具有减轻炎症反应、缓解疼痛,改善脊髓水肿、保护神经元等功效[4]。功能性磁共振成像(functional magnetic resonance imaging,fMRI)和弥散张量纤维束成像(diffusion tensor imaging,DTI)则显示[5-6],电针可激活脊柱功能区,调整脊柱纤维束形态,恢复脊柱功能结构。 本研究通过电针预处理SCII 模型兔,观察不同时点白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等致炎因子和白细胞介素-1 受体拮抗剂(IL-1Rα)抗炎因子的变化,进一步明确电针预处理SCII 的免疫机制,为临床治疗SCII 提供依据。
1 实验材料与方法
1.1 实验动物
安徽中医药大学实验动物中心提供成年健康SPF 级新西兰大白兔24 只,雌雄各半,单笼饲养,自由饮水摄食,体质量2.0~2.5 kg。 实验遵循《实验动物管理与使用指南》[7],并通过安徽中医药大学医学伦理委员会批准(批号:AHUCM-rabbits-2019010)。
1.2 主要实验试剂与设备
乌拉坦(武汉久安药业有限公司);30%过氧化氢(武汉久安药业有限公司);DAB 染色剂和IL-1β+bs-0812R(均购自上海苏懿化学试剂有限公司);兔IL-1β 试剂盒、兔IL-6 试剂盒、兔TNF-α 试剂盒、兔IL-1Rα 试剂盒(均购自上海三发科学仪器有限公司);光学显微镜(日本奥林巴斯公司,Nikon牌);毫针(合肥有为康设备有限公司,华佗牌1.5 寸);酶标仪(深圳雷杜生命科学股份有限公司,RT-6000);电针仪(合肥有为康设备有限公司,SDZ-II型)。
1.3 分组及模型制备
1.3.1 实验分组 将24 只新西兰大白兔按照随机数字表法分为模型组、假手术组、电针组,每组8 只。
1.3.2 模型制备 采用Zivin 法[8]进行造模。 术前禁食12 h。 20%的乌拉坦(6 mL/kg)耳缘静脉注射麻醉,兔仰卧位固定,手术范围内备皮,常规消毒,气管插管,保持呼吸道。 距兔剑突下约1 寸处行腹部正中切口,切口长度约3~4 cm,清洁纱布包裹大网膜和胃肠管,推开并暴露腹主动脉,钝性分离约0.5 cm,以肾上腺为标志,靠近右肾动脉的近心端起始部夹闭腹主动脉,当触及腹主动脉远端波动感消失开始计时,用血管钳把切口进行临时夹闭,30 min后取出动脉夹,确定腹主动脉远端搏动恢复后,无菌纱布清除腹腔渗出液,复位胃肠等器官,逐层缝合,关闭腹腔。 假手术组不夹闭腹主动脉,其余步骤相同。 保持室内温度22 ℃,注意动物保暖直至清醒,术后予以青霉素抗感染治疗4 d,正常饮水摄食。
1.4 实验动物处理
1.4.1 模型组 造模成功后,连续4 d 给予青霉素20 万U/d 肌肉注射,饲料喂养,正常饮水、自由活动。
1.4.2 假手术组 模型制备及实验动物处理同模型组,但不夹闭腹主动脉。
1.4.3 电针组 兔脊髓缺血再灌注模型诱导前30 min进行电针干预治疗,采用SDZ-II 型电针仪,参照《实验针灸学》[9]的操作方法,针刺双侧“悬钟”和“阳陵泉”2 个穴位。电针参数:疏密波,10 Hz,电针强度要让肢体保持轻微颤动,治疗时间为30 min[10]。
1.5 观察指标及方法
1.5.1 IL-1β、IL-6、TNF-α 和IL-1Rα 检测 分别于造模前0 h 及缺血再灌注后4、8、12 h 这4 个时间点采集兔股静脉血2 mL 于试管中,静置30 min后以3 000 r/min 的速度将血液离心20 min,然后移液器取上清液,置于-20 ℃冰箱中保存待测。采用ELISA 法检测血清 中IL-1β、IL-6、TNF-α 和IL-1Rα 的表达,检测严格按照ELISA试剂盒说明书进行操作。
1.5.2 脊髓组织变化观察 取血完成后采用耳缘静脉空气栓塞法处死兔,确定L2~5的位置,使用咬骨钳咬断棘突和椎板,手术刀清理脊柱周围软组织,手术剪剪断附着的脊神经根,取出L2~5段的脊髓组织后,用生理盐水冲洗干净,固定于10%的福尔马林溶液中,再经过脱钙、脱水、透明、石蜡包埋等步骤将标本制作成蜡块,切片,厚度约为5 mm,行苏木精-伊红染色(HE 染色),光学显微镜下观察脊髓组织变化并采集照片。
1.5.3 IL-1β、IL-6、TNF-α 定位及表达检测 取上述蜡块,切片、脱蜡,3% H2O2水孵育5 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗干净,滴加一抗后PBS 冲洗,接着滴加二抗室温孵育10 min,PBS 再次冲洗,然后使用DAB 溶液让脊髓组织显色,经过冲洗、复染、脱水、封片步骤,最后在光学显微镜下观察并采集照片。 兔脊髓组织中IL-1β 的表达以间质及胞浆被染成棕褐色为阳性表达,IL-6、TNF-α 的阳性表达则为神经元胞浆及突起中被染成棕褐色。
1.6 统计学方法
利用SPSS 23.0 统计软件进行统计分析。 计量资料服从正态分布采用(±s)表示,各组兔血清中多时点炎症因子含量符合正态分布,采用重复测量方差分析,两两比较采用LSD-t法;各组兔脊髓组织中蛋白平均灰度值满足独立、正态、方差齐性,组间比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 3 组兔脊髓组织形态学变化
研究结果显示,假手术组兔脊髓组织中神经元轮廓清晰,胞体较大且圆润,胞浆染色均匀,胞核及核仁完整清楚,树突、轴突完整存在,整个组织的结构较为清楚、完整。 模型组兔脊髓组织中神经元数目减少,细胞胞核及胞浆染色变浅,胞核固缩或消失,核膜的边界不清晰,或者核破碎、或者核溶解甚至出现核仁消失,轴突出现扩大或肿胀或消失等病理改变,神经细胞的周围存有透亮区,甚至坏死后留下空腔。 与模型组比较,电针组神经元的数目增加,变形、坏死减少,其结构也更为清晰,细胞胞核及胞浆染色变深,胞核及核仁轻度肿胀,萎缩减轻,神经元的存活密度增加,整体破坏程度减轻。 见图1。
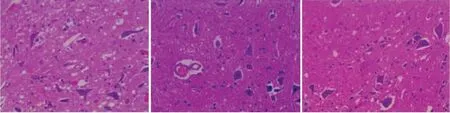
图1 3 组兔脊髓组织病理显微结构(HE 染色×400)Figure 1 Pathological microstructure of spinal cord tissue in three groups of rabbits (HE staining×400)
2.2 3 组兔炎症因子表达变化
2.2.1 3 组IL-1β 含量比较 见表1。
2.2.2 3 组IL-6 含量比较 见表2。
2.2.3 3 组TNF-α 含量比较 见表3。
表1 3 组兔脊髓缺血再灌注损伤IL-1β 水平比较(±s) 匹克/毫升Table 1 Comparison of IL-1β level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL

表1 3 组兔脊髓缺血再灌注损伤IL-1β 水平比较(±s) 匹克/毫升Table 1 Comparison of IL-1β level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL
注:与模型组缺血前比较,1) P<0.05;与假手术组同一时间点比较,2) P<0.05;与模型组同一时间点比较,3) P<0.05。Note: Compared with the model group before ischemia, 1) P<0.05; Compared with the sham operation group at the same time,2) P<0.05; Compared with the model group at the same time, 3) P<0.05.
组别假手术组模型组电针组n 8 8 8缺血前24.38±1.49 24.42±2.20 24.16±1.59再灌注后4 h 23.86±1.09 42.90±1.971)2)28.36±1.002)3)8 h 25.10±1.05 66.24±1.761)2)37.97±1.352)3)12 h 24.83±1.38 67.53±2.071)2)41.03±1.592)3)
2.2.4 3 组IL-1Rα 含量比较 见表4。
2.3 3 组兔促炎因子定位及表达变化
假手术组无特殊阳性表达,着色均匀。 模型组胞核着色不均或不着色,IL-1β 大量表达在细胞间质及胞浆中,IL-6 和TNF-α 则大量表达在神经元胞浆及突起中。 电针组间质及胞浆中IL-1β、IL-6、TNF-α 的表达明显减少,见图2、图3、图4。 与假手术组同一时间点比较,模型组与电针组IL-1β、IL-6、TNF-α 的含量表达均明显上升,模型组含量最高,电针组次之;与模型组同一时间点比较,电针组IL-1β、IL-6、TNF-α 的含量表达明显下降,差异具有统计学意义(P<0.05)。 见表5。
表2 3 组兔脊髓缺血再灌注损伤IL-6 水平比较(±s) 匹克/毫升Table 2 Comparison of IL-6 level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL
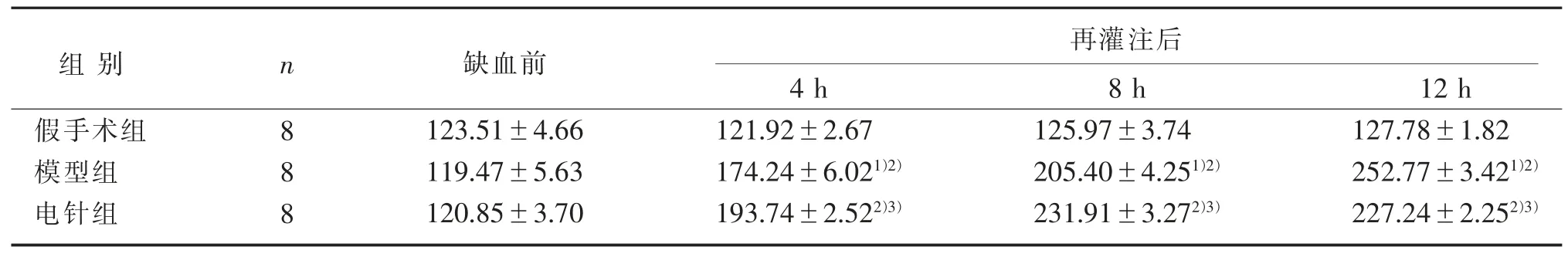
表2 3 组兔脊髓缺血再灌注损伤IL-6 水平比较(±s) 匹克/毫升Table 2 Comparison of IL-6 level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL
注:与模型组缺血前比较,1) P<0.05;与假手术组同一时间点比较,2) P<0.05;与模型组同一时间点比较,3) P<0.05。Note: Compared with the model group before ischemia, 1) P<0.05; Compared with the sham operation group at the same time,2) P<0.05; Compared with the model group at the same time, 3) P<0.05.
组别假手术组模型组电针组n 8 8 8缺血前123.51±4.66 119.47±5.63 120.85±3.70再灌注后4 h 121.92±2.67 174.24±6.021)2)193.74±2.522)3)8 h 125.97±3.74 205.40±4.251)2)231.91±3.272)3)12 h 127.78±1.82 252.77±3.421)2)227.24±2.252)3)
表3 3 组兔脊髓缺血再灌注损伤TNF-α 水平比较(±s) 匹克/毫升Table 3 Comparison of TNF-α level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL

表3 3 组兔脊髓缺血再灌注损伤TNF-α 水平比较(±s) 匹克/毫升Table 3 Comparison of TNF-α level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL
注:与模型组缺血前比较,1) P<0.05;与假手术组同一时间点比较,2) P<0.05;与模型组同一时间点比较,3) P<0.05。Note: Compared with the model group before ischemia, 1) P<0.05; Compared with the sham operation group at the same time,2) P<0.05; Compared with the model group at the same time, 3) P<0.05.
组别假手术组模型组电针组n 8 8 8缺血前173.28±3.40 170.90±6.67 172.24±5.04再灌注后4 h 176.31±4.37 438.14±5.121)2)376.95±4.572)3)8 h 174.43±3.92 479.51±4.281)2)416.88±2.832)3)12 h 176.54±4.93 447.66±8.501)2)380.78±8.862)3)
表4 3 组兔脊髓缺血再灌注损伤IL-1Rα 水平比较(±s) 匹克/毫升Table 4 Comparison of IL-1Rα level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL

表4 3 组兔脊髓缺血再灌注损伤IL-1Rα 水平比较(±s) 匹克/毫升Table 4 Comparison of IL-1Rα level in spinal cord ischemia-reperfusion injury of rabbits in three groups (±s)pg/mL
注:与模型组缺血前比较,1) P<0.05;与假手术组同一时间点比较,2) P<0.05;与模型组同一时间点比较,3) P<0.05。Note: Compared with the model group before ischemia, 1) P<0.05; Compared with the sham operation group at the same time,2) P<0.05; Compared with the model group at the same time, 3) P<0.05.
组别假手术组模型组电针组n 8 8 8缺血前97.20±2.68 98.00±3.19 97.37±4.96再灌注后4 h 99.47±3.15 131.07±2.981)2)148.46±8.152)3)8 h 98.86±2.96 136.24±4.311)2)133.75±7.832)12 h 96.15±2.17 101.13±2.87 108.05±3.222)
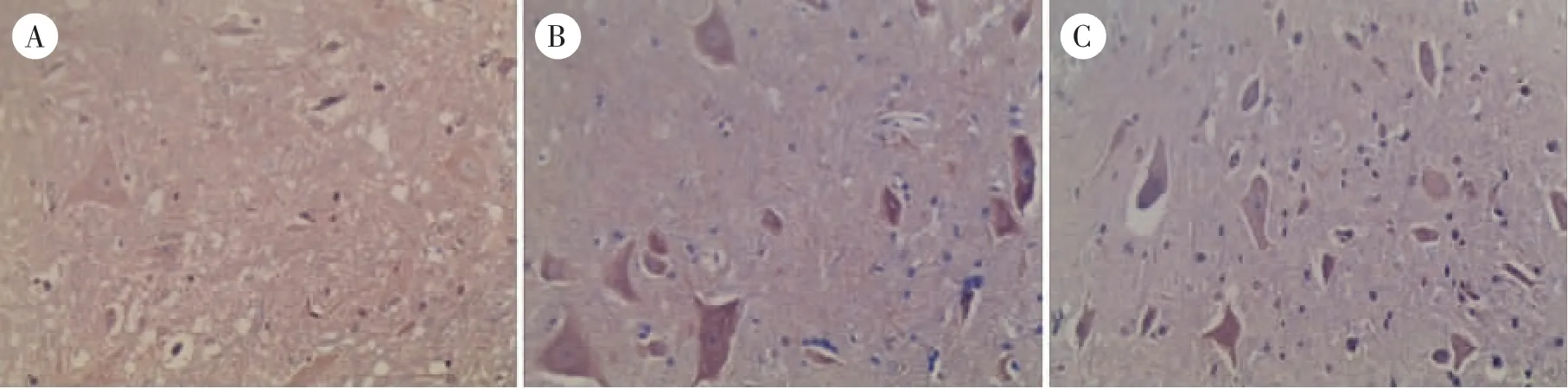
图2 3 组兔脊髓组织IL-1β 阳性表达(×200)Figure 2 Positive expression of IL-1β in spinal cord tissue of rabbits in three groups (×200)
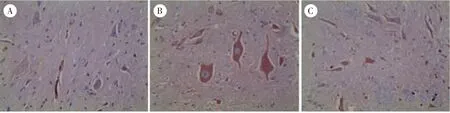
图3 3 组兔脊髓组织IL-6 阳性表达(×200)Figure 3 Positive expression of IL-6 in spinal cord tissue of rabbits in three groups (×200)
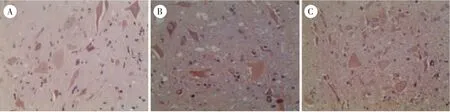
图4 3 组兔脊髓组织TNF-α 阳性表达(×200)Figure 4 Positive expression of TNF-α in spinal cord tissue of rabbits in three groups (×200)
表5 3 组兔脊髓IL-1β、IL-6、TNF-α 阳性AOD 值比较(±s)Table 5 Comparison of positive AOD values of IL-1β,IL-6 and TNF-α in spinal cord of rabbits in three groups (±s)
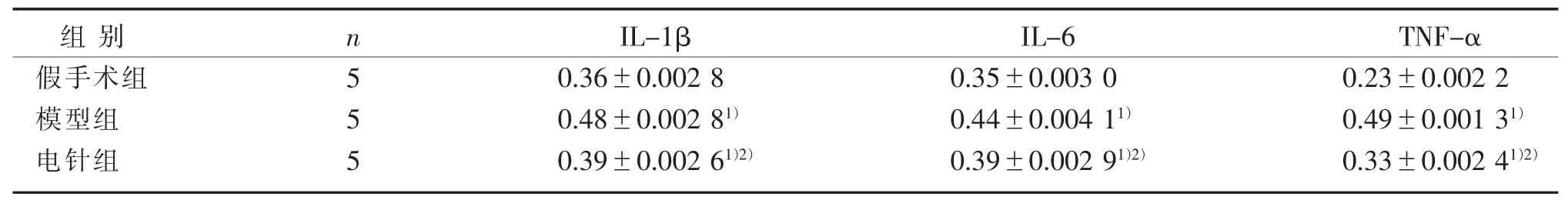
表5 3 组兔脊髓IL-1β、IL-6、TNF-α 阳性AOD 值比较(±s)Table 5 Comparison of positive AOD values of IL-1β,IL-6 and TNF-α in spinal cord of rabbits in three groups (±s)
注:与假手术组比较,1) P<0.05;与模型组比较,2) P<0.05。Note: Compared with the sham operation group, 1) P<0.05; Compared with the model group, 2) P<0.05.
TNF-α 0.23±0.002 2 0.49±0.001 31)0.33±0.002 41)2)组别假手术组模型组电针组n 5 5 5 IL-1β 0.36±0.002 8 0.48±0.002 81)0.39±0.002 61)2)IL-6 0.35±0.003 0 0.44±0.004 11)0.39±0.002 91)2)
3 讨 论
炎症因子分为促炎因子和抑炎因子两部分,在发生损伤的早期阶段,机体会分泌适量的促炎因子建立防御机制,抵御伤害。 在各种因素的影响下,机体自身的调节功能失衡,会产生过量的促炎因子,引起瀑布样炎症反应,导致炎症反应失控,引发全身炎症反应综合征,甚至多器官功能障碍综合征等严重后果,造成器官和躯体损害。 SCII 就是脊髓炎症反应失控的一种表现,在脊髓缺血再灌注过程中,免疫炎症反应倾向于造成脊髓损伤。
3.1 脊髓缺血再灌注损伤后TNF-α、IL-6、IL-1β及IL-1Rα 等炎症因子表达明显上升
ELISA 法检测结果显示,与假手术组比较,模型组促炎因子TNF-α、IL-6、IL-1β 与抑炎因子IL-1Rα 在再灌注4、8、12 h 均有不同程度的上升;此外,免疫组化分析结果显示模型组促炎因子表达也明显上升,其表达位置集中在神经元胞浆中。 这提示促炎因子与抑炎因子均参与了脊髓炎症反应。 炎症反应发生可能会造成脊髓组织损伤, 本研究的HE 染色结果证实了这一观点。 模型组兔脊髓组织光镜下显示脊髓组织中神经元数量减少,细胞胞核及胞浆着色较浅,胞核固缩或消失等病理变化。 IL-1Rα 是一种天然抗炎剂,其与IL-1β 受体结合切断IL-1β 生物活性,具有很好的抗炎作用。IL-1Rα 水平在再灌注后4 h 有明显表达,再灌注后8 h 时达到高峰,再灌注后12 h 时呈下降趋势;而IL-1β 在再灌注后4、8、12 h 均上升,但在再灌注后12 h 时上升幅度减小,证实IL-1Rα 对IL-1β 具有明显抑制作用,这提示IL-1Rα 只在再灌注后8 h 内发挥最大的保护作用,因此其抗炎作用有限。
TNF-α 作为机体内多种细胞因子的启动因子,具有协同放大炎症级联反应的作用[11]。 本研究结果显示,模型组TNF-α 的表达在再灌注后8 h 达最高峰,这与苏权等[12]研究结果一致。 而安民等[13]实验研究结果则显示,脊髓组织中的TNF-α 在再灌注后6、12、24 h 均保持高水平的表达,在再灌注后12 h 时达最高峰,这种差异可能与检测材料、观察时间点不同有关。 这提示,TNF-α 在不同时间点脊髓炎症反应中均具有重要的意义。在再灌注后4、8、12 h 3 个时间点TNF-α 的变化规律与IL-1Rα 一致,但这种变化规律究竟是由于IL-1Rα 的影响,还是TNF-α 本身的变化规律尚不明确,需要后续进一步研究。
IL-6 是具有促炎作用的细胞因子,在SCII 早期即有明显表达,可以进一步加剧炎症反应,损伤脊髓[14]。 本研究结果显示,IL-6 在再灌注后4、8、12 h 3 个时间点的表达均呈现上升趋势,这与TNF-α的变化趋势不同。 这提示,IL-6 在脊髓炎症反应中可能发挥更重要的作用。 因此,平衡炎症因子表达,抑制炎症反应是减轻脊髓缺血再灌注损伤的主要策略。
3.2 电针预处理干预有助于抑制脊髓缺血再灌注损伤后炎症反应
本研究结果显示,与模型组同一时间比较,电针组IL-1β、IL-6、TNF-α 的表达均明显改变,再灌注损伤后4、8、12 h 电针组IL-1β、TNF-α 表达均明显降低,而IL-6 在再灌注损伤后4、8 h 表达明显上升,12 h 表达明显下降,这提示电针可有效抑制IL-1β、TNF-α 的表达,具有良好的抑炎作用,但对IL-6 的抑制作用不明显;与模型组再灌注4 h 比较,电针组IL-1Rα 的表达上升,之后呈逐渐降低趋势,这与IL-1β、TNF-α 的表达趋势相反,这提示电针促进IL-1Rα 的表达具有时间窗效应。 因此,临床上可以通过电针疗法抑制炎症反应,有效减轻脊髓损伤后的继发性损害,保护脊髓组织,但在治疗时应注意时间窗效应。
HE 染色结果显示,与模型组比较,电针组脊髓组织出现神经元数量增加,细胞胞核、核仁萎缩减轻,细胞破坏程度下降等良好变化,这与唐能能等[15]的研究结果一致。 这可能与本研究充分发挥针与电的双重作用,从而提高治疗效果有关。 本研究电针参数设置如下:疏密波,频率10 Hz,强度以保持肢体轻微震颤为度,时间30 min。 疏密波可以更加快速地清除自由基,促进脊髓损伤大鼠运动功能的恢复;而频率1~100 Hz 疏密波可以有效促进局部组织血液循环,改善神经组织营养,提高新陈代谢,促进炎症吸收。 这与张尧等[16-18]研究结果一致。此外,本研究采用电针针刺悬钟穴、阳陵泉穴,这2个穴位均分布于足少阳胆经,属于八会穴,分别是筋与髓的精气汇聚之处。 针刺这2 个穴位可以有效激发脏腑经络之气,促进气血流通,濡养经脉,从而缓解肌肉痉挛,改善肢体运动功能障碍[19]。这与陈向华等[20]研究结果一致。
4 小 结
本研究证实电针阳陵泉穴、悬钟穴干预SCII,对脊髓组织具有良好的保护作用,而这可能是通过介导免疫炎症反应发挥作用,其具体作用机制可能是在特定时间点电针通过上调IL-1Rα 的表达,降低TNF-α、IL-1β 及IL-6 的水平,从而发挥对脊髓组织的免疫保护作用。 这可为临床早期开始治疗SCII 提供一定的理论依据。

