大鼠灌胃消癌解毒方水煎液后2种入血的单糖苷类成分含量测定及其药代动力学研究△
钱桂英,闫秋莹,程海波,沈卫星,谭佳妮,李柳,孙东东*
1.南京中医药大学 常熟附属医院,江苏 苏州 215500;2.国家中医药管理局 名医验方评价与转化重点研究室/江苏省抗肿瘤验方研究与产业化工程实验室/江苏省中医药防治肿瘤协同创新中心/南京中医药大学 转化医学研究中心,江苏 南京 210023
肿瘤是由多种因素引起的复杂难治性疾病,近年来其发生率有上升趋势[1]。当前通过早期检测和主动预防可以降低肿瘤的发生、干预肿瘤的发展[2]。长期以来,中药被广泛应用于肿瘤防治,在提高患者生存质量、延缓肿瘤发展进程、延长患者生存时间等方面发挥重要作用[3]。消癌解毒方是基于癌毒病机理论,针对不同肿瘤配伍形成的系列有效验方[4],本实验所用方主要针对乳腺癌防治,其由天葵子、八月札、柴胡、漏芦、白毛夏枯草和天冬组成,全方共奏抗癌解毒、疏肝解郁、化痰散结之功效。现代研究表明,方中所用药味在抑制肿瘤细胞增殖、调节免疫功能、抗炎和抗菌等方面有广泛的药理活性[5-12]。去乙酰哈巴苷与紫草氰苷分别是白毛夏枯草和天葵子的主要活性成分,具有显著的抗肿瘤作用[13-14]。有文献报道采用高效液相色谱(HPLC)法进行大鼠血浆中乙酰哈巴苷的药代动力学研究[15],本团队也建立了UPLC-MS/MS法测定大鼠灌胃天葵子水提物后血浆中紫草氰苷和格列风内酯的浓度[16]。由于天葵子与白毛夏枯草为该方的君臣主药,在全方中起主要作用并具有较高剂量,所以其安全性应引起重视;同时整方的药效依赖于入血成分维持一定的浓度,主要药味的活性累加作用尤为明显。UPLC-MS/MS技术应用于含量测定更加灵敏高效,鉴于此,本研究采用UPLC-MS/MS技术,建立同时测定大鼠灌胃消癌解毒方水煎液后血浆中乙酰哈巴苷和紫草氰苷含量的方法,并进行2种化合物的药代动力学研究。
1 材料
1.1 实验动物
SPF级SD大鼠,雌雄各半,体质量180~220 g,购自上海斯莱克实验动物公司,实验动物许可证SCXK(沪)2007-0005。实验前适应性饲养1周,温度(25±2) ℃,12 h/12 h明暗光照循环。
1.2 试药
柴胡BupleurumchinenseDC.、天冬Asparaguscochinchinensis(Lour.) Merr.、白毛夏枯草AjugadecumbensThunb.、八月札Akebiaquinata(Thunb.) Decne、漏芦Rhaponticumuniflorum(L.)DC.和天葵子Semiaquilegiaadozoides(DC.)Makino药材均购自安徽亳州国源中药材公司,经南京中医药大学陈建伟教授鉴定为正品;乙酰哈巴苷(批号:P07D6F7164)、紫草氰苷(批号:PM0517SA13)及内标黄芩苷(批号:P09M7F10367)均购自上海源叶生物科技公司,纯度均大于98%;质谱级乙腈和甲醇购自美国默克公司;超纯水使用南京EPDA公司超纯水仪自制。
1.3 仪器
岛津UHPLC系统,搭载LC-30AD泵、在线脱气、自动进样器、柱温箱(日本岛津公司);三重四极杆5500 MS/MS系统(美国AB公司)。
2 方法与结果
2.1 色谱条件
Agilent Extend C18柱(100 mm×2.1 mm,1.8 μm)。0.1%甲酸水溶液(A)-乙腈(B)作为流动相。梯度洗脱程序(0~1 min,5%~20%B;1~4 min,20%~60%B;4~6 min,60%~70%B;6~6.5 min,70%~5%B;6.5~7.5 min,5%B),进样体积3 μL,柱温4 ℃,流速0.3 mL·min-1。
2.2 质谱条件
采用电喷雾离子源(ESI);扫描方式为多反应监测(MRM),待测物在正离子模式下进行检测,乙酰哈巴苷m/z429.2/369.2,紫草氰苷m/z330.3/168.2,黄芩苷m/z447.2/271.1。检测条件为气帘气(CU):241.15 kPa;离子源温度:500 ℃;雾化气(GS1)压力:378.95 kPa;雾化气(GS2)压力:378.95 kPa。
2.3 消癌解毒方药材提取
消癌解毒方组成为柴胡6 g、天冬10 g、白毛夏枯草15 g、八月札10 g、漏芦15 g和天葵子 15 g。将所有药材混合后,分别加入10、8倍水,提取2次,每次2 h。将所得滤液抽真空浓缩至2 g·mL-1(以生药量计)。
2.4 给药与血浆样品采集
12只大鼠随机分为2组,根据临床人用剂量进行换算后,给药组灌胃消癌解毒方提取物27 g·kg-1,对照组给予3 mL生理盐水。在末次给药前及给药后0.25、0.50、1.00、2.00、3.00、5.00、8.00、12.00、24.00 h眼眶采血约0.3 mL于1.5 mL肝素化离心管中,5000 r·min-1(离心半径7 cm)离心10 min,-80 ℃储存。
2.5 血浆样品预处理
90 μL血浆样品加入10 μL内标溶液和300 μL甲醇溶液,涡旋5 min,13 000 r·min-1(离心半径7 cm),4 ℃离心10 min,上清低温离心干燥,残留物使用100 μL甲醇复溶,涡旋1 min,13 000 r·min-1(离心半径7 cm)离心10 min。取上清3 μL进行检测。取100 μL血浆样品加入300 μL甲醇后,做上述相同处理,作为空白血浆样品。
2.6 方法学考察
2.6.1标准曲线系列溶液与质控(QC)样品制备 精密称取乙酰哈巴苷、紫草氰苷及内标黄芩苷,加入甲醇溶解,使其母液质量浓度分别为:乙酰哈巴苷115 μg·mL-1、紫草氰苷73 μg·mL-1、黄芩苷276 μg·mL-1。标准曲线系列溶液通过使用甲醇稀释母液至适当质量浓度制备。内标储备液质量浓度为2 μg/mL。标准曲线系列溶液使用10 μL工作液加入90 μL空白血浆制备。乙酰哈巴苷系列溶液质量浓度分别为1.11、2.21、3.16、4.42、44.23、176.92、221.15 ng·mL-1,紫草氰苷系列溶液质量浓度分别为0.70、1.40、2.01、2.81、28.08、112.32、140.40 ng·mL-1。乙酰哈巴苷QC样品质量浓度为2.21、4.42、176.92 ng·mL-1,紫草氰苷QC样品质量浓度为1.40、2.81、112.32 ng·mL-1。上述样品保存于4 ℃,备用。
2.6.2专属性 制备分别含有乙酰哈巴苷、紫草氰苷和黄芩苷20 ng·mL-1工作液,使用10 μL工作液加入90 μL空白血浆,制备空白血浆+混合对照品样品,取空白血浆样品、空白血浆+混合对照品样品及灌胃后0.5 h血浆样品进行检测。结果见图1,血浆中成分对各待测物无干扰,方法属性良好。
2.6.3线性关系与检测限 以各待测物浓为X,各待测物和内标峰面积的比值为Y,进行线性回归,得到各待测物的标准曲线。各待测物最低检测浓度(LLOQ)作为标准曲线上质量浓度最低点。测得的平均质量浓度在其标准质量浓度的±20%,且RSD≤20%。结果如表1所示,各待测物在其线性范围内,线性关系良好。
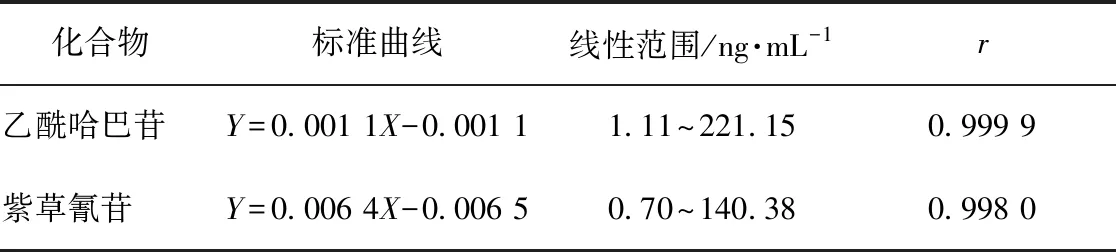
表1 血浆中各待测物标准曲线及线性范围
2.6.4精密度与准确度 QC样品低、中、高3个质量浓度分别重复检测6次,根据标准曲线计算各待测物质量浓度,内标样品的日内精密度和日间精密度RSD分别为5.64%和0.97%。QC样品的日内、日间精密度RSD均在±15%。乙酰哈巴苷3个质量浓度日内精密度RSD分别为2.74%、1.54%、2.93%,日间精密度RSD分别为4.10%、1.50%、2.90%;紫草氰苷3个质量浓度日内精密度RSD分别为1.32%、0.58%、3.28%,日间精密度RSD分别为12.45%、1.32%、0.17%;准确度通过QC样品检测质量浓度与实际质量浓度比值计算,内标准确度RE为-3.63%,乙酰哈巴苷3个质量浓度日内准确度RE分别为-2.82%、3.03%、-2.56%,日间准确度RE分别为7.86%、1.06%、-5.10%;紫草氰苷3个质量浓度日内准确度RE分别为13.61%、-14.37%、-4.81%,日间准确度RE分别为-1.31%、-12.45、2.74%。结果表明,该方法对各待测物具有良好的精密度和准确度。
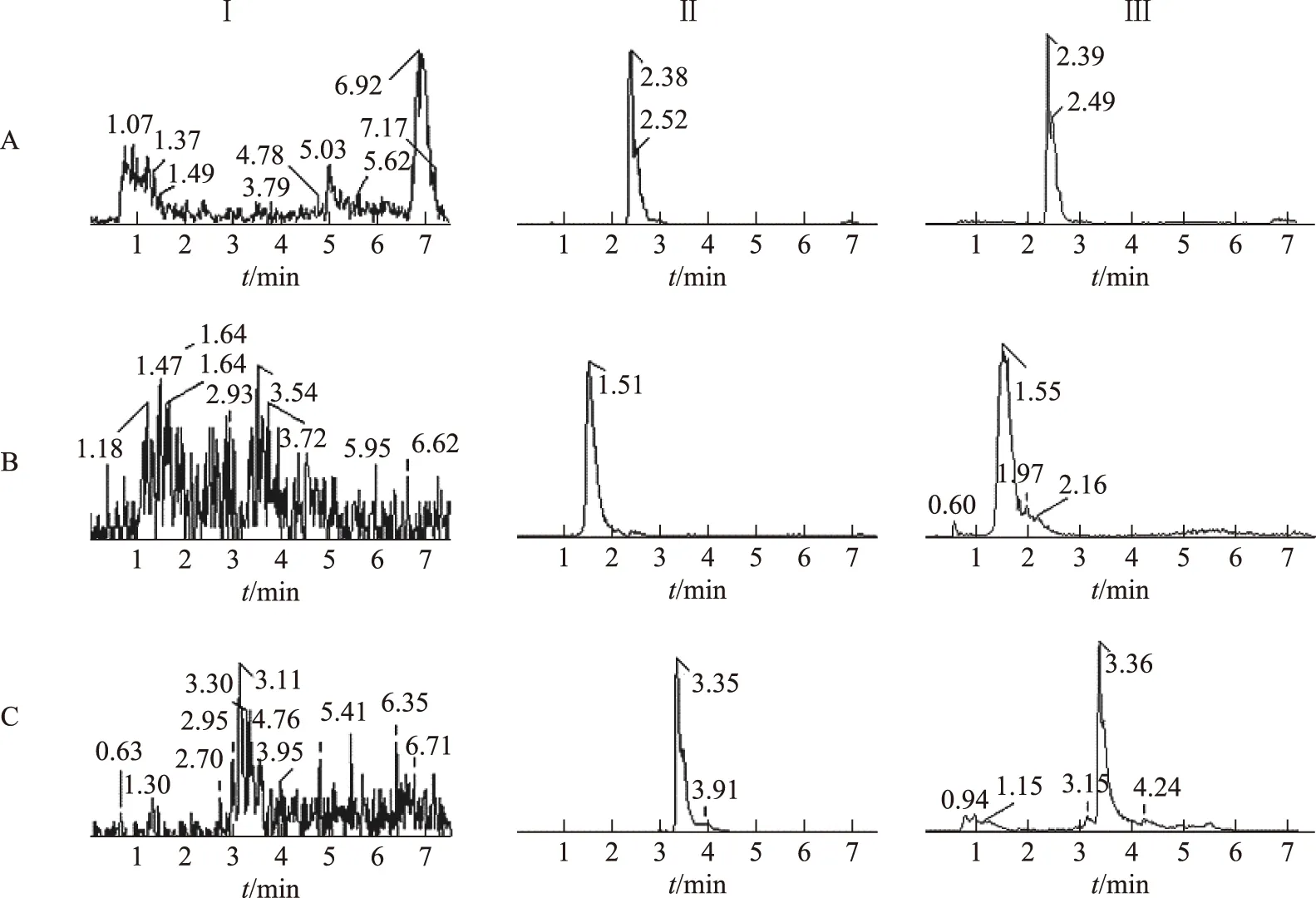
注:Ⅰ.空白血浆;Ⅱ.空白血浆+混合对照品;Ⅲ.灌胃后0.5 h血浆+黄芩苷;A.乙酰哈巴苷;B.紫草氰苷;C.黄芩苷。图1 血浆中乙酰哈巴苷、紫草氰苷和黄芩苷的液相色谱图
2.6.5提取回收率与基质效应 各待测物的提取回收率通过比较QC样品中峰面积和标准溶液中峰面积得到。分别取乙酰哈巴苷和紫草氰苷3个质量浓度的QC样品进行检测,得到峰面积A1,每个质量浓度平行检测6个样本;将空白血浆处理后得到上清,分别加入乙酰哈巴苷和紫草氰苷配制成与QC样品相应质量浓度的样品,分别检测得到峰面积A2,每个质量浓度平行检测6个样品,通过公式A1/A2×100%计算得到提取回收率,内标提取回收率使用相同方法计算。基质效应通过比较前处理血浆样品中各待测物中的样品峰面积与甲醇溶液中各待测物的样品峰面积评价。分别配制乙酰哈巴苷和紫草氰苷3个与QC样品相同质量浓度的对照品工作液,不经过处理直接进行检测,得到峰面积A3,通过公式A2/A3×100%计算得到基质效应,内标基质效应使用相同方法计算。结果表明,内标提取回收率为81.84%,基质效应为81.27%,各待测物提取回收率为89.56%~109.03%,基质效应为86.03%~104.46%。各待测物提取回收率良好,血浆中内源性物质对待测物无明显基质效应。
2.6.6稳定性 分别将3个质量浓度的血浆QC样品放置在室温24 h后检测各待测物的浓度,得到各待测样品短期稳定性结果;将3个质量浓度血浆QC样品进行3次冻融循环后检测各待测物的浓度,得到各待测物冻融循环的稳定性,结果表明,在2种不同的情况下,各待测物检测结果RSD均在15%以内,表明其稳定性良好。
2.7 药代动力学研究
对2.4项下得到的各血浆样品进行含量测定,使用DAS 2.0软件对其进行非房室模型拟合。各活性成分血药浓度-时间曲线见图2,药代动力学参数峰浓度(Cmax)、药时曲线下面积(AUC)、达峰时间(Tmax)、半衰期(t1/2)和平均驻留时间(MRT)见表2。由图2可知,乙酰哈巴苷在体内被快速吸收,灌胃后0.5 h达到最高血药浓度,紫草氰苷在灌胃后3 h达到最大血药浓度,紫草氰苷出现吸收双峰,且第2个吸收峰高于第1个。
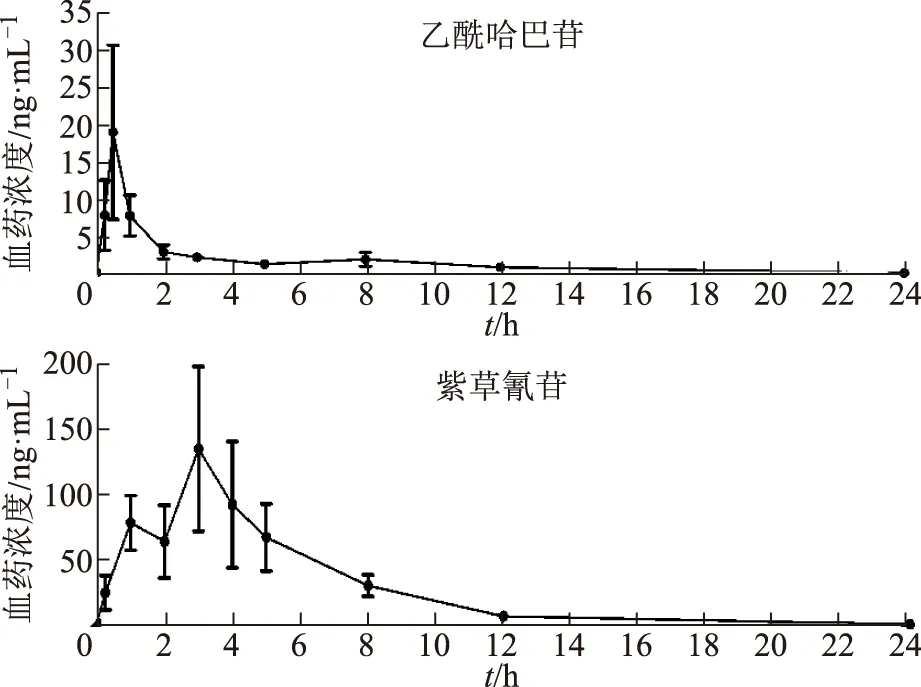
图2 乙酰哈巴苷、紫草氰苷血药浓度曲线
表2 各待测物药代动力学参数
3 讨论
有文章报道使用HPLC对乙酰哈巴苷进行药代动力学研究[15],该方法检测灵敏度较低。本课题组曾通过UPLC-MS/MS检测大鼠血浆中紫草氰苷和格列风内酯的含量[16],得到良好的检测结果,因此将此方法应用于本研究。为得到良好的检测结果,本研究对不同的流动相系统进行考察,如甲醇水溶液、甲醇-0.1%甲酸水溶液、乙腈水溶液、乙腈-0.1%甲酸水溶液等,结果表明乙腈-0.1%甲酸水溶液梯度洗脱具有更好的响应,各待测物也能够更好地分离,血浆中的内源性成分也不会对待测物产生显著的影响。
药代动力学研究表明,乙酰哈巴苷的MRT和t1/2均长于紫草氰苷,表明乙酰哈巴苷在大鼠体内消除更加缓慢,更有利于保持药物疗效。乙酰哈巴苷和紫草氰苷Tmax明显不同,使2种成分在不同的时间达到Cmax,避免同时达到Cmax而产生毒副作用。与文献报道尾静脉注射乙酰哈巴苷相比较[15],乙酰哈巴苷Tmax、t1/2和MRT0~t值均明显延后,分析其原因为灌胃给药后药物需要经过吸收后才能入血、分布及代谢,灌胃后其消除曲线与尾静脉给药消除曲线一致。与单独灌胃天葵子后检测到的紫草氰苷药代动力学参数比较[16],本研究中紫草氰苷的Tmax和t1/2均延后,可能与其在复方配伍后多种成分相互影响有关。乙酰哈巴苷和紫草氰苷在大鼠灌胃消癌解毒方和单味药材提取物后的药代动力学比较研究,有利于进一步阐明药物之间的相互作用,值得进一步研究。
本研究建立了同时测定消癌解毒方中2种潜在抗肿瘤成分的UPLC-MS/MS,并将其应用于2种成分的药代动力学研究,为消癌解毒方应用的安全性及药效作用研究提供参考。

