不同处理条件下11种有毒药用植物的DNA条形码鉴定△
赵喆,李明宇,何仟,程瑾*,谢磊
1.北京林业大学,北京 100083;2.中国疾病预防控制中心 职业卫生与中毒控制所,北京 100050
DNA条形码技术是利用标准的且有足够信息并容易扩增的短DNA片段,创建生物的身份识别系统的技术[1-3]。该方法不仅可以为生物分类学、生态学等理论研究领域服务,同时可以作为许多应用领域的有力鉴别工具,如中药资源鉴定、药物及食品市场监督等[4-14]。DNA条形码技术通常包括DNA提取、聚合酶链式反应(PCR)扩增、DNA测序、序列校对和鉴定分析等重要环节[1]。在DNA条形码作为鉴定工具的实际应用过程中,待鉴定的植物材料情况可能十分复杂。这种情况可能严重影响DNA质量和PCR扩增过程,对鉴定成功率造成影响。
在我国,由于误食有毒药用植物引起的食物中毒事件多有报道[15]。中毒事件发生后,快速准确地鉴定有毒植物对开展有针对性的治疗至关重要。中毒现场的有毒植物往往缺乏可用于形态学鉴定的关键性状(如花、果等),因此DNA条形码技术为快速鉴定有毒植物提供了有效工具[16-17]。然而,中毒现场的植物材料往往经过了高温处理甚至经过了胃液消化,是否仍然能够用于分子鉴定工作目前仍缺乏实验研究数据。
本研究采用直接PCR技术[18],选取11种有毒药用植物和1种对照材料,通过模拟常见中毒案例可能出现的情况,设计了21种实验材料处理条件,并对每种处理分别使用6对常用引物进行扩增、测序和分子鉴定,从而检验不同材料处理方法对PCR扩增与测序的影响,为DNA条形码技术在有毒植物鉴定中的应用提供参考。
1 材料与方法
1.1 材料
选取常见的11种有毒药用植物和1种对照植物,共9科12属12种,所有植物样本均经北京林业大学自然保护区学院谢磊副教授进行准确形态学鉴定(见表1)。掌叶半夏和芹取自北京林业大学温室,互叶醉鱼草和花菱草取自北京药用植物园,其他植物材料均来自野外采集。

表1 实验样品及标本信息(APG IV分类系统)
1.2 样品处理
根据实际中毒案例可能出现的情况,设计了新鲜叶片、沸水处理叶片、胃液处理叶片、沸水结合胃液处理叶片等样品处理方法。结合常规硅胶干燥处理方法,共采用21种不同的材料处理方法(见表2)。

表2 植物材料的不同处理方法
人工胃液根据《中华人民共和国药典》2015年版[19]配制。取用37%盐酸234 mL,加入蒸馏水766 mL稀释至1000 mL得稀盐酸。取稀盐酸16.4 mL加入蒸馏水800 mL,胃蛋白酶10 g,搅拌均匀,加水稀释至1000 mL得人工胃液。人工胃液pH为1~2,使用温度为(37±1) ℃。
1.2.1新鲜叶片处理 将野外或温室栽培有毒药用植物的新鲜叶片取下,封口袋封存,立即放入4 ℃冰箱,防止水分散失。后续实验在1~2 d内完成。
1.2.2硅胶干燥处理 将采集到的新鲜有毒药用植物叶片材料放入密封袋中,加入变色硅胶直至叶片完全被遮盖,封闭密封袋。获得硅胶干燥的植物叶片后即可称量并完成后续实验。
1.2.3沸水加热处理 模拟烹饪过程,将新鲜的有毒药用植物叶片材料置于沸水(100 ℃)中处理。使用电磁炉煮沸蒸馏水后加入新鲜植物叶片并计时,到时后用镊子取出,用滤纸吸附净叶片上的多余水分,称量并完成后续实验。
1.2.4人工胃液处理 模拟胃消化食物过程,使用消毒的一次性枪头捣碎空烧杯中新鲜植物叶片,模拟咀嚼过程,之后加入人工胃液,直至被捣碎叶片被胃液完全浸没。烧杯置于37 ℃水浴锅中水浴处理20 min,期间不断震荡保证叶片与人工胃液接触充分且反应完全。取出叶片,蒸馏水冲洗后用滤纸吸附净叶片上的多余水分,称量并完成后续实验。
1.2.5沸水加热+胃液处理 蒸馏水经过加热煮沸后加入药用植物叶片并计时,到时后用镊子取出置于空瓶中,吸干净多余水分。使用干净的一次性枪头捣碎沸水煮过的叶片,模拟咀嚼过程,之后加入人工胃液,直至被捣碎叶片完全浸没。烧杯放置于37 ℃水浴锅中水浴处理20 min,期间不断震荡保证叶片与人工胃液接触充分,反应完全。取出叶片,蒸馏水冲洗之后用滤纸吸附叶片上的多余水分,称量并完成后续实验。
1.3 直接PCR扩增与测序
1.3.1直接PCR扩增 为了加快分子鉴定实验速度,采用Kasajima等[20]提出的快速获得DNA提取液的方法用于直接PCR实验。配制Edwards溶液[Tris-HCl(pH=7.5)200 mmol·L-1,EDTA(乙二胺四乙酸)25 mmol·L-1;NaCl 250 mmol·L-1,0.5%SDS(十二烷基硫酸钠)]、TE Buffer[Tris-HCl(pH=8)10 mmol·L-1,EDTA 1 mmol·L-1][21]。取TE Buffer 10倍稀释Edwards溶液,即获得快速提取液,存于瓶中备用。
取3~5 mg经过不同处理的有毒药用植物叶片组织,进行称量并记录质量,置于研钵中稍许研磨;加入200 μL快速提取液,沿同一方向快速研磨至匀浆状,无肉眼可见块状碎片,收集于1.5 mL的离心管中。再向研钵中加入200 μL提取液,冲洗研钵中残留液体,将液体小心收集于离心管中,防止DNA损失。加入400 μL ddH2O稀释提取液并小心上下颠倒,混匀;12 000 r·s-1离心5 s(离心半径8 cm),移取出上清液直接用于PCR扩增。
选取5个常用于植物DNA条形码片段的6对不同引物进行扩增[22-24],引物信息见表3。PCR总体系为25 μL,其中包括DNA模版1 μL,dd H2O 9.5 μL,双向引物各1 μL,PCR master mix 12.5 μL(天根生化科技有限公司)。PCR反应循环程序:94 ℃预变性3 min;94 ℃变性20 s;54 ℃退火30 s;72 ℃延伸60 s,共25个循环;72 ℃终延伸5 min,获得扩增产物。

表3 引物名称及序列
采用1.2%琼脂糖凝胶对PCR反应产物进行电泳检测。取1 μL Novel Juice染料(Bio-Helix公司)与2 μL扩增产物混合进行电泳,拍照观察结果。
1.3.2测序 PCR扩增产物送北京诺赛基因组研究中心有限公司进行双向测序。测序采用末端终止法,以纯化后的PCR产物为模板,使用BigDye terminator试剂盒(Applied Biosyetems公司)与单侧扩增引物做末端终止PCR反应。反应包程序:96 ℃变性30 s;50 ℃退火30 s;60 ℃延伸4 min,共30个循环。测序反应产物经过纯化后,用ABI 3730xl型测序仪测序。产生的原始序列数据使用Geneious R11[25]进行编辑处理去除机读错误。
1.4 序列扩增成功率检验与分子鉴定分析
采用Blast法[17]将校对好的序列与美国国家生物技术信息中心(NCBI,https://www.ncbi.nlm. nih.gov/)已经公布的序列进行比对,相似性指数最高的匹配即为鉴定结果[17],检测本实验方法的可行性,科、属、种鉴定的准确性以及是否存在污染情况。
2 结果与分析
2.1 DNA提取及PCR扩增结果
对12种植物叶片采用21种不同处理后提取的DNA进行了6种不同引物的PCR扩增,结果表明,使用不同处理方法及不同引物对DNA扩增结果均有一定影响。
除psbA-trnH片段外,新鲜叶片的PCR成功率明显高于硅胶干燥处理下的扩增成功率。在沸水加热处理条件下,随着沸水处理时长增加,PCR扩增成功率呈不断降低趋势。与未经过胃酸处理的样品相比,胃酸处理后样品PCR扩增成功率降低(见图1)。
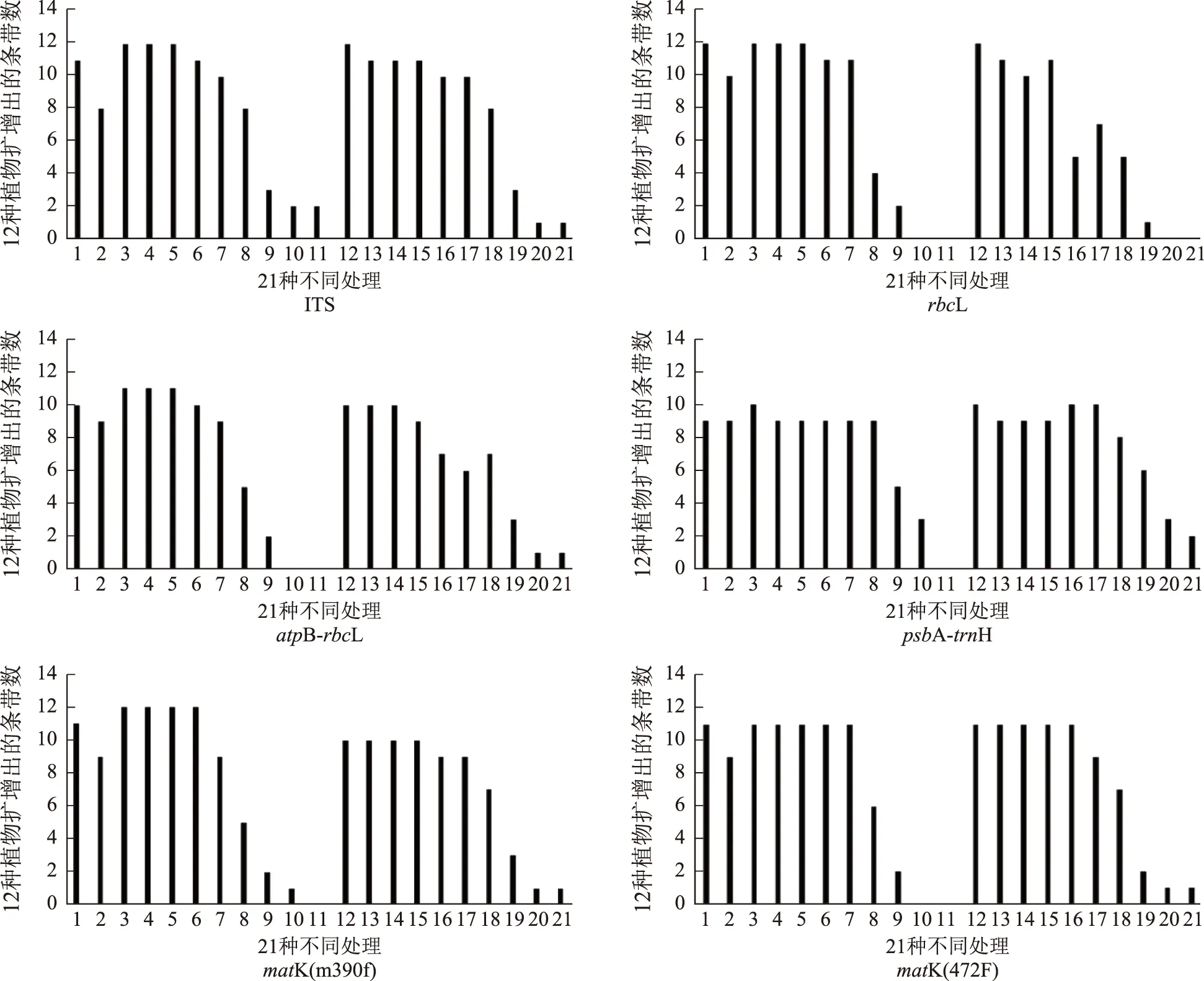
注:横坐标数字代表不同处理方法;1.新鲜叶片;2.硅胶干燥;3.沸水加热10 s;4.沸水加热20 s;5.沸水加热30 s;6.沸水加热5 min;7.沸水加热10 min;8.沸水加热15 min;9.沸水加热30 min;10.沸水加热45 min;11.沸水加热60 min;12.胃液处理;13.加热10 s后使用胃液处理;14.加热20 s后使用胃液处理;15.加热30 s后使用胃液处理;16.加热5 min后使用胃液处理;17.加热10 min后使用胃液处理;18.加热15 min后使用胃液处理;19.加热30 min后使用胃液处理;20.加热45 min后使用胃液处理;21.加热60 min后使用胃液处理。图1 不同引物对不同处理方法药用植物DNA扩增结果的影响
ITS引物扩增的样品无论是否进行胃酸处理,在加热15 min以内其扩增成功率均可以达到较高水平。而rbcL引物在加热10 min的处理下仍可保证较高的扩增成功率,即使是在胃酸处理后也能保持较高的成功率。使用atpB-rbcL引物的扩增效果在相同处理条件下PCR成功率略低于前2个引物。变异速率最快、GC含量较低的psbA-trnH引物相对于其他5种引物总体的PCR扩增成功率最低,而沸水加热处理在15 min内对该引物PCR扩增成功率没有影响,超过15 min成功率显著下降。matK(390f)与matK(472F)引物比较,在加热5 min内前者的扩增成功率略高,而在胃酸处理下后者扩增成功率更高。
2.2 序列检测结果
将扩增成功的PCR产物进行DNA测序。一些PCR反应虽然可以检测出明显的条带,但是由于PCR产物浓度不高或序列存在特殊结构等原因不能成功测序。对于本研究的12个植物种类,最终有11个种类获得了ITS和matK(2个引物结果相同)序列,所有种类都获得了rbcL序列,而10个种类获得了atpB-rbcL 和psbA-trnH序列。无论哪种材料处理方法,北马兜铃的ITS片段测序失败,毛茛的matK片段测序失败,掌叶半夏和一把伞南星的atpB-rbcL片段测序失败,一把伞南星和商陆的psbA-trnH片段测序失败。
2.3 分子鉴定成功率
将校对好的序列在NCBI数据库中进行Blast搜索,检索结果以相似性最高的匹配为准。根据最高匹配结果,统计了各引物在科、属、种水平上的鉴定正确率。在科、属、种水平上,形态学鉴定结果与Blast结果完全一致的记为鉴定正确,不一致的记为鉴定错误。结果表明,对于所有获得的条码序列,使用Blast方法在科水平上的鉴定结果正确率为100.00%(见表4),在属水平上,仅有花菱草的atpB-rbcL片段鉴定结果为博落茴属植物,其他鉴定均正确。而在种水平上,除了ITS片段之外,其他所有序列的鉴定成功率均较低,其中rbcL的种级鉴定成功率最低,psbA-trnH在叶绿体片段种级鉴定成功率最高。

表4 6种引物扩增片段在科、属、种水平上的鉴定成功率 %
3 讨论
常规的DNA提取方法操作一般较为复杂,步骤常涉及植物组织破碎、细胞裂解、酚氯仿萃取、异戊醇抽提等,耗时较多且需大量有毒试剂,不符合鉴定所需的快速简便的要求。直接PCR技术操作简便、耗时较短,大大降低了分子鉴定的工作量。本研究采用的DNA制备法相较于传统的十六烷基三甲基溴化铵(CTAB)法、十二烷基苯磺酸钠(SDS)法、试剂盒提取等方法,实验操作简便快捷。整个实验操作无需使用液氮研磨,使用试剂种类少,操作步骤简单,少有离心的过程,获得用于PCR扩增的DNA仅需数分钟,符合快速鉴定要求。同时,本方法对实验室条件要求较低,需要的实验器材和试剂种类少,使用的试剂均为实验室常备试剂,配制简单,不需要三氯甲烷、苯酚等传统常用DNA提取试剂,减少了有毒试剂的使用。此外,常规方法提取DNA要求的植物组织材料往往较多,常在100 mg左右。而本研究提供的方法需要的材料用量少,仅需3~5 mg叶片即能提取出适用于后续PCR扩增测序的DNA片段。
有研究表明,直接PCR技术只宜针对某些特定植物,难以大规模采用,且提取到的DNA质量较低,含有大量杂质,无法满足PCR扩增鉴定要求[26-27]。从本研究的PCR扩增和测序成功率来看,该方法的确在掌叶半夏、一把伞南星、北马兜铃等植物的某些片段扩增中无法取得成功,但对测试的绝大多数实验材料都能成功获得DNA条码序列,说明该方法对有毒药用植物的分子鉴定具有一定的普遍适用性。
本研究的直接PCR方法也存在一些明显的不足。为了缩短实验时间,DNA制备没有去除杂质过程,因此DNA提取液无法长久保存,只能当时进行PCR检测。此外,DNA提取液中不可避免的存在阻抑PCR反应的次生代谢物质。因此,在PCR扩增失败后可通过加入ddH2O稀释DNA提取液的方法降低阻抑物浓度,以达到提高PCR成功率的目的。另外,实验结果表明,硅胶干燥处理的植物材料PCR成功率普遍低于新鲜叶片材料。这可能是因为植物失水导致植物中的多糖、多酚以及其他代谢产物含量相对增加,使得DNA提取液中PCR反应阻抑物质浓度提高。
对植物材料的长时间高温处理会造成DNA严重降解。朱军民等[28]已研究证明100 ℃处理DNA,在5 min以上就会引起DNA分子不同程度的损害。本研究结果表明,短时间沸水处理的植物叶片材料仍可以用于直接PCR方法。经过10、20、30 s沸水煮后的叶片使用本提取方法均可在PCR扩增后的琼脂糖凝胶电泳检测中呈现清晰的目的条带,其产物也可以成功进行测序。沸水处理在1 min以内,对PCR实验结果几乎没有影响,多数植物材料经过煮沸5、10 min后仍能通过本方法进行PCR扩增,而煮沸15 min以上PCR成功率下降明显。因此,如果在实际中毒案例中,有毒植物经过15 min以上的高温处理,其分子鉴定成功率较低。
本研究中人工胃液处理对PCR成功率有一定程度的影响。胃液中含有的强酸和蛋白酶对DNA会有一定程度影响,加热处理加上咀嚼消化过程会造成DNA某种程度的降解。然而,总体来讲多数胃液消化后的植物叶片材料仍能获得较好的PCR扩增效果。一些植物材料,如互叶醉鱼草,加热结合胃液处理对PCR扩增和测序影响较小。此结果表明本研究方法可以适用于呕吐物的鉴定。
在DNA条形码通过测序获得之后,可使用多种鉴定分析方法[24]。常用的DNA条形码鉴定方法包括PWG距离法、构树法和Blast法等。由于前2种方法直观性较差,耗费时间较多,而Blast法基于公共数据平台,无需研究者自己构建基础数据库,操作最为直观快捷,所以Blast鉴定方法最适合用于快速分子鉴定的实际应用当中[17]。此方法在科、属级水平上成功率极高,而在种的水平上成功率显著降低。这与数据库中缺少许多有毒植物相关DNA数据有关,在将来数据库不断得到丰富扩充之后,物种水平的成功率也会相应得到提高。而且在实际中毒案例发生之后,有毒植物科、属的准确判断对采取有针对性的治疗方法已经充分有效。因此本研究提出的直接PCR实验方法对于有毒植物快速鉴定具有一定的实际应用前景。实际鉴定过程中,建议采用PCR扩增成功率高的ITS和rbcL片段相结合进行快速分子鉴定。而鉴于psbA-trnH片段在材料加热30 min以上仍有较高的PCR成功率,且该引物的种水平鉴定成功率在叶绿体片段中最高,建议在快速鉴定中3个片段同时使用以提高总体的成功率。

