重组人钙调蛋白磷酸酶B亚基在大鼠体内的药动学和组织分布特征
韩丽芳,张彩云,刘 莹,邵继平,谢学立,符 健
(海南医学院海南省药物临床前药理毒理学研究重点实验室,海南 海口 571199)
钙调蛋白磷酸酶B亚基(calcineurin subunit B,CNB)是钙调蛋白磷酸酶的调节亚基,能促进CNA的活性,且相对分子质量为19 000,性质稳定,其经典的功能是调节钙调蛋白磷酸酶的催化活性[1]。此外,CNB还有其单独的功能。本实验室前期研究表明,重组人CNB(recombinant human CNB,rhCNB)在体内外对肝癌和胃癌具有良好治疗效果,且具有高效低毒的特性。rhCNB作为一个基因工程新型药物国内外市场均无类似产品问世,已经作为一个基因工程抗癌新药进行开发[2-4],并获得了中国和美国专利[5-6]。
酶联免疫吸附法(enzyme linked immune sorbent assay,ELISA)由于特异性强、灵敏度高而广泛用于蛋白多肽类生物制品的药动学研究[7-8]。rhCNB作为我国自主研发的国家生物制品1类新型抗肿瘤生物药[9-10],目前缺少大鼠给药后的药动学和组织分布研究。本研究采用ELISA对大鼠iv给予rhCNB后血药浓度经时变化和组织分布进行研究,以阐明rhCNB在大鼠体内的药动学过程和组织分布学特征,为评价rhCNB用于肝癌和胃癌治疗的临床疗效提供行之有效的检测手段,并为设计和优化临床试验给药方案提供参考。
1 材料与方法
1.1 动物、药物、试剂和仪器
Wistar大鼠124只,SPF级,湖南斯莱克景达实验有限公司提供(动物使用许可证号:SYXK(琼)2016-0013),雌雄各半,体质量242~346 g,饲养于海南医学院药物安评中心动物房。注射用rhCNB(批号:20160910,规格:每瓶10 mg),海口奇力制药股份有限公司。rhCNB测定ELISA试剂盒(批号:A217020223),南京金斯瑞公司。TECAN酶标仪,奥地利TECAN有限公司;Centrifuge 5810低速离心机,德国Eppendorf公司;TGL-16M台式高速冷冻离心机,长沙湘麓离心机仪器有限公司;FJ200高速分散均质机,上海标本模具厂。
1.2 ELISA测定rhCNB浓度
将含rhCNB样品和对照品加入96孔板内,室温孵育1 h,洗板4次;加生物素标记的抗rhCNB单克隆抗体,孵育1 h,洗板4次;再加入辣根过氧化酶标记链霉亲和素,孵育10 min,洗板4次。加入四甲基联苯胺底物,避光室温孵育5~15 min,最后加终止液(硫酸0.5 mol·L-1)终止反应,于酶标仪450 nm处读取吸光度[11]。按上述方法对处理后的样品进行分析,将测得数据带入随行标准曲线,得出血药浓度。
1.3 方法学验证
1.3.1 选择性[12]
选择10只未给药大鼠的组织匀浆液,向其加入定量下限和定量上限水平的分析物来考察选择性,同时测定未加入分析物的组织匀浆液中rhCNB的含量。
1.3.2 线性范围
取未给药大鼠肺和胃组织匀浆液分别加入rhCNB对照品,配制成浓度为0,1,2,4,8,12和16 μg·L-1的标准曲线溶液,按1.2检测。
1.3.3 准确度和精密度
取未给药大鼠肺和胃组织匀浆液分别加入rhCNB标准品溶液制备成0,1,2,4,8,12和16 μg·L-1的标准曲线溶液,2,6和12 μg·L-1浓度质控样品(每浓度5平行样)及定量下限样品分别作为一个分析批,按1.2检测。连续测定3 d,考察1,2,6和12 μg·L-14种浓度肺和胃组织匀浆样品日内准确度、日间准确度、日内精密度和日间精密度。
1.3.4 回收率
取大鼠肺和胃组织空白匀浆液加入rhCNB对照品配制成20和1000 μg·L-1组织样品各5份,分别用1×稀释液稀释5和100倍后(终浓度为4和10 μg·L-1),按1.2检测。将测定结果与理论值比较,计算回收率(平均实测值/理论值×100%)。
1.3.5 稳定性
取大鼠肺和胃组织空白匀浆液加入rhCNB对照品配制成4,100和1000 μg·L-1组织样品各3份,分别在室温(25℃)置2 h、2~8℃置24 h和-20℃置1,4和8周,分别用1×稀释液稀释1,10和100倍后,按1.2检测,考察样本的稳定性。
1.4 给药和样品处理
取大鼠72只随机分为3组,每组24只,雌雄各半。大鼠iv剂量参考注射用rhCNB的药效学剂量,选择5,10和20 mg·kg-1作为单次给药剂量,分别于给药前及给药后 0.033,0.25,0.5,1,2,4,8和12 h采血;按20 mg·kg-1剂量每天给药1次,连续给药7 d进行多次给药实验,第4,5,6和7次给药前釆血用于谷浓度的测定,分别于末次给药后0.033,0.25,0.5,1,2,4,6,8和12 h采血。每次从大鼠眼眶静脉取血0.3 mL,置于肝素化离心管中,1500×g离心20 min,分离血浆,-20℃冰箱保存,按1.2测定rhCNB浓度。测定时用大鼠空白血浆将血浆样品按不同稀释倍数进行稀释。
取大鼠32只随机分为4组,每组8只,雌雄各半。按10 mg·kg-1剂量给大鼠静脉注射rhCNB,给药前取空白血浆,给药后0.25,1,2和8 h取血处死,立即解剖,采集脑、心、肝、脾、肺、肾、全胃、睾丸、卵巢、体脂、骨骼肌和胸腺等组织。采集的各组织用生理盐水洗净表面浮血,滤纸吸干,称重,置-20℃冷冻保存。测定前,将样品剪碎后置于高速匀浆器中,加入1×稀释液在冰浴中制成组织匀浆(心组织稀释倍数为1∶40,体脂0.25,1和2 h点稀释倍数为1∶30,肝、脾、肺和肾组织稀释倍数为1∶20,脑、全胃、睾丸、卵巢、体脂8 h点、骨骼肌和胸腺组织稀释倍数为1∶10),充分涡旋混匀,离心(4℃,2000×g离心10 min),取上清液,按1.2测定rhCNB浓度。
1.5 统计学分析
实验所得血药浓度数据用DAS3.0软件釆用非房室模型计算主要药动学参数。药动学参数使用SPSS 20.0软件进行统计分析,采用独立样本t检验对单次和多次给药所得的药动学数据进行显著性差异分析。
2 结果
2.1 方法学验证
2.1.1 选择性
对采集的12个组织进行选择性考察结果表明,12个组织定量上限≥80%的样品回收准确度在±20%范围内,定量下限≥80%的样品回收准确度在±25%范围内,且未加入分析物的组织空白匀浆液的测量值均低于定量下限,符合验证的要求。
2.1.2 线性范围
以标准品浓度为横坐标,以吸收值为纵坐标进行线性拟合并绘制标准曲线。肺组织直线回归方程为Y=19.1002X-0.1399,r=0.9987;胃组织直线回归方程为Y=31.5272X-0.2127,r=0.9917。表明肺和胃组织中rhCNB检测浓度的范围为1~16μg·L-1。
2.1.3 准确度和精密度
肺和胃组织匀浆样品的日内精密度和日间精密度均符合生物样品测定要求(表1),肺组织准确度在-22.5%~14.8%,胃组织准确度在-20.8%~25.0%之间,符合生物样品测定要求。
2.1.4 回收率
rhCNB在肺和胃组织中4和10 μg·L-1的回收率均在80%~110%范围内(表2),符合生物样品测定要求。
2.1.5 稳定性试验
肺和胃组织匀浆中rhCNB浓度在不同条件下均无显著变化(表3),表明组织样品在上述条件下稳定。
2.2 药-时曲线
多次给药组大鼠第4,5,6和7次给药前采血用ELISA测定谷浓度,结果均低于检测下限。
大鼠单次iv给予不同剂量rhCNB及多次给予rhCNB后,用ELISA检测血药浓度,得到大鼠体内药-时曲线(图1)。
2.3 药动学参数
rhCNB 5,10和20 mg·kg-1剂量组消除半衰期(t1/2)分别为0.95,0.85和0.91 h,统计学分析无显著性差异,提示rhCNB在体内是恒比消除,消除较快,呈一级动力学消除过程。
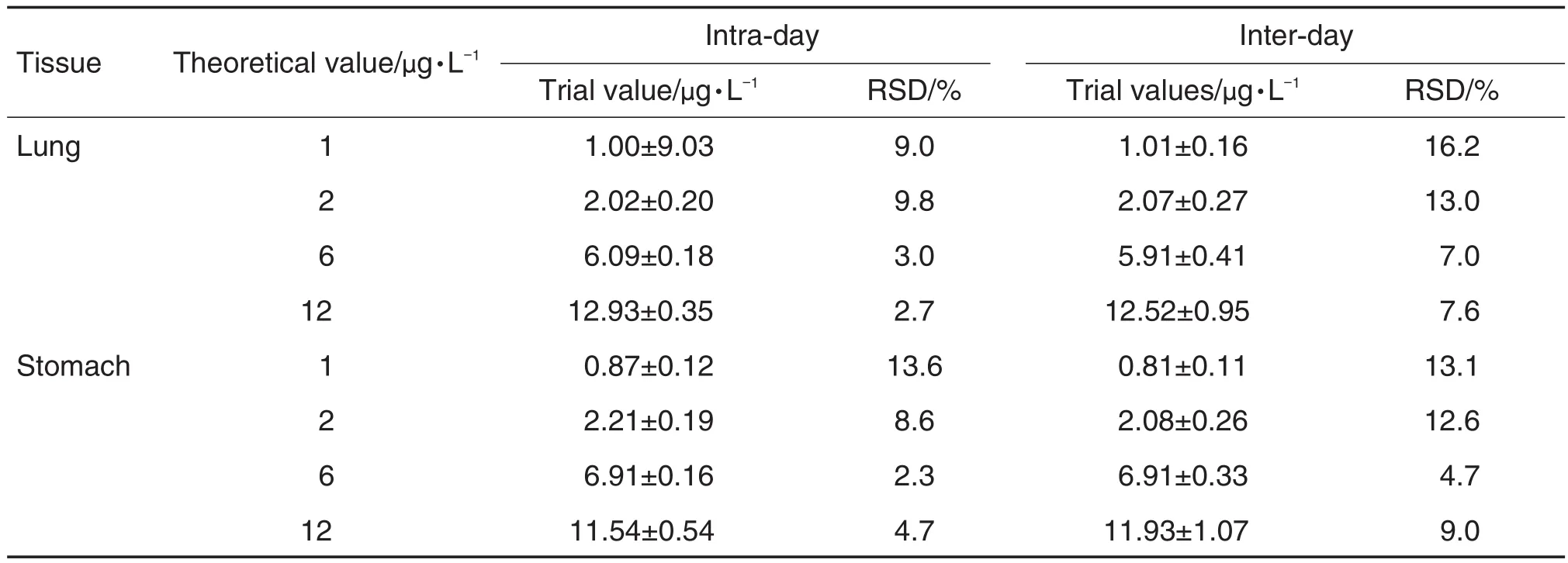
Tab.1 Precision of recombinant human calcineurin B subunit(rhCNB)in lung and stomach tissue of rats

Tab.2 Recovery of rhCNB in lung and stomach tissue of rats
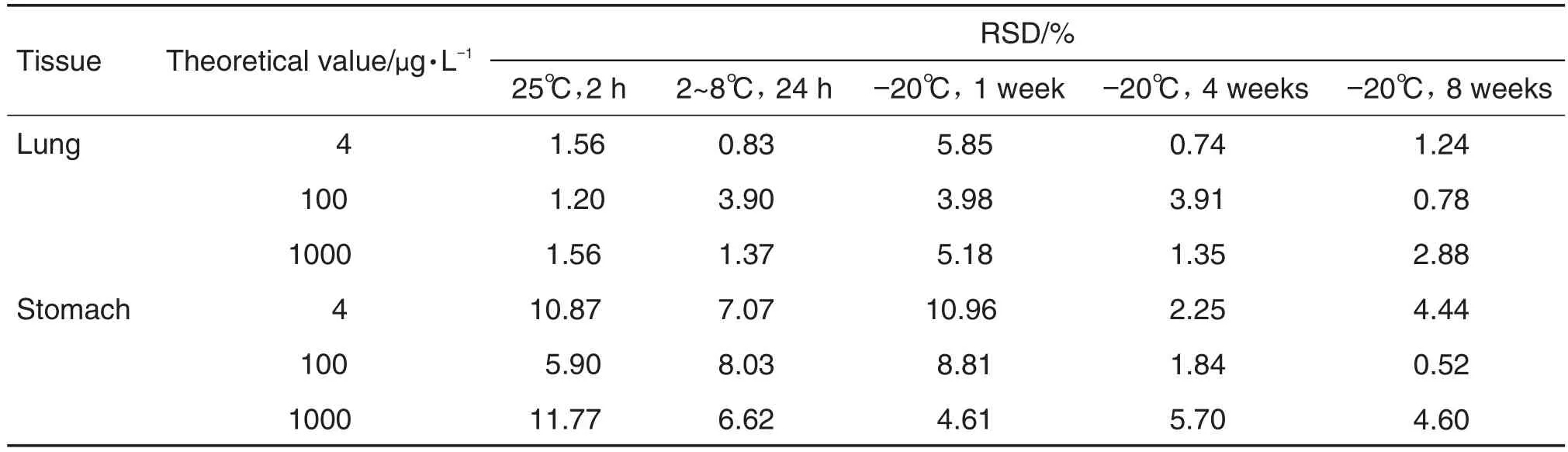
Tab.3 Stability of rhCNB in lung and stomach tissue of rats
rhCNB 5,10和20 mg·kg-1剂量组给药剂量比为1∶2∶4,AUC0-12h比值为1.0∶1.5∶3.7,药时曲线下面积与给药剂量成比例增加,表明在5~20 mg·kg-1剂量范围内,rhCNB在大鼠体内基本呈现线性动力学特征。
多次给药的主要药动学参数Cmax和AUC0-12h与单次给药比较无显著性差异,末次给药后AUC0-12h积累系数为0.63,提示rhCNB在大鼠体内无明显蓄积(表4)。
2.4 体内组织分布
SD大鼠尾静脉注射给予注射用rhCNB,给药0.25,1,2和8 h后麻醉腹主动脉采血,取组织,采用ELISA检测各个组织或器官内rhCNB浓度,得到12个组织或器官内rhCNB浓度(图2)。通过计算不同组织药物浓度或血浆药物浓度比,可看出不同组织中rhCNB的浓度分布由高到低的顺序为体脂>肺>肾>脾>睾丸/卵巢>心>肝>胸腺>胃>脑>骨骼肌。给药8 h后除肾有较高的浓度外,其他组织或器官的rhCNB含量均较低,说明rhCNB在SD大鼠体内无蓄积。
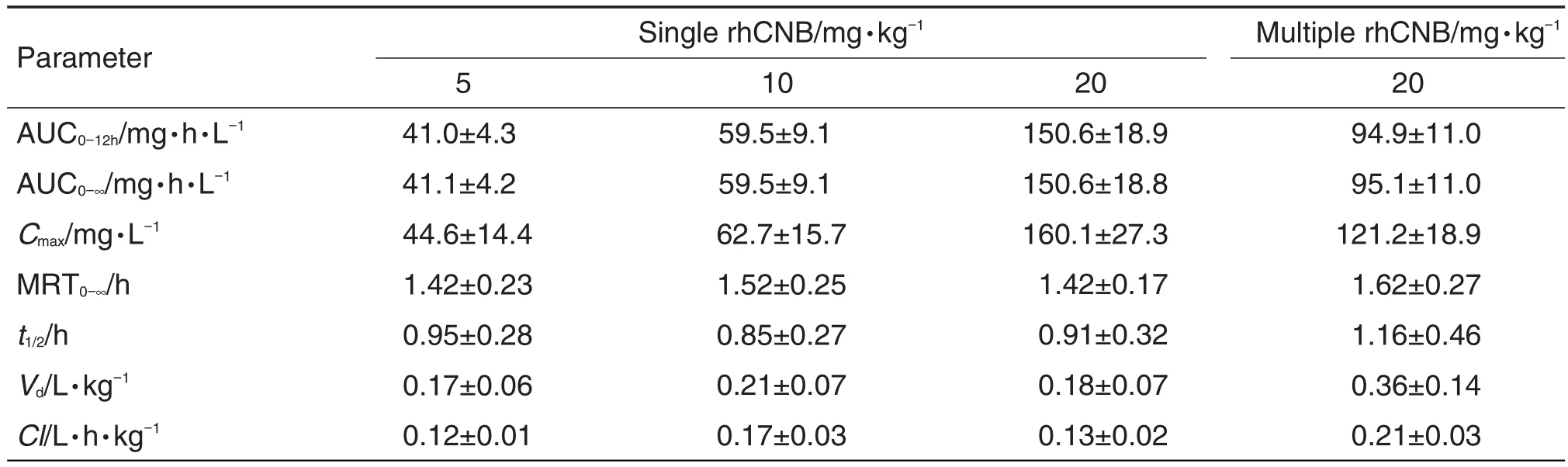
Tab.4 Pharmacokinetic parameters of rhCNB in rats after iv administration
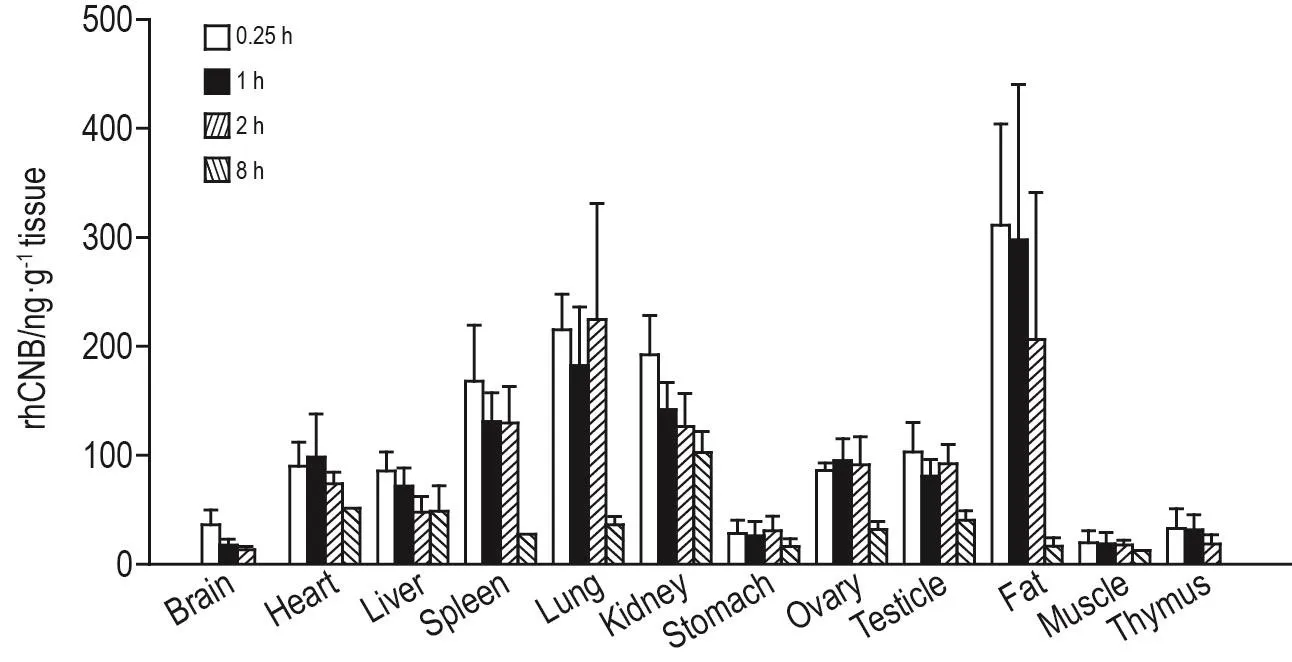
Fig.2 Tissue dynamic distribution of rhCNB in rats after iv administration.After administration of rhCNB,tissue samples were collected at 0.25,1,2 and 8 h.The samples were measured by ELISA.±s,n=8(n=4,ovary and testicle).
3 讨论
ELISA是生物技术药物药动学研究中最常用的免疫分析方法。用ELISA作为检测rhCNB在大鼠血药浓度的方法已经进行验证,其专属性、线性、精密度、准确度和稳定性等均符合验证可接受标准[13]。本研究采用ELISA检测rhCNB在大鼠组织样本中浓度进行方法学评价结果表明,各组织中内源性物质均不干扰rhCNB的测定,方法选择性好;在1~16 μg·L-1的线性范围内,线性关系良好;3个质控浓度的日内和日间精密度均<15.0%,有良好的精密度;回收率在80%~110%范围内。表明该方法选择性、线性范围、准确度、精密度、回收率和稳定性等均符合验证可接受标准,能够快速、灵敏、准确地对组织样品中的rhCNB进行定量检测。
单次给药rhCNB 5,10和20 mg·kg-1剂量组rhCNBt1/2分别为0.95,0.85和0.91 h,3个剂量组接近,提示rhCNB在大鼠体内消除较快,呈一级动力学恒比消除,线性动力学特征。rhCNB在体内t1/2约1.0 h,与注射用重组人白细胞介素2(t1/2为85 min)相似,临床上通过静脉点滴延迟给药时间来维持临床治疗作用[14]。
多次给予rhCNB 20 mg·kg-1后,rhCNBCmax和AUC0-12h均较首次给药后降低,表明多次给药后药物暴露量降低,本课题组前期研究发现,大鼠体内有rhCNB抗体产生(待发表),考虑多次给药后血药浓度下降可能是由于一方面体内抗体的产生导致rhCNB在体内的消除增加,另一方面体内rhCNB抗体影响了ELISA检测结果造成的。因大鼠与人之间存在种属差异,这种差异决定了人用重组蛋白与实验动物体内的同源蛋白存在不同程度的序列和构象差异,大鼠体内多次给药后出现暴露量降低,而在人体内是否会出现此现象还需进一步验证[15]。组织分布结果显示,大鼠静脉给予rhCNB后,在12个组织中均可测得,rhCNB在体脂、肺、肾、脾等组织的分布较高,在脑、胃、肌肉和胸腺的分布较低。给药8 h后仅肾有较高的浓度,表明rhCNB是部分经肾小球滤过进行消除。
综上所述,本研究为rhCNB在体内药动学和组织分布研究提供了可靠的定量检测方法,阐明了rhCNB单次和多次给药在大鼠体内的药动学特征,为临床试验给药方案提供参考。

