孕康口服液对环磷酰胺诱导大鼠卵巢早衰的改善作用及其机制
夏 伟,刘学武,王小青,姜德建,李欣荣
(1.湖南省药物安全评价研究中心,湖南省新药药效与安全性评价重点实验室,湖南 长沙 410331;2.复旦大学附属妇产科医院,上海 200011)
卵巢早衰指发生在40岁以前女性因环境、心理和疾病等因素造成的卵巢功能衰竭,其主要表现为生殖器官萎缩退化,并伴有雌激素(estrogenic hormone,E2)低下,促卵泡激素(follicle stimulating hormone,FSH)升高,严重影响女性正常生活与工作[1-2]。卵巢早衰病因复杂,确切发病机制尚不明确,通过调节激素水平能改善卵巢早衰的临床症状,但长期使用激素副作用大[3]。孕康口服液(Yunkang oral solution,YKos)主要有山药、断续、黄芪和当归等,具有健脾固本、养血安胎之功效。临床应用表明,YKos可治疗黄体功能不全,具有显著的助孕疗效,其机制与调节激素水平有关[4]。本研究通过环磷酰胺(cyclophosphamide,CTX)诱导雌性大鼠卵巢早衰模型,观察YKos对卵巢早衰的改善作用,并初步探讨其作用机制。
1 材料与方法
1.1 实验动物、药品、试剂和主要仪器
SPF级SD大鼠168只,雌性108只,体质量200~240 g,雄性60只,体质量300~350 g,湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2016-0002;饲养于湖南省药物安全评价研究中心屏障环境,使用许可证号:SYXK(湘)2015-0016。本研究获得动物伦理委员会的许可〔编号IACUC-2018(3)019〕,所有大鼠均在麻醉状态下安乐死。
YKos(国药准字Z10920062,批号:180501),江西济民可信药业有限公司;黄体酮软胶囊(国药准字H20040982,批号:180103),浙江医药股份有限公司新昌制药厂;注射用CTX(每瓶0.2 g,批号:18032225),江苏盟迪医药有限公司。大鼠E2 ELISA试剂盒(批号:RA20666)和FSH ELISA试剂盒(批号:RA20044),中国Bio-swamp公司;兔抗大鼠促性腺激素释放激素受体(gonadotropinreleasing hormone receptor,GnRHR)多抗(货号:19950-1-AP)、兔抗大鼠FSH受体(FSH receptor,FSHR)多抗(货号:22665-1-AP)、兔抗小鼠β肌动蛋白单抗(货号:60008-1-Ig)和HRP标记的山羊抗兔IgG抗体,美国Proteintech公司。SpectiaMax i3x型多功能酶标仪,奥地利美股光子公司;DFC 420C病理成像系统、RM2235型石蜡切片机、TP1020型全自动脱水机、HI1210型摊片机、HI1220型烤片机、EG1150H+C型组织包埋机和DM2000型生物显微镜,德国Leica公司;PL203电子天平,中国梅特勒-托利多仪器有限公司;Power Pac TM Basic电泳仪,美国Bio-Rad公司;JY04S-3C凝胶成像分析系统,北京君意东方公司。
1.3 动物分组、模型制备和给药
将108只雌性大鼠随机分为6组,每组18只,分别为正常对照组、CTX模型组、黄体酮软胶囊(18 mg·kg-1)(阳性对照)组及YKos 2.5,5.0和10.0 mL·kg-1组。除正常对照组外,其余各组单次ip给予CTX 100 mg·kg-1,制备大鼠卵巢早衰模型,正常对照组ip相应体积的生理盐水。于造模当天开始,黄体酮软胶囊组(每日给药前用纯水将黄体酮软胶囊配制成1.8 g·L-1药液)和YKos 3个剂量组(每日给药前用纯水将YKos原液配制成浓度为0.25和0.50 L·L-1药液)以10.0 mL·kg-1ig给予大鼠(药液或原液),每天1次,连续28 d。正常对照组和CTX模型组每天ig给予相应体积的蒸馏水。
1.4 卵巢和子宫系数的测定
末次给药前记录大鼠体质量。各组随机取8只雌性大鼠,安乐死后立即取出卵巢和子宫,剔除脂肪和结缔组织后称重,计算卵巢和子宫系数。卵巢(子宫)系数=卵巢(子宫)湿量(g)/体质量(g)×100。
1.5 HE染色观察卵巢和子宫组织病理变化
将大鼠的右侧卵巢和子宫组织用浓度为4%多聚甲醛溶液固定,经脱水、透明化、石蜡包埋和切片处理后,HE染色,光学显微镜下观察卵巢和子宫组织病理变化。卵巢病理评分标准:0分,卵泡形态无异常,卵巢颗粒细胞层多,排列整齐;1分,卵泡形态无明显异常,卵巢颗粒细胞层较少,排列较混乱;2,卵泡形态变小,卵巢颗粒细胞层明显减少,且颗粒细胞排列紊乱;3分,卵巢萎缩,无卵巢颗粒细胞或较少。子宫病理评分标准:0分,子宫壁厚度无异常,且无炎症细胞浸润;1分,子宫壁厚度略减小,子宫内膜少量炎症细胞浸润;2分,子宫壁厚度变小,子宫内膜炎症细胞浸润;3分,子宫壁厚度明显减小,炎症细胞大量浸润。
1.6 ELlSA法测定大鼠血清E2和FSH水平
末次给药后次日,腹主动脉采血,室温静置30 min后,以1650×g离心10 min取上清,参照试剂盒说明书操作,测定大鼠血清中E2和FSH水平。
1.7 Western印迹法测定大鼠卵巢组织GnRHR和FSHR表达水平
左侧卵巢组织匀浆后,加入RIPA裂解液提取卵巢总蛋白,采用BCA法进行蛋白质定量。随后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转至聚偏二氟乙烯(PVDF)膜上,以5%的脱脂奶粉封闭1.5 h;随后TBST漂洗3次,用一抗(抗GnRHR,1∶2000;抗FSHR,1∶2000)与PVDF膜结合,4℃孵育过夜;TBST洗3次,室温孵育HRP标记的山羊抗兔IgG抗体(二抗)(1∶20000)90 min;TBST漂洗3次,ECL化学发光法曝光拍照扫描,用Quantity One软件分析卵巢组织中GnRHR和FSHR蛋白条带的积分吸光度(integrated absorbance,IA),以待测蛋白IA/内参β肌动蛋白IA比值表示待测蛋白的相对表达水平。
1.8 雌性大鼠生育力和胎仔发育的测定
各组剩余的10只雌性大鼠与正常雄性大鼠按雄∶雌=1∶1合笼交配,14 d后,各组大鼠安乐死,取出子宫,观察记录各组雌性大鼠总着床数、活胎数、死胎数和吸收胎数,计算活胎率、死胎率和吸收胎率。活胎率(%)=活胎数/着床数×100%,死胎率(%)=死胎数/着床数×100%,吸收胎率(%)=吸收胎数/着床数×100%。
1.9 统计学分析
实验结果数据用±s表示,用SPSS16.0软件进行统计学分析。组间显著性差异比较采用单因素方差分析(one way ANOVA);方差齐性者组间比较采用LSD检验,不满足方差齐性者采用TamhaneT2检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 YKos对卵巢早衰模型大鼠卵巢和子宫系数的影响
与正常对照组比较,CTX模型组大鼠卵巢和子宫系数明显降低(P<0.01);与CTX模型组比较,YKos 2.5,5.0和10.0 mL·kg-1组大鼠卵巢系数显著升高(P<0.01),5.0和10.0 mL·kg-1组子宫系数显著升高(P<0.01);黄体酮胶囊组卵巢和子宫系数均显著升高(P<0.01)(表1)。
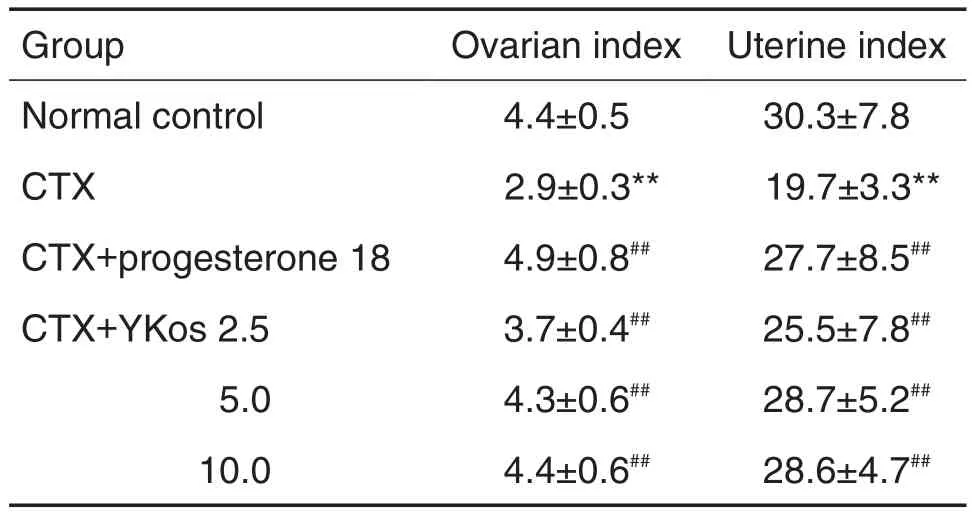
Tab.1 Effect of Yunkang oral solution(YKos)on ovarian index and uterine index of rats with cyclophosphamide(CTX)-induced premature ovarian failure
2.2 YKos对卵巢早衰模型大鼠卵巢和子宫组织病理改变的影响
图1和图2可见,正常对照组光镜下观察卵泡成长过程活跃,可见较多各级卵泡,闭锁细胞较少,黄体发育好,体积大,黄体细胞丰富。与正常对照组比较,CTX模型组卵巢体积萎缩,各级卵泡少见,闭锁卵泡增多,卵泡内颗粒细胞层数较其余各组明显减少,颗粒细胞排列紊乱;子宫内膜变薄,内膜上皮细胞排列紊乱,腺体减少,腺腔变小,基质稀疏水肿,可见嗜酸性粒细胞浸润,且组织病理评分显著降低(P<0.01)。与CTX模型组比较,YKos 2.5,5.0和10.0 mL·kg-1组大鼠卵巢中闭锁卵泡显著减少,卵泡内颗粒细胞层数显著增多;子宫膜增厚,嗜酸性粒细胞浸润减少,病理评分显著升高(P<0.05,P<0.01)。黄体酮胶囊组可见各级卵泡发育较正常,可见卵泡内母细胞大而圆,卵泡液丰富,轮廓清晰,颗粒细胞层数增多,排列整齐,病理评分显著升高(P<0.05)(表2)。
2.3 YKos对卵巢早衰模型大鼠血清E2和FSH水平的影响
与正常对照组比较,CTX模型组大鼠血清E2含量显著降低(P<0.01),FSH含量显著升高(P<0.01);与CTX模型组比较,YKos 5.0和10.0 mL·kg-1组大鼠E2含量显著升高(P<0.05,P<0.01),FSH水平显著降低(P<0.01);黄体酮胶囊组大鼠E2含量显著升高(P<0.05),FSH水平显著降低(P<0.05)(表3)。
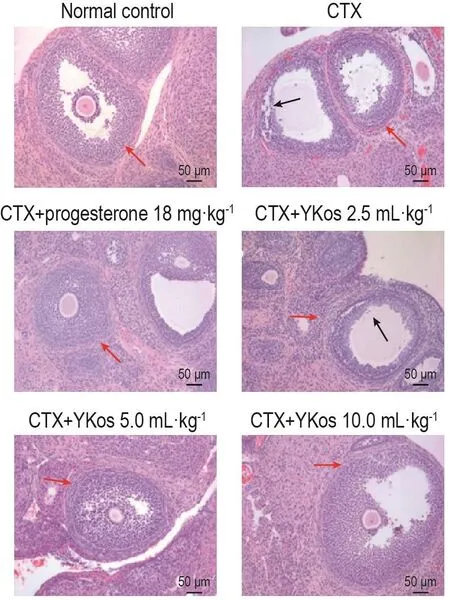
Fig.1 Effect of YKos on histopathological changes in ovarian tissues of rats with CTX-induced premature ovarian failure(HE staining).See Tab.1 for the rat treatment.The black arrow indicates ovarian granulosa cells.The red arrow indicates follicles.
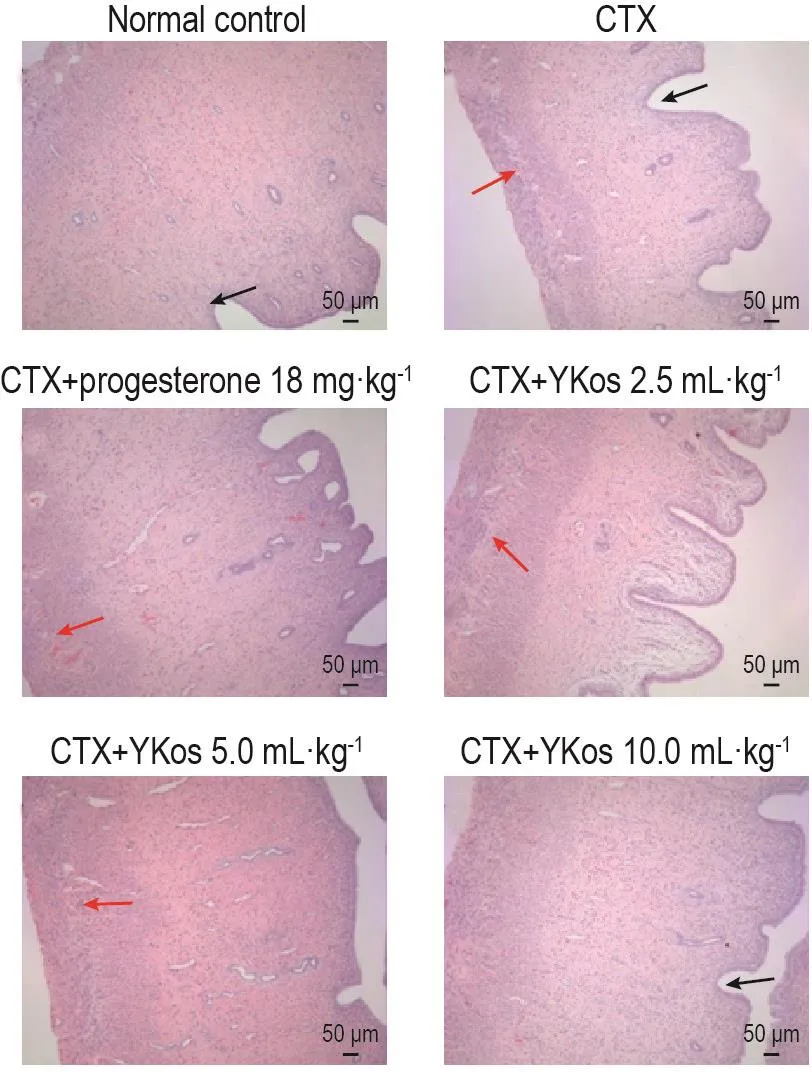
Fig.2 Effect of YKos on histopathological changes in uterine tissues of rats with CTX-induced premature ovarian failure(HE staining).See Tab.1 for the rat treatment.The black arrow indicates the endometrial thickness.The red arrow indicates eosinophil infiltration.
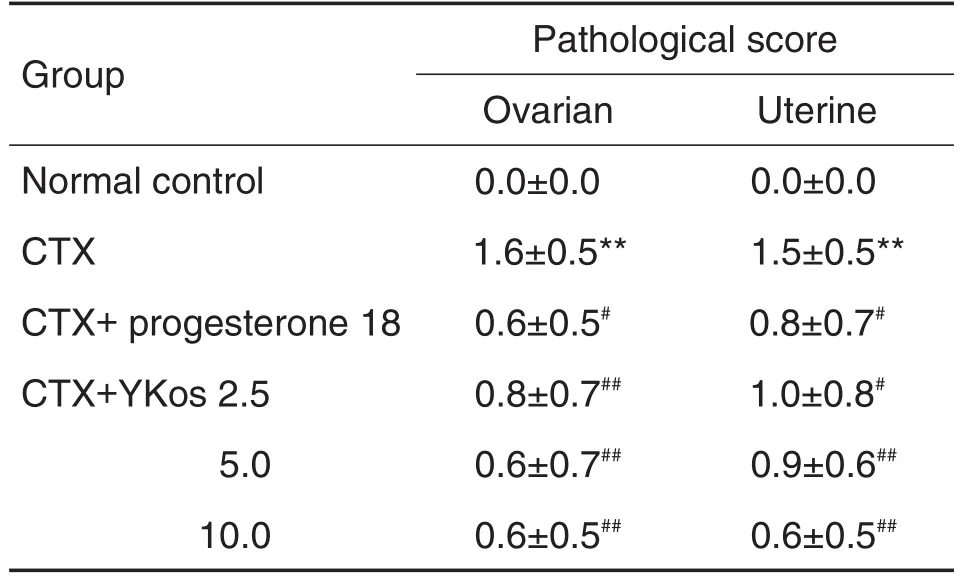
Tab.2 Effect of YKos on pathological scores of ovaries and uterus of rats with CTX-induced premature ovarian failure
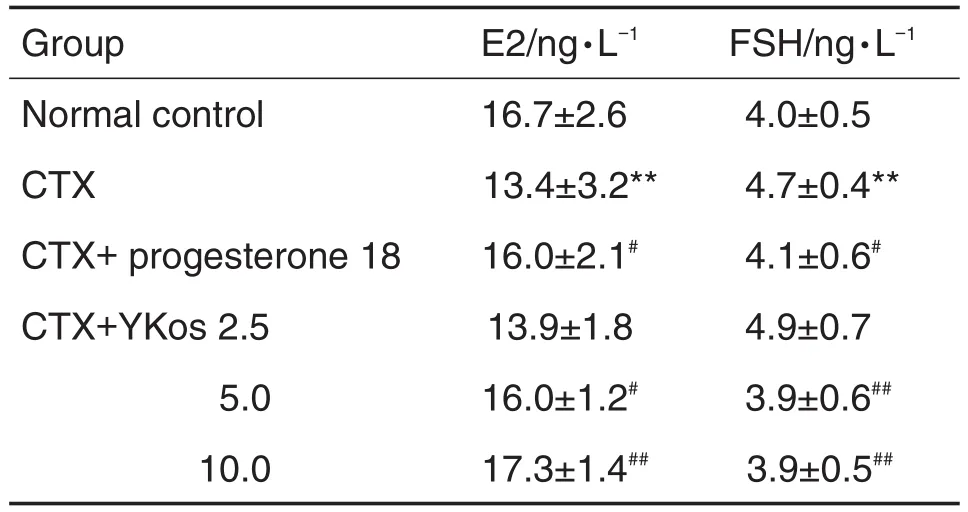
Tab.3 Effect of YKos on serum estrogen(E2)and follicle stimulating hormone(FSH)content of rats with CTX-induced premature ovarian failure
2.4 YKos对卵巢早衰模型大鼠卵巢组织GnRHR和FSHR蛋白表达的影响
Western印迹法检测结果显示,与正常对照组比较,CTX模型组卵巢组织GnRHR和FSHR蛋白表达水平均显著下降(P<0.01);与CTX模型组相比较,YKos 2.5,5.0和 10.0 mL·kg-1组 GnRHR 和FSHR表达水平均显著增强(P<0.01);黄体酮胶囊组GnRHR和FSHR蛋白表达水平均显著上升(P<0.01)(图3)。

Fig.3 Effect of YKos on protein expressions of gonadotropin-releasing hormone receptor(GnRHR)and FSH receptor(FSHR)of rats with CTX-induced premature ovarian failure.See Tab.1 for the rat treatment.B was the semiquantitative result of A.IA:integrated absorbance.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with CTX group.
2.5 YKos对卵巢早衰模型大鼠生育力和胚仔发育的影响
与正常对照组比较,CTX模型组受孕大鼠平均黄体数、平均着床数和活胎率均显著降低(P<0.01),死胎率和吸收胎率显著上升(P<0.05,P<0.01);与 CTX 模型组比较,YKos 2.5,5.0和10.0 mL·kg-1组及黄体酮胶囊组平均黄体数、平均着床数和活胎率均显著升高(P<0.01),YKos 2.5和5.0 mL·kg-1组及黄体酮胶囊组死胎率和吸收胎率显著下降(P<0.05,P<0.01),YKos 10 mL·kg-1组吸收胎率显著降低(P<0.01)(表4)。
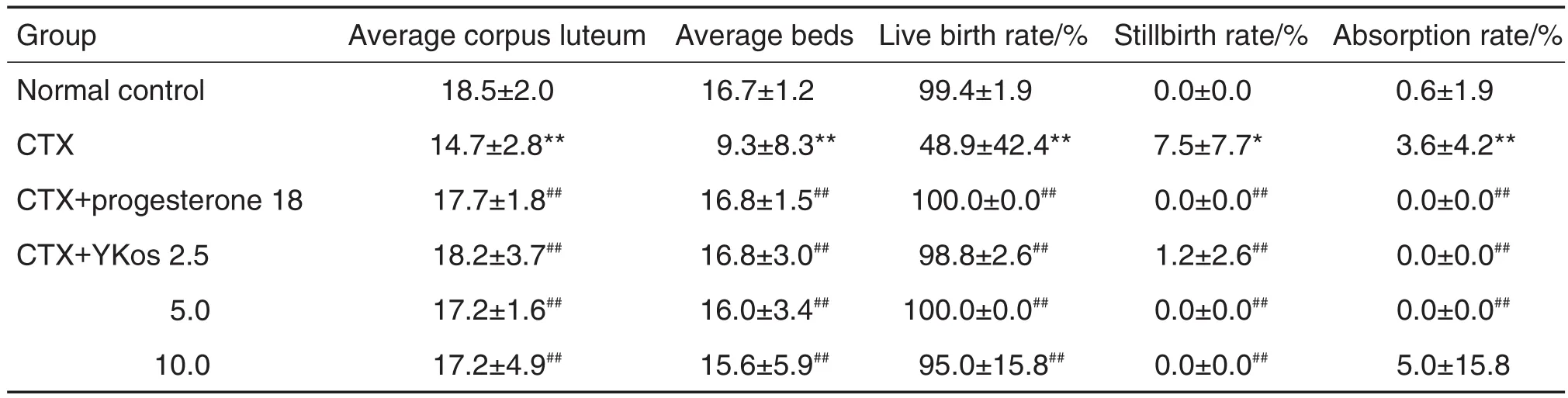
Tab.4 Effect of YKos on fertility of rats with CTX-induced premature ovarian failure
3 讨论
卵巢早衰发病原因主要是原始卵泡储备过少,卵泡闭锁或者耗竭[5]。本研究采用CTX制备卵巢早衰大鼠模型,发现CTX模型组大鼠卵巢明显萎缩,光镜下观察各级卵泡明显减少,闭锁卵泡增多,提示造模成功。
YKos临床日用量为60 mL,按体表系数折算到大鼠的等效剂量为5.4 mL·kg-1,本研究雌性大鼠ip给予CTX后,给予YKos 2.5,5.0和10.0 mL·kg-1治疗。与CTX模型组比较,YKos 2.5,5.0和10.0 mL·kg-1组大鼠卵巢系数明显升高,光镜下各级卵泡数目增多,闭锁卵泡明显减少,颗粒细胞数增多,且子宫病理改变明显改善,说明YKos可促进卵泡生长。
体内E2和FSH水平是评价卵巢功能的重要指标,基础FSH水平升高会降低卵巢储备功能,E2水平低下会导致卵巢分泌功能不良[6-7]。本研究结果显示,CTX模型组血清E2水平明显降低,FSH水平明显升高;与CTX模型组比较,YKos组E2水平明显升高,FSH水平明显下降,提示YKos可改善卵巢功能。与CTX模型组比较,YKos组平均黄体数、平均着床数及活胎率明显升高,且死胎率和吸收胎率明显降低,表明YKos可改善雌性大鼠的生育能力。
GnRHR是介导GnRH功能不可或缺的物质,主要在次级卵泡、窦卵泡和排卵前颗粒细胞中阳性表达,GnRH通过结合促性腺细胞中特异性极高的GnRHR,进而调节和控制卵泡成熟和激素的生成[8]。FSHR主要分布在卵泡表面,通过与垂体分泌的FSH结合从而发挥调节卵泡发育的作用[9-11]。本研究结果显示,CTX模型组雌性大鼠卵巢中GnRHR和FSHR蛋白表达明显降低,这可能与CTX破坏了卵巢中卵泡结构,并使颗粒细胞明显减少有关。与CTX模型组比较,YKos组GnRHR和FSHR蛋白表达明显上升,提示YKos可上调卵巢早衰大鼠卵巢中GnRHR和FSHR的表达,进而缓解卵巢中激素异常状况,维持卵巢正常的生殖功能。
综上所述,YKos可有效修复CTX诱导的雌性大鼠生殖系统损伤,恢复卵巢功能,其作用机制可能与调节GnRHR-FSHR信号通路有关。

