吉西他滨和髓细胞白血病基因1小干扰RNA纳米药物的制备和表征
王艳冰,程佳禾,高锋华,蒋兴伟,窦向梅,于 群
(1.军事科学院军事医学研究院卫生勤务与血液研究所,北京 100850;2.沈阳药科大学生命科学与生物制药学院,辽宁 沈阳 110016;3.College of Letters and Science,University of California,Berkeley,CA 94720,USA;4.北京市十一学校,北京 100039)
胰腺癌是常见的消化道恶性肿瘤,在癌症死亡原因中位列第7[1]。吉西他滨(gemcitabine,Gem,2,2-二氟脱氧胞苷)作为20世纪90年代美国食品药品监督管理局(Food and Drug Administration,FDA)批准的治疗胰腺癌的一线药物,能明显改善患者的生活质量并延长生存期,被誉为胰腺癌治疗的金标准[2]。虽然术后辅以Gem和其他细胞毒性药物联合化疗,可将胰腺癌患者的5年生存率提高到30%,但中位生存期仅为26个月[3]。因此,迫切需要探索更加有效的治疗方案。
髓细胞白血病基因1(myeloid cell leukemia-1,MCL-1)是BCL-2家族成员中功能独特的一个分子,参与抗细胞凋亡和线粒体呼吸,为胚胎发育和成人多细胞系生存所必需[4-5]。MCL-1在胰腺癌等多种肿瘤中表达异常升高,可促进肿瘤细胞的恶性生长和耐药性产生,是肿瘤治疗理想的分子靶标。本研究集体前期研究发现,通过小干扰RNA(small interference RNA,siRNA)选择性地降低胰腺癌细胞的MCL-1基因表达,不仅可以直接抑制肿瘤生长,还可以显著提高胰腺癌对化疗药物的敏感性[6-7]。但是裸露的siRNA在血液循环中很容易降解,半衰期很短(<1 h),到达肿瘤组织的少量siRNA则因为高亲水性、大分子质量和负电荷,很难穿过细胞膜进入细胞。采用纳米技术包裹MCL-1siRNA(siMCL-1)和Gem,制成纳米药物则有可能克服该障碍。
用于siRNA体内递送的脂质体和聚合物具有负载量大、可修饰性强、细胞毒性低和便于保存等优势,已经用于制成纳米药物,并被批准用于临床试验和临床治疗[8]。本研究采用一种磷脂-聚合物混合型纳米载体磷脂双分子层覆盖的ε-多聚赖氨酸改性的单甲氧聚乙二醇-羟基乙酸〔monomethoxy poly(ethylenecol)-poly(lactic-co-glycolic acid),mPEG-PLGA〕共聚物(lipid bilayer coated ε-polylysine-modified mPEG-PLGA nanoparticles,LENP)制备治疗胰腺癌的纳米药物LENP-Gem-siMCL-1,包括装载化疗药物Gem和吸附siMCL-1的聚合物核心、覆盖在聚合物核心外面的磷脂双分子层以及最外层的聚乙二醇(polyethylene glycol,PEG)表面修饰,并对制备的纳米药物LENP-Gem-siMCL-1进行系统的特性表征和体外抗肿瘤活性检测,为临床治疗胰腺癌提供实验基础。
1 材料与方法
1.1 细胞、试剂和仪器
人胰腺癌BxPC-3和PANC-1细胞购自美国模式培养物集存库(American Type Culture Collection),用含10%胎牛血清的DMEM完全培养基,于5%CO2,37℃培养箱中培养。
我们前期优化的siMCL-1(5’-CCAAGAAAGCUGCAUCGAA-3’)和非特异性阴性对照siRNA(siControl)[7]以及羧基荧光素FAM标记的siMCL-1(FAM-siMCL-1)由上海生工生物技术公司合成。Gem和胆固醇购自美国Sigma Aldrich公司;mPEG-PLGA购自济南岱罡生物科技有限公司;ε-多聚赖氨酸购自郑州拜纳佛生物工程股份有限公司;聚乙烯醇(polyvinyl alcohol,PVA)和卵磷脂购自北京百灵威化学技术有限公司;二硬脂酰基磷脂酰乙醇胺-甲氧聚乙二醇-2000〔distearoylphosphoethanolamine-methoxy(polyethylene glycol)-2000,DSPE-PEG-2000〕购自西安瑞禧生物科技有限公司;DMEM培养基、Opti-MEM培养基和胎牛血清购自美国Gibco BRL公司;溶酶体染料LysoTracker Red和细胞核染料4′,6-二脒基-2-苯基吲哚(DAPI)购自美国Invitrogen公司;BCA蛋白质定量试剂盒购自美国Thermo Fisher公司;兔抗人MCL-1单抗和兔抗人α微管蛋白抗体单抗购自美国Cell Signaling公司;Odyssey标记羊抗兔IgG抗体(二抗)购自美国LI-COR生物公司。
纳米粒度及Zeta电位分析仪(英国马尔文仪器有限公司);透射电子显微镜(美国FEI公司);高效液相色谱UPLC1290(美国Agilent公司);TiA1激光倒置共聚焦显微镜(日本NIKON公司);蛋白电泳仪(美国Bio-Rad公司);Odyssey®CLx显像系统(美国Lincoln公司);二氧化碳细胞培养箱和MK3酶标仪(美国Thermo公司)。
1.2 LENP-Gem-siRNA的制备
LENP纳米载体由一个阳离子聚合物核心ENP和表面覆盖的PEG化的磷脂双分子层组成[9]。第一步,采用改良的复乳法制备阳离子聚合物核心ENP-Gem-siRNA:称取mPEG-PLGA溶解在1 mL二氯甲烷中,加入Gem水溶液0.2 mL,用细胞破碎仪超声乳化,然后在乳液中加入2%PVA水溶液2 mL和一定量的ε-多聚赖氨酸(ε-多聚赖氨酸和mPEG-PLGA的质量比为2.5∶1)进行第2次超声乳化。得到的乳液滴加到10 mL 0.6%PVA中,用旋转蒸发仪去除有机试剂二氯甲烷。离心,将沉淀重新分散在去离子水中,即可获得ENP-Gem。然后加入无RNA酶去离子水溶解的siRNA(siMCL-1或者siControl),通过静电吸附作用将带有负电荷的siRNA吸附在表面,离心,将纳米颗粒重新分散在去离子水中,得到负载Gem和siRNA的阳离子聚合物核心ENP-Gem-siRNA。第二步,通过超声薄膜法进行ENP表面的磷脂层自组装:将卵磷脂、胆固醇、DSPE-PEG-2000按照60∶15∶12的质量比溶于二氯甲烷,置于圆底烧瓶,用旋转蒸发仪将有机试剂旋蒸去除,在瓶壁形成一层致密的磷脂双分子层薄膜。将ENP-Gem-siRNA加入上述带有磷脂双分子层薄膜的圆底烧瓶,在超声辅助下使磷脂双分子层薄膜组装到纳米颗粒的表面,制备成负载Gem和siRNA的磷脂-阳离子聚合物混合型纳米颗粒LENP-GemsiRNA。离心15 500×g,10 min,将纳米颗粒LENPGem-siRNA重新分散在去离子水中用于以下实验。
1.3 纳米粒度和Zeta电位分析仪测量纳米颗粒的粒径分布和表面电位
在纳米颗粒粒径分布和表面电位的测量中,采用组成近似但性质更稳定的DNA代替siRNA[9]。根据1.2制备ENP,ENP-Gem,ENP-Gem-DNA和LENP-Gem-DNA溶于去离子水,利用纳米粒度和Zeta电位分析仪,根据动态光散射(dynamic light scattering,DLS)法测量各纳米颗粒的粒径分布,激光源为波长为633 nm的He-Ne激光,固定散射角为90°。根据激光多普勒微量电泳法测量各纳米颗粒表面的Zeta电位,根据其变化对聚合物纳米颗粒的组装进行表征。以上测试均在25℃下进行。
1.4 透射电镜观察纳米颗粒的内部结构
取5 μL浓度为20 g·L-1的LENP,LENP-Gem或LENP-Gem-DNA乳液滴加在碳支撑膜的铜网上,常温干燥后用2%醋酸双氧铀溶液5 μL对样品进行负染色2次,每次5 min。常温干燥后,用透射电子显微镜观察这3种纳米颗粒的形貌,并测算其尺寸。
1.5 高效液相色谱(HPLC)测定LENP对Gem的包封率
新合成的LENP-Gem经15 500×g离心10 min后,取上清用于HPLC仪分析其中Gem的浓度。HPLC色谱柱为C18反相柱(20 mL,4.6 mm×150 mm),进样量为20 μL。Gem的吸收波长为270 nm,洗脱时间约为2 min。药物包封率(%)=(初始时加入的Gem质量-上清中未包载到LENP中的Gem质量)/初始时加入的Gem质量×100%,其中药物质量单位为mg。
1.6 共聚焦显微镜检测LENP对siRNA的输运作用
为了观察纳米载体能否将siRNA有效输运到细胞内,分别以绿色荧光素FAM和红色荧光染料LysoTracker Red标记siMCL-1和溶酶体。首先,在siMCL-1上修饰一个带有绿色荧光的基团(FAM),制备FAM-siMCL-1;再包载到LENP中制备LENP-FAM-siMCL-1。把胰腺癌细胞PANC-1接种入共聚焦显微镜专用皿,每孔1×105细胞。向细胞中加入LENP-FAM-siMCL-1(终浓度60 nmol·L-1),以未包载的裸FAM-siMCL-1作为对照,分别在37℃培养2和4 h。然后,加入红色荧光的溶酶体染料LysoTracker Red继续培养1 h;4%多聚甲醛固定,用DAPI将细胞核染成蓝色。通过激光共聚焦显微镜观察细胞对带绿色荧光siMCL-1的摄取及其细胞内定位,判断LENP能否将siRNA有效输运到胰腺癌细胞内。
1.7 Western印迹法检测PANC-1细胞MCL-1蛋白表达
将PANC-1细胞接种入6孔板,每孔3×105细胞,分为5组,分别加入裸siMCL-1、空纳米载体LENP、LENP-siControl和 LENP-siMCL-1处理,siControl和siMCL-1的终浓度是60 nmol·L-1,同时设生理盐水对照组。在Opti-MEM无血清培养基中37°C,5%CO2培养5 h,换成DMEM加10%胎牛血清完全培养基继续培养48 h后提取蛋白质。用BCA蛋白质定量试剂盒进行蛋白定量后,每组等量蛋白经过12%SDS-PAGE电泳分离,转移至PVDF膜上,封闭,洗膜,加入抗MCL-1或抗α-微管蛋白抗体(稀释比1∶1000)4°C孵育过夜;洗膜,加入荧光素标记的二抗(稀释比1∶2000)室温避光孵育1 h;最后在Odyssey®CLx显像系统下,用Gel-pro Analyzer软件检测蛋白条带积分吸光度(integrated absorbance,IA)值。MCL-1蛋白相对表达水平用IAMCL-1/IAα微管蛋白比值表示。
1.8 MTT法测定PANC-1和BxPC-3癌细胞存活率
将胰腺癌PANC-1和BxPC-3细胞接种入96孔板,分为6组。LENP组:空纳米载体对照;Gem组:单加Gem处理;Gem+siMCL-1组:Gem和裸露的siMCL-1联合处理;LENP-Gem组:纳米载体包裹Gem药物处理;LENP-Gem-siControl组:纳米载体包裹Gem和对照siControl处理;LENP-GemsiMCL-1组:纳米载体包裹Gem和siMCL-1处理。每组4复孔,siControl和siMCL-1的终浓度是60 nmol·L-1,Gem的终浓度为32 μmol·L-1。在Opti-MEM无血清培养基中37°C,5%CO2培养5 h,换成DMEM加10%胎牛血清完全培养基继续培养48 h,每孔加入 MTT(5 g·L-1)10 μL,4 h 后加入 10%SDS 100 μL溶解紫色结晶,2 h后利用酶标仪读570nm吸光度值(A570nm)。细胞存活率(%)=各组A570nm/LENP组A570nm×100%。
1.9 统计学分析
实验结果数据均以±s表示,用GraphPad Prism 6.0软件对数据进行统计学处理,组间比较采用单因素方差分析和t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 纳米颗粒粒径分布、Zeta电位、电镜结构和包封率的表征
为了确证在纳米药物合成过程中各组分是否进行了有效组装,对制备过程中的各纳米颗粒进行表征。如图1所示,DLS检测到纳米载体核心颗粒ENP的平均水合粒径为154.50 nm,依次包载Gem和DNA后,ENP-Gem和ENP-Gem-DNA的平均水合直径分别为183.54和191.00 nm;当核心颗粒表面覆盖了PEG化的磷脂双分子层,LENP-Gem-DNA的平均水合直径增至213.50 nm。相应地,采用激光多普勒微量电泳法测量这4种纳米颗粒表面的Zeta电位,ENP,ENP-Gem,ENP-Gem-DNA和LENP-Gem-DNA的表面电位分别为11.50,6.35,-12.60和-22.60 mV,提示在纳米药物LENP-GemsiMCL-1合成过程中各组分依次进行了有效的组装。
随后对LENP,LENP-Gem和LENP-Gem-DNA的内部结构进行了观察。在电子透射电镜下(图2),可以看到3种纳米颗粒为结构和大小分布均匀的球形粒子,具有典型的核壳结构。LENP的直径约190 nm,而LENP-Gem和LENP-Gem-DNA直径升至约210 nm,提示Gem和核酸成功包载。
通过HPLC对Gem的包载效率进行了检测。在紫外可见吸收光谱中,Gem吸收峰的波长为270 nm,将其设为HPLC检测Gem时的检测波长。如图3所示,LENP-Gem的色谱图具有Gem的特征峰,说明Gem被成功包载到了LENP中。其次,根据前期优化的mPEG-PLGA与Gem质量比,测量出初始时加入Gem 5 mg时,上清中未包载到纳米材料中的Gem质量为3.77 mg。LENP对Gem的包封率为24.6%。
2.2 LENP对siRNA的输运作用
如图4所示,LENP-FAM-SiMCL-1与PANC-1细胞在孵育2 h后,细胞内出现明显的红色和绿色荧光信号。4 h后细胞内的荧光强度逐渐增强,2种信号相互叠加形成橙色荧光。有的细胞中2种颜色的荧光则分离开来,提示siMCL-1已经从溶酶体逃逸出来并进入细胞质中。由此说明,LENP能够将siRNA有效输运至胰腺癌细胞内部,并且通过细胞内吞途径进入溶酶体中。

Fig.1 Size distribution of nanoparticles measured by dynamic light scattering (DLS).The nanoparticles were fabricated reproducibly by combining a double-emulsion method for polymer nanocore and ultrasound assisted self-assembly of a lipid film for lipid shell.The size distribution of four nanoparticles was measured by DLS equipped with a He-Ne laser beam at a wavelength of 633 nm and a fixed scattering angle of 90°。The average diameters of ENP(nanoparticle core,A),ENP-Gem[ENP encapsulated with gemcitabine(Gem),B],ENP-Gem-DNA(ENP encapsulated with Gem and DNA,C),and LENP-Gem-DNA(LENP encapsulated with Gem and DNA,D)were 154.50,183.54,191.00 and 213.50 nm,respectively.

Fig.2 Structure of nanoparticles observed by transmission electron microscopy(TEM).LENP(A),LENP-Gem(B)and LENP-Gem-DNA(C)(5 mL,20 g·L-1)were deposited onto a carbon-coated copper grid,respectively,negatively stained twice with 2% uranyl acetate solution,and viewed under TEM.
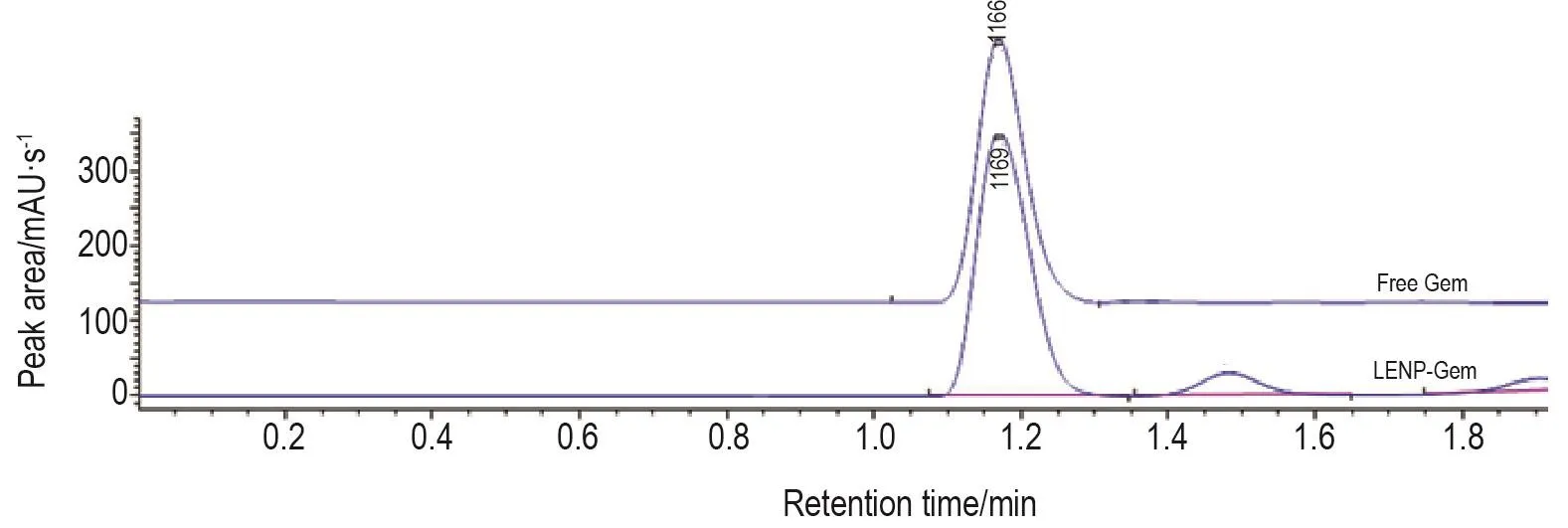
Fig.3 Gem in LENP-Gem measured by high performance liquid chromatography(HPLC).The synthesized LENPGem was centrifuged and the supernatant was collected for HPLC assay.The eluent was monitored at 270 nm for Gem.Upper peak:free Gem;lower peak:Gem in the supernatant of synthesized LENP-Gem.
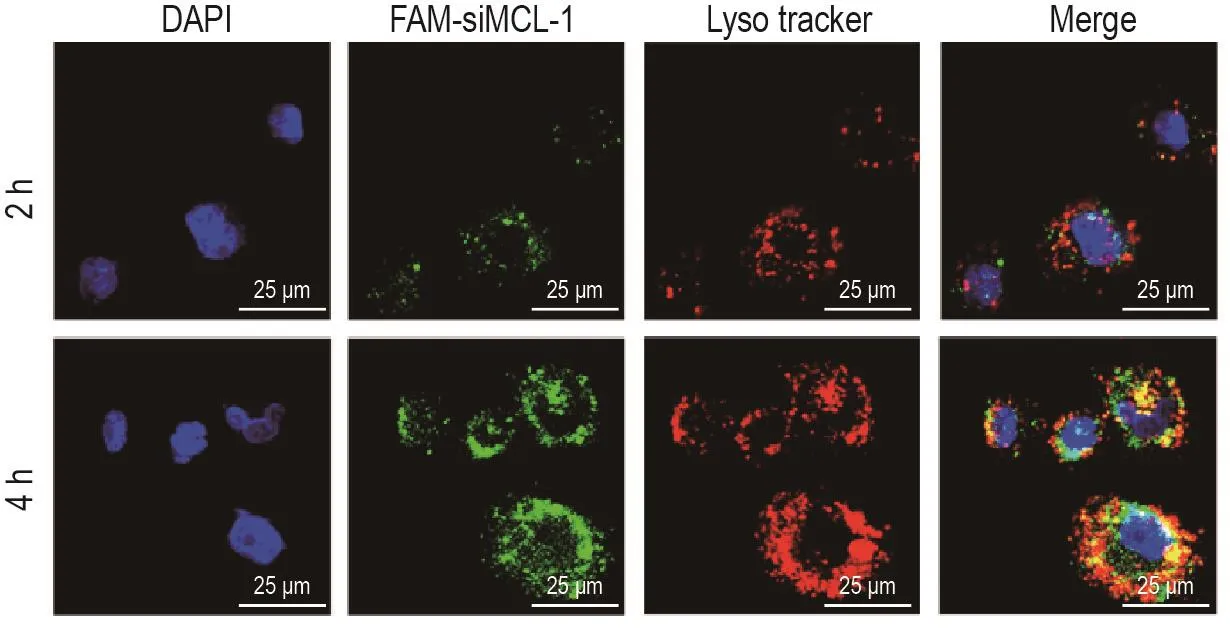
Fig.4 Transportation of siRNA into PANC-1 cells by nanoparticle LENP.PANC-1 cells were seeded at a density of 1×105 cells per well and incubated overnight.After being treated with LENP-FAM-SiMCL-1(green)for 2 or 4 h,the cells were stained with Lyso-Tracker Red(red)for another 70 min,fixed,stained nucleus with 4’6-diamidino-2-phenylindole(DAPI)(blue),and observed under a confocal laser-scanning microscope.
2.3 LENP-siMCL-1抑制胰腺癌细胞MCL-1蛋白表达
Western印迹结果(图5)所示,与LENP组(IA值为0.246)比较,LENP-siControl组PANC-1细胞MCL-1蛋白表达无明显变化,LENP-siMCL-1组MCL-1蛋白表达则显著降低至57.7%(IA值为0.142)。而裸siMCL-1组与生理盐水对照组(IA值为0.547)相比未发现明显下调。提示进入胰腺癌细胞内的siMCL-1能够特异性抑制MCL-1蛋白表达;如无LENP纳米载体辅助,裸siRNA很难通过被动扩散机制进入细胞发挥作用。
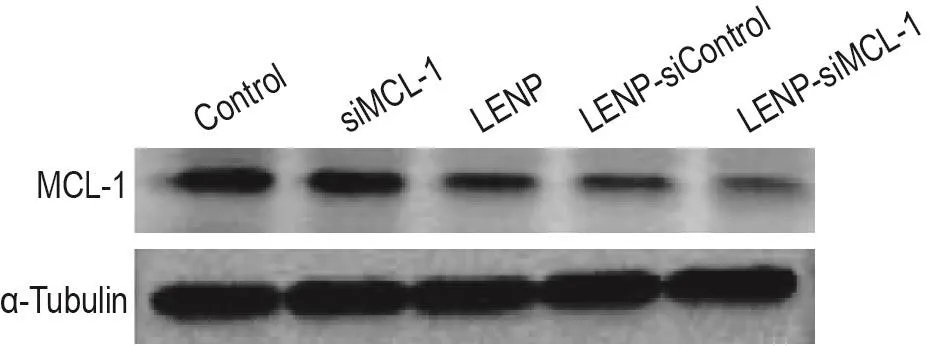
Fig.5 Knockdown of MCL-1 expression by LENP-siMCL-1 in PANC-1 cells assayed by Western blotting.PANC-1 cells were treated with saline,free siMCL-1,LENP,LENP-siControl or LENP-siMCL-1 for 6 h and incubated for another 48 h.
2.4 LENP-Gem-siMCL-1明显抑制胰腺癌细胞存活
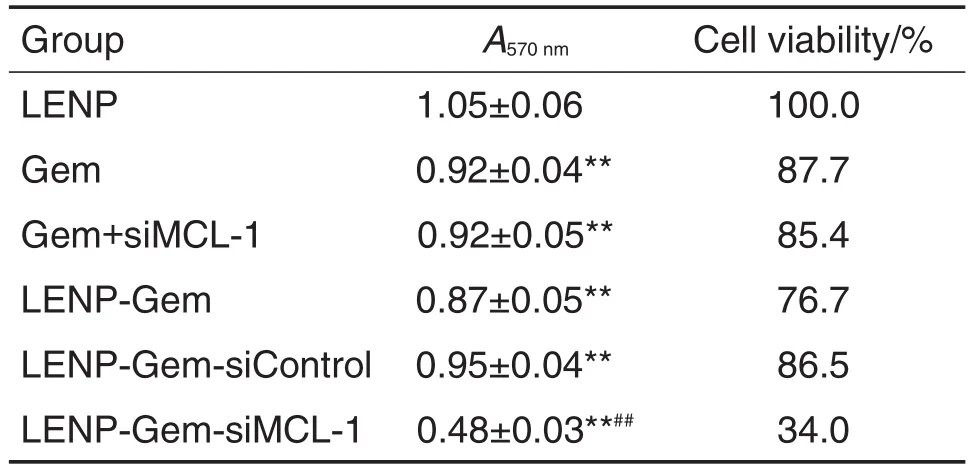
如表1所示,与LENP组比较,Gem,Gem+siMCL-1,LENP-Gem,LENP-Gem-siControl和LENP-Gem-siMCL-1组PANC-1细胞存活率均明显降低(P<0.01),LENP-Gem-siMCL-1组最低,为42.7%;与Gem组相比,Gem+siMCL-1组细胞存活率无显著性差异;LENP-Gem-siControl组与LENP-Gem组比较亦无明显变化;与LENP-GemsiControl组比较,LENP-Gem-siMCL-1组PANC-1细胞存活率进一步降低(P<0.01)。LENP-GemsiMCL-1对BxPC-3细胞存活的抑制作用与对PANC-1细胞的作用相似(表2)。由此提示,LENPGem-siMCL-1能够提高胰腺癌细胞对Gem的敏感性,增强Gem的细胞杀伤效应。
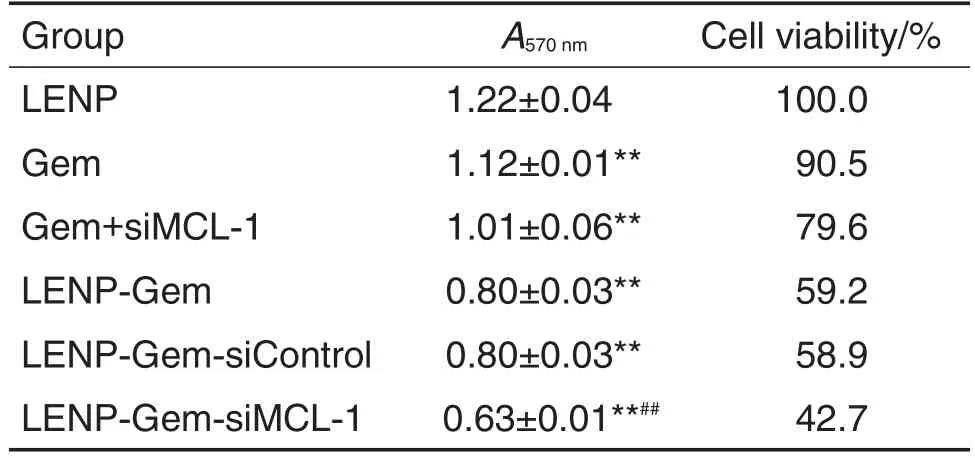
Tab.1 Viability of PANC-1 cells treated with LENPGem-siMCL-1
Tab.2 Viability of BxPC-3 cells treated with LENPGem-siMCL-1
3 讨论
目前纳米药物的研究进展非常迅速,因其独特的性质和优势而成为肿瘤治疗的热点,美国、加拿大和欧洲一些国家已经有纳米化疗药物上市。我国对纳米药物治疗肿瘤的研究也越来越受到重视,如紫杉醇脂质体治疗卵巢癌、多柔比星脂质体治疗艾滋病相关的卡波肉瘤等,已经进入临床使用[10-11]。除了作为传统化疗药物的载体,纳米载体在基因药物递送过程中也显示出巨大潜力,包括siRNA、反义核苷酸、信使RNA和DNA寡核苷酸抑制剂等,很大程度上提高了基因治疗的安全性[12-13]。用于siRNA体内递送的纳米载体主要有脂质体和聚合物两类,前者是最早被用作纳米载体的生物材料,通常由磷脂和胆固醇类构成,后者主要包括聚乙烯基吡啶、聚赖氨酸和聚乙烯亚胺等。阳离子聚合物和阳离子脂质体通过静电吸附作用可以有效地大量吸附带负电荷的siRNA。最近出现的新型磷脂-聚合物混合型纳米载体兼具二者的优势,显现出良好的临床应用前景[14-15]。
本研究正是采用了磷脂-聚合物混合型纳米载体LENP实现共同递送化疗药物Gem和siMCL-1。此设计具有3个突出的特点:①聚合物核心可以有效包载药物和吸附siRNA,为整个纳米颗粒提供优异的力学稳定性;②覆盖在聚合物核心外面的磷脂单分子或双分子层增强纳米颗粒的生物相容性,并将聚合物核心和外界隔离,避免药物分子的渗漏和水分子对聚合物核心的渗透,减缓聚合物分子的水解;③最外层的PEG表面修饰赋予了纳米颗粒“隐身”性质,减少血清蛋白吸附,避免网状内体系统对纳米颗粒的清除,利于纳米颗粒逃逸免疫清除,延长体内循环时间[16]。
纳米药物LENP-Gem-siMCL-1由一个阳离子聚合物核心和PEG化的磷脂双分子层构成。首先,通过复乳法合成mPEG-PLGA聚合物核心,在合成过程中掺入一定量的带有正电荷的ε-多聚赖氨酸,水溶性的Gem被包裹在亲水性内核,siMCL-1通过静电作用吸附在核心表面。然后通过薄膜超声法,在吸附siMCL-1的聚合物核心表面覆盖一个PEG化的磷脂双分子层,形成纳米颗粒的保护层,有助于更多纳米颗粒通过高通透性和滞留效应(enhanced permeability and retention effect,EPR)在肿瘤组织内靶向富集,并最终杀伤肿瘤细胞。本研究采用了4种方法对纳米药物LENP-Gem-siMCL-1进行表征和鉴定,即DLS测量纳米颗粒的粒径分布、激光多普勒微量电泳法测量纳米颗粒表面的Zeta电位、透射电镜观察纳米颗粒的结构和大小以及HPLC测量纳米颗粒中Gem的特征峰。结果表明,纳米药物符合设计要求,粒径约200 nm,大小均一,表面带有负电荷,并且能够有效包载Gem和siMCL-1。
纳米药物和普通药物相比具有截然不同的体内性质,其中最突出的优势是具有治疗肿瘤的被动靶向效应[8]。由于肿瘤细胞新生内皮细胞不连续性,粒径约200 nm的粒子可以通过血管壁进入组织间隙。研究表明,将化疗药物(如Gem)包载于纳米载体中可将药物在肿瘤部位的富集提高5~10倍。这种基于纳米药物粒径及EPR效应的靶向称为被动靶向。本研究对LENP-Gem-siMCL-1的药物输运和肿瘤抑制作用进行检测,表明Gem和siMCL-1可以被有效地联合输运到胰腺癌细胞内,靶向抑制MCL-1蛋白表达,并且在体外实验中明显抑制胰腺癌细胞PANC-1和BxPC-3存活,抑制率分别达到57.3%和66.0%。下一步将建立胰腺癌的动物模型,对LENP-Gem-siMCL-1的体内抗肿瘤效应进行评价。
本研究采用了磷脂-聚合物混合型纳米载体LENP同时将Gem和siMCL-1有效地输运到肿瘤细胞内,使其发挥抗肿瘤效应。LENP的各组分都是经美国FDA批准的用于临床药物或食品添加剂的材料,易被临床接受。下一步将评价该纳米药物在体内的抗肿瘤效应,为临床应用提供实验基础。

