暴马桑黄SbLSD基因克隆及差异表达分析
刘增才,王世新,孙婷婷,曲晓磊,邹 莉
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.哈尔滨学院 食品工程学院,黑龙江 哈尔滨 150086)
桑黄是一类大型的药用真菌,近几十年来深受消费者的喜爱和追捧,主要由于桑黄在降血糖[1]、抗氧化[2]、抗肿瘤[3]、增强人体免疫[4]等方面具有良好的医疗功效,并且在产生良好药用效果的同时,不会使患者机体出现不良反应和副作用[5-6]。桑黄良好的药用效果主要源于其富含的多种活性物质,包括三萜、多糖、黄酮、酚类等,通过分化诱导、抗侵袭转移、对肿瘤细胞的毒作用等方式来发挥功效[7-8]。三萜是一类基本母核由30 个碳原子组成的复杂化合物,是桑黄发挥药用功效的重要成分,并且三萜含量的多少是衡量桑黄药用价值高低的重要指标[9]。
暴马桑黄Sanghuangporus baumii(Pilát) L.W.Zhou &Y.C.Dai 是生长在暴马丁香树上的一种桑黄,目前从中分离提取得到的三萜含量较低,通过大面积人工栽培暴马桑黄或者利用化学手段获得大量三萜难度均较大,所以三萜的获取限制了其药用价值的应用。暴马桑黄三萜是通过甲羟戊酸途径(mevalonate pathway,MVA)途径合成的,由起始物乙酰辅酶A 经过乙酰辅酶A 酰基转移酶(acetyl-CoA acetyltransferase,AACT)、羟甲基戊二酰辅酶A 合酶(3-hydroxy-3-methylglutary-CoA synthase,HMGS)、羟甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)、甲羟戊酸激酶(mevalonate kinase,MVK)、甲羟戊酸焦磷酸脱羧酶(mevalonate pyrophosphate decarboxylase,MVD)、异戊二烯焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)、羊毛甾醇合酶(lanosterol synthase,LS)等一系列酶催化后反应生成中间三萜产物羊毛甾醇[10]。但是羊毛甾醇如何在多种酶的催化、修饰下演变成不同结构的三萜依然未知,目前大多数研究者认为,P450 家族基因在羊毛甾醇后续反应中起着重要作用,并且已有研究者发现证实,在灵芝和蒺藜苜蓿等生物中存在少量P450 基因参与三萜合成过程[11-14]。如果通过分子手段对暴马桑黄三萜合成途径中的相关酶基因进行研究,解析三萜生物合成途径机制,从而提高三萜产量,也不失为一种切实可行的获取大量三萜的技术手段。
为此,本研究对P450 家族的暴马桑黄SbLSD基因进行研究,基于前期测得的转录组数据,同时结合基因组数据筛选得到SbLSD基因电子序列,设计特异性引物进行PCR 扩增,扩增产物测序后进行生物信息学分析,并对SbLSD基因在暴马桑黄不同发育阶段的转录水平进行差异表达研究,可为揭示SbLSD基因在暴马桑黄三萜合成途径中的功能及探明三萜合成的机理提供理论依据。
1 材料与方法
1.1 试验材料
本研究所用的暴马桑黄菌种DL101(GenBank KP974834)、大肠杆菌克隆菌株Top10、大肠杆菌表达菌株BL21 (DE3)、原核表达载体pET-32a(+)于东北林业大学森林保护学科实验室保藏。限制性内切酶EcoRⅠ、HindⅢ、Premix Taq 酶、TB Green ™ Premix Ex Taq ™ Ⅱ(Tli RNaseH Plus)酶、5×In-Fusion HD 试剂盒、Prime Script Ⅱ 1st Strand cDNA Synthesis Kit 试剂盒、Prime Script ™RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒均购自大连Takara 公司。植物总RNA 提取试剂盒、琼脂糖凝胶DNA 回收试剂盒均购于北京天根生化公司。质粒提取试剂盒购自于上海Omega 公司。聚丙烯酰胺凝胶电泳(dodecyl sulphate polyacrylamide gel electrophoresis,SDSPAGE)试剂盒购自北京索莱宝公司。
1.2 试验方法
1.2.1 试验引物
试验引物信息见表1。
1.2.2 SbLSD 基因克隆
采用植物总RNA 提取试剂盒提取暴马桑黄总RNA,检测其纯度和浓度后,反转录成cDNA。用cDNA 为模板,SbLSD-F1、SbLSD-R1(表1)为引物进行PCR 扩增。PCR 扩增条件:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 40 s,35 个循环;最后72 ℃延伸7 min,16 ℃结束。PCR 产物电泳检测后,用琼脂糖凝胶DNA 回收试剂盒进行纯化回收,检测回收产物浓度并送至哈尔滨擎科生物公司测序。
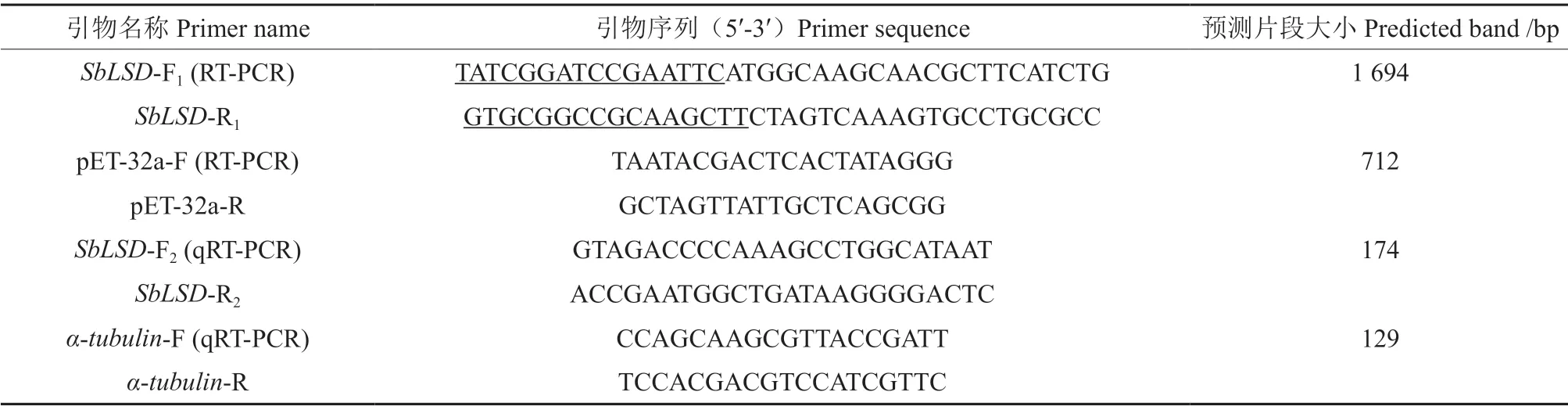
表1 引物信息†Table 1 Primer information
1.2.3 SbLSD 基因序列分析
将SbLSD基因测序结果提交到NCBI,并预测开放阅读框(open reading frame,ORF)和保守结构域(https://www.ncbi.nlm.nih.gov/);利用生物信息学软件对SbLSD基因编码的氨基酸序列进行预测和分析:ProtParam 预测蛋白的理化性质;TMHMM 和SignalP 分别预测蛋白的跨膜区和信号肽;NetPhos 预测蛋白的磷酸化位点;PSORT Ⅱ预测蛋白的亚细胞定位;SOPMA 和Swissmodel分别预测蛋白的二级结构和三级结构;MEGA 6.0预测蛋白系统进化关系[15-17]。
1.2.4 SbLSD 基因原核表达载体构建
用限制性内切酶EcoRⅠ和HindⅢ对pET-32a质粒进行双酶切,酶切产物纯化回收后,用In-Fusion HD 试剂盒将其与SbLSD基因片段进行同源重组,得到pET-32a-SbLSD重组质粒,随后转入大肠杆菌Top10 感受态细胞中。从转化后的大肠杆菌Top10中提取质粒,用引物pET-32a-F、pET-32a-R(表1)进行PCR 检测,PCR 扩增条件:94 ℃预变性5 min;94 ℃ 30 s,57 ℃ 40 s,72 ℃ 50 s,35 个循环;最后72 ℃延伸10 min,16 ℃结束。将PCR 检测正确的阳性质粒送至哈尔滨擎科生物公司测序。
1.2.5 SbLSD 基因诱导表达及检测
将检测正确的pET-32a-SbLSD质粒转入大肠杆菌BL21(DE3)感受态细胞后进行菌落PCR检测,将阳性菌落接种到LB 液体培养基(含100 μg·mL-1Amp)中过夜振荡培养,取50 μL 菌液加入新鲜LB 液体培养基(含100 μg·mL-1Amp)中振荡培养,当OD600达到0.6~0.8 时收集阴性对照菌液,在剩余菌液中加入IPTG(终浓度为1 mmol·L-1)诱导表达,收集不同诱导时间段的菌液进行SDS-PAGE 检测。
1.2.6 SbLSD 基因荧光定量检测
将长满培养皿的暴马桑黄菌丝接种至PD 液体培养基中振荡培养,收集6、8、10、12、14 d 不同时间段的菌丝。同时将暴马桑黄菌丝接到栽培袋中,接种45 d 后收集原基,60 d 后收集子实体[10]。将收集得到的暴马桑黄材料分别提取总RNA,得到的总RNA 用Prime Script ™ RT reagent Kit with gDNA Eraser 试剂盒反转录成cDNA,采用α-tubulin基因作为内参(表1),每组样品设置3 个重复。qRT-PCR 反应在核酸扩增荧光检测仪上完成,反应程序:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃1 min,40 个循环;95 ℃ 10 s,55 ℃ 30 s,95 ℃30 s。根据得到的不同Ct 值,按照公式2-ΔΔCt计算暴马桑黄不同发育阶段基因相对转录水平[18]。
2 结果与分析
2.1 SbLSD 基因克隆
以暴马桑黄总RNA 反转录得到的cDNA 为模板,用所设计的引物在1 000~2 000 bp 之间扩增出单一的SbLSD基因条带,与预测目的条带大小相吻合(图1)。纯化回收产物送至哈尔滨擎科生物公司测序,测序结果提交到GenBank(登录号为MN864180)。
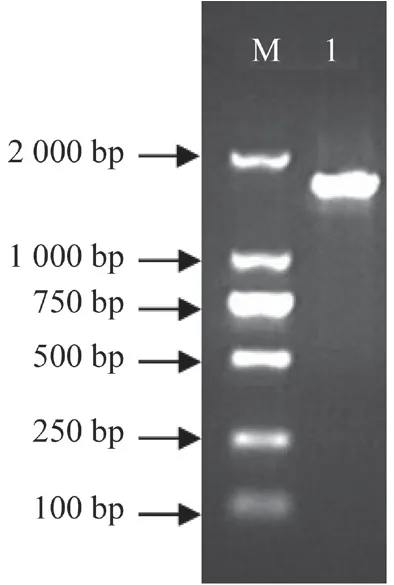
图1 SbLSD 基因cDNA 全长PCR 产物电泳检测Fig.1 Electropherograms of SbLSD gene cDNA full-length amplified by PCR
2.2 SbLSD 基因生物信息学分析
2.2.1 SbLSD 蛋白理化性质预测
利用NCBI 网站上的ORF Finder 进行ORF 查找,结果显示序列中含有一个最大长度为1 662 bp的ORF,编码553 个氨基酸(图2),具有P450超家族的保守结构域。ProtParam 分析结果表明,SbLSD 蛋白中亮氨酸的含量最高(8.5%),半胱氨酸的含量最低(0.5%),蛋白分子量为62.26 kDa,理论等电点为6.42,亲水性的总平均值为-0.255,不稳定系数为36.24,说明SbLSD 蛋白是亲水的稳定蛋白。

图2 SbLSD 基因cDNA 全长及其编码的氨基酸序列Fig.2 Complete cDNA and deducted amino acid sequence of SbLSD gene
2.2.2 SbLSD 蛋白跨膜区预测
跨膜区预测是检验一个蛋白是否具有传递物质或信号的能力,其中跨膜螺旋区的位置和数量对于细胞膜的功能具有重要的影响[19]。使用TMHMM 对跨膜区预测,结果显示SbLSD 蛋白1~30 位氨基酸在膜内,54~553 位氨基酸在膜外,31~53 位氨基酸之间含有一个跨膜螺旋结构(图3),说明SbLSD 蛋白可能为跨膜蛋白。
2.2.3 SbLSD 蛋白信号肽预测
信号肽是一段能将新合成的蛋白质引导到不同亚细胞器中去发挥作用的氨基酸序列,其序列长度在8~90 个氨基酸残基之间,一般长度在18~25 个之间[20]。使用SignalP 对信号肽预测,结果表明SbLSD 蛋白在24 位和40 位氨基酸可能存在信号肽,并且在42 和43 位氨基酸间存在一个PLA-II 切割位点(图4)。
2.2.4 SbLSD 蛋白磷酸化位点预测
修饰作用在形成多功能蛋白质的过程中具有十分重要意义,它能使蛋白质的结构更加多样,功能更为全面,调节更为精细。磷酸化修饰作为蛋白质翻译后的修饰之一,它在生物体内普遍存在[21],使用NetPhos 对磷酸化位点预测结果表明,SbLSD 蛋白存在51 个潜在的磷酸化位点,包括20 个丝氨酸位点、18 个苏氨酸位点以及13 个酪氨酸位点(图5)。
2.2.5 SbLSD 蛋白亚细胞定位预测
蛋白质是生命体的基本组成部分,它的功能发挥与亚细胞区间有着密切关联,只有处在特定的亚细胞区间内,才能发挥每种蛋白所特有的功能,通过对蛋白所处的亚细胞区间预测,有利于了解该蛋白的功能性质及和其他蛋白之间的联系[22]。使用在线软件PSORT Ⅱ分析SbLSD 蛋白的亚细胞定位,结果显示其主要定位于内质网(44.5%)和高尔基体(22.2%),在线粒体(11.1%)、细胞核(11.1%)、细胞质(11.1%)也有少量分布,说明SbLSD 蛋白主要在内质网和高尔基体完成蛋白质的加工修饰。
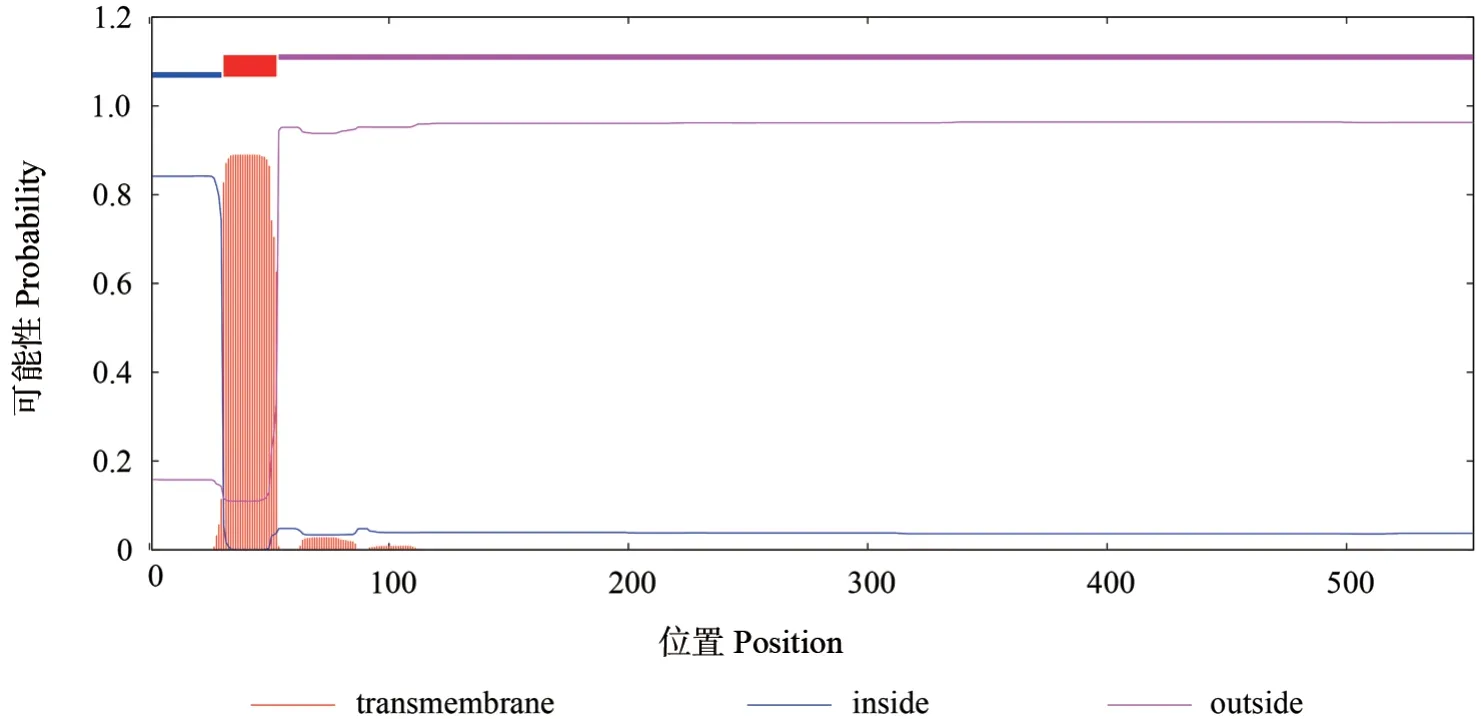
图3 SbLSD 蛋白的跨膜区预测结果Fig.3 The prediction of transmembrane region for SbLSD protein
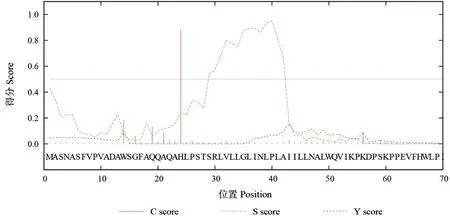
图4 SbLSD 蛋白信号肽预测结果Fig.4 The prediction of signal peptide for SbLSD protein
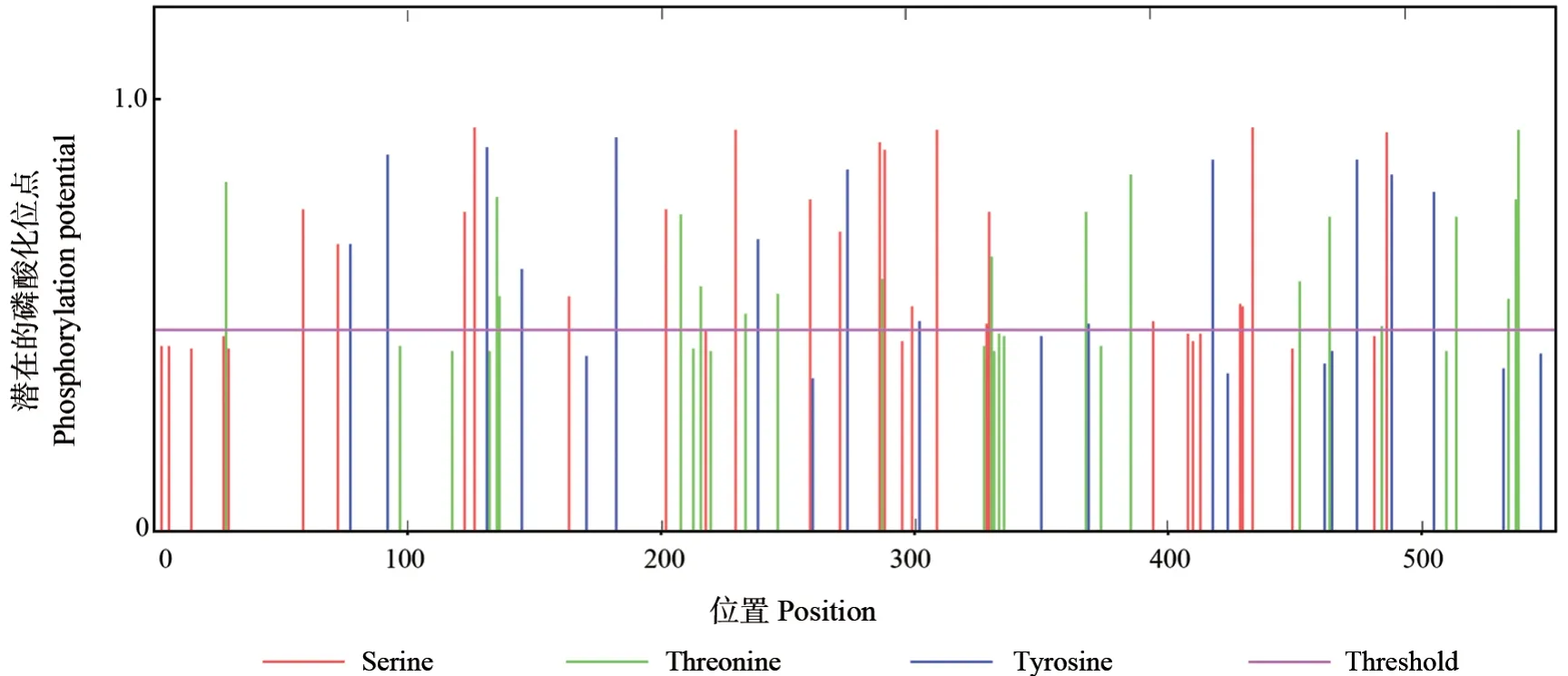
图5 SbLSD 蛋白磷酸化位点预测结果Fig.5 The prediction of phosphorylation potential for SbLSD protein
2.2.6 SbLSD 蛋白高级结构预测
使用SPOMA 软件对SbLSD 蛋白二维结构预测分析,结果显示43.76%的SbLSD 蛋白处于α 螺旋状态,11.57%处于延伸状态,3.80%处于转角状态,40.87%处于无规则卷曲状态,说明该蛋白大部分氨基酸都处于卷曲状态。使用Swissmodel 软件对SbLSD 蛋白三维结构预测分析,结果显示SbLSD 蛋白结构预测图是以酿酒酵母Lanosterol 14-alpha demethylase 的蛋白三维结构图(SMTL ID:5hs1.1.A)为模板构建的,序列相似度为45.60%(图6)。
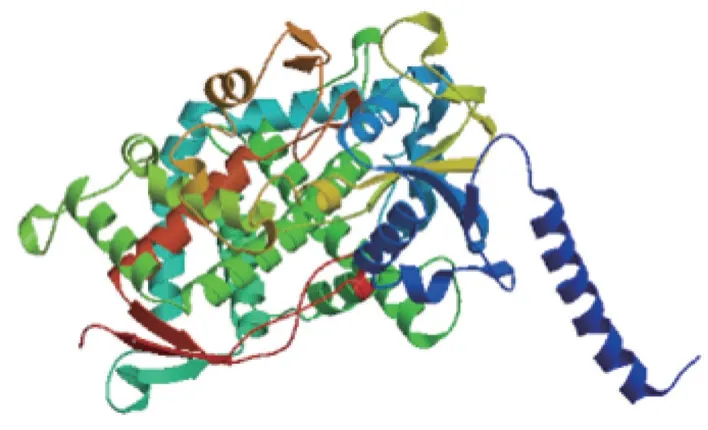
图6 SbLSD 蛋白的三维结构预测结果Fig.6 Three-dimensional structure prediction for SbLSD protein
2.2.7 SbLSD 蛋白同源性分析
从NCBI 数据库中挑选与暴马桑黄具有一定同源性的LSD 氨基酸序列,用MEGA 6.0 软件构建LSD 蛋白同源进化树(图7)。结果显示所有生物的LSD 蛋白聚为一大分支,说明LSD 蛋白具有同一个祖先;随后大分支分成真菌和动物两个次分支,可能由于不同类生物在进化过程LSD 蛋白产生的差异表达;而在真菌一小分支中,暴马桑黄LSD 蛋白和灵芝LSD 蛋白同源性最高,主要由于二者均属于多孔药用真菌,亲缘关系较近,以上结果符合生物进化关系。
2.3 重组质粒的获得
将线性化的pET-32a 质粒和SbLSD基因片段重组后,得到pET-32a-SbLSD重组质粒,以pET-32a-F、pET-32a-R(表1)为引物进行PCR扩增检测。结果显示在2 000 bp 附近出现特异性条带,与预测目的片段大小一致(图8)。阳性质粒在哈尔滨擎科生物公司测序后得到电子序列,序列分析结果表明重组质粒pET-32a-SbLSD构建成功。

图7 暴马桑黄LSD 蛋白和其他生物LSD 蛋白的同源性分析Fig.7 Homology analysis of LSD protein of S.baumii and LSD protein of other species
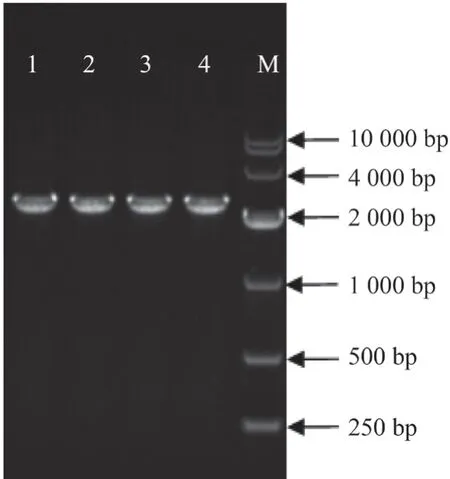
图8 重组质粒pET-32a-SbLSD PCR 检测结果Fig.8 Results of PCR detection for recombinant plasmid pET-32a-SbLSD
2.4 SbLSD 基因原核表达
将测序结果正确的重组质粒pET-32a-SbLSD转入大肠杆菌感受态细胞BL21(DE3) 后,用1 mmol·L-1IPTG 诱导重组蛋白表达。SDS-PAGE结果显示,在IPTG 诱导2、4、6、8 和10 h 后,转入重组质粒的菌体均表达出一条与目的蛋白分子量(62.26 kDa)大小相近的条带,结果如图9所示。进一步说明重组质粒pET-32a-SbLSD构建成功,通过IPTG 诱导成功表达出目的蛋白,且总体处于较高表达水平。
2.5 SbLSD 基因在不同发育阶段转录水平变化
分别提取不同发育阶段暴马桑黄材料的总RNA,以反转录后得到的cDNA 为模板,采用qRT-PCR 检测SbLSD基因的转录水平。由图10可以看出,SbLSD基因转录水平在不同发育阶段呈动态变化。在子实体阶段SbLSD基因的转录水平最高,其次是原基阶段,在菌丝阶段,该基因转录水平相对较低,并且在菌丝阶段培养14 d 时转录水平达到最低,仅为子实体阶段SbLSD基因转录水平的1/3 左右。
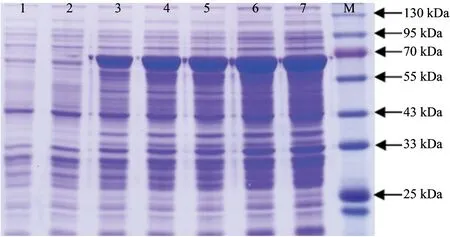
图9 SDS-PAGE 分析SbLSD 基因诱导表达产物Fig.9 Results of the expression of SbLSD gene in E.coli BL21(DE3) by SDS-PAGE analysis
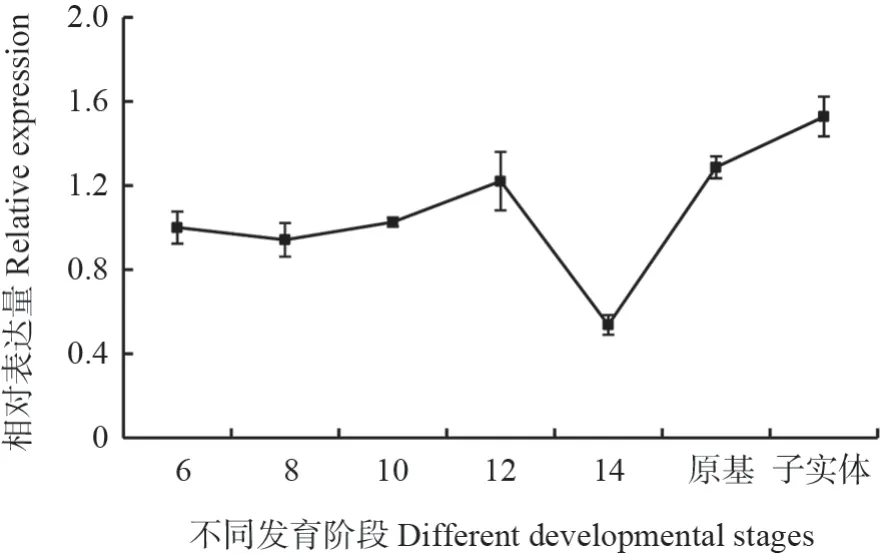
图10 不同发育阶段SbLSD 基因的转录水平Fig.10 The transcript level of SbLSD gene in S.baumii under different developmental stages
3 结论与讨论
3.1 讨 论
近年来,P450 家族基因在复杂的真菌生物转化过程中所起的作用越来越受到人们关注,羊毛甾醇14α-脱甲基化酶基因作为P450 家族成员之一,被认为是羊毛甾醇转化成三萜过程中的一个关键催化酶[23]。本研究通过PCR 克隆得到SbLSD基因cDNA 序列全长,并进行生物信息学分析,结果表明SbLSD 蛋白包含P450 超家族的保守结构域,在31~53 位氨基酸之间含有一个跨膜螺旋结构,并且该蛋白是亲水的稳定蛋白,这些结构都是SbLSD基因发挥功能不可或缺的组成单位[24-25]。亚细胞定位显示SbLSD 蛋白主要存在于内质网和高尔基体,推测该蛋白主要在内质网和高尔基体对蛋白质进行加工修饰。系统进化分析显示,暴马桑黄与灵芝聚为一支,亲缘关系较近,相似性可达57.87%,符合生物进化关系,推测暴马桑黄LSD 蛋白与灵芝等物种的LSD 蛋白在三萜合成过程中具有相似的功能。
本研究选用pET-32a 为表达载体,基于SbLSD基因全长,构建重组质粒pET-32a-SbLSD,在大肠杆菌BL21(DE3)中成功诱导出目的蛋白表达,且目的蛋白含量明显高于杂蛋白,说明在pET-32a载体中的T7 启动子作用下,SbLSD基因表达效果良好。此外,在研究不同诱导时间对SbLSD 蛋白产生的影响时,结果发现该蛋白表达量没有随着IPTG 诱导时间的延长而显著增加,说明在原核系统中,诱导时间长短对该蛋白产量的影响不明显,而在真核系统中外源诱导对SbLSD基因的表达情况影响,有待于进一步检测验证。
在检测SbLSD基因在暴马桑黄不同发育阶段转录水平的过程中发现,SbLSD基因转录水平在不同发育阶段呈动态变化,子实体阶段转录水平较高,菌丝阶段转录水平相对较低,其变化趋势与羊毛甾醇合成基因在不同发育阶段变化趋势相似[12,26],推测该基因可能对羊毛甾醇起修饰作用,进而增加三萜生物合成,该结果与上述亚细胞定位显示SbLSD 蛋白主要存在于内质网和高尔基体对蛋白质加工修饰结果相吻合。
目前在植物和真菌中,研究者均发现有P450基因参与到三萜合成工作中。在植物中,Carelli等[13]在蒺藜苜蓿中鉴定出1 种参与三萜生物合成的P450 基因(CYP716A12),并发现CYP716A12基因是皂苷生物合成途径的早期步骤,能够在C-28位催化β-amyrin 和erythrodiol 产生三萜齐墩果酸;Seki 团队[27-29]在甘草中鉴定出3 种参与三萜生物合成的P450 基因(CYP88D6,CYP72A154,CYP716A179),其中CYP88D6基因是在C-11位通过两步氧化催化将β-amyrin 生成11-oxo-βamyrin,而CYP72A154基因和CYP716A179基因被证明是分别负责三萜甘草酸途径中的C-30 位和C-28 位的氧化。在真菌中,Wang 等[11]将灵芝P450 基因CYP5150L8在酿酒酵母中进行异源过表达研究,结果在酿酒酵母中检测到灵芝三萜的存在;方星等[30]将CYP51基因在灵芝中过量表达,在灵芝菌丝中发现三萜含量明显增加。上述实验说明P450 家族基因在三萜合成过程中作用重大,但目前在暴马桑黄中并未见P450 基因的相关报道,本研究通过差异表达分析初步鉴定出可能参与三萜合成的SbLSD基因,但该基因在三萜合成途径中的功能和调控机制还不明确。本实验室已经完成暴马桑黄遗传转化体系的初步构建,以期通过转化试验对SbLSD基因进行深入研究,探明其具体的功能和调控作用。
3.2 结 论
以暴马桑黄转录组为基础,通过反转录克隆得到SbLSD基因,该基因cDNA 全长1 662 bp,将其构建到pET-32a 表达载体上,在大肠杆菌BL21(DE3)中成功表达出62.26 kDa 目的蛋白。亚细胞定位显示,SbLSD 蛋白主要存在于内质网和高尔基体,并且在暴马桑黄不同发育阶段,SbLSD基因在子实体阶段转录水平较高,菌丝阶段表现不活跃,与MVA 途径中合成羊毛甾醇基因的变化趋势相吻合,初步证实该基因参与三萜合成途径,并推测该基因表达的SbLSD 蛋白主要在内质网和高尔基体对羊毛甾醇进行加工修饰,减少中间产物羊毛甾醇的积累,进而提高下游三萜产物的含量。
——一道江苏高考题的奥秘解读和拓展

