合并KRAS G12V突变的EGFR T790M阳性肺腺癌患者奥西替尼耐药1例并文献复习
符宇龙 刘泽毅 王佳佳 许文景 黄建安
病例资料
患者男,71岁,因“咳嗽咳痰20余天”入院于2018年5月9日。入院查体未见明显异常。门诊查外周血肿瘤指标示:癌胚抗原371.2ng/mL(正常范围0~5.5ng/mL),CA199 709.7U/mL(正常范围0~39U/mL),CA125 419.1U/mL(正常范围0~35U/mL)。5月12日胸部CT示:右肺下叶占位——MT不除外;两肺多发小结节;纵隔未见明显肿大淋巴结(图1A、B)。支气管镜检查气管腔内未见明显新生物。5月16日在CT引导下行经皮肺穿刺,穿刺病理结果:右下肺原发性腺癌。外送组织切片进行热点基因突变(EGFR exon18-21、ALK重排、ROS1重排)检测,显示EGFR exon19 c.2236_2250del。诊断为右下肺腺癌cT4N0M1a-IVa期,结合患者意愿,行培美曲塞+顺铂全身化疗一次,于5月30日出院。2018年6月21日患者复查胸部CT示:右下肺肿块、两肺结节;纵隔结节,提示出现纵隔淋巴结转移(图1C、D)。患者传统化疗治疗效果不佳,2018年12月开始吉非替尼(易瑞沙)二线治疗,剂量250mg/d。
2019年3月起患者出现咳嗽、咯痰症状加重,3月19日查胸部CT示:肺部原发病灶无明显变化,肺内小结节增大,纵隔淋巴结肿大,出现右侧胸腔积液,肝脏转移可能(图3A、B)。全身骨扫描提示右侧肩胛骨及肩胛关节局部骨代谢增高,考虑骨转移。患者疾病进展,于4月9日再次住院,入院查体右下肺呼吸音减低,余未见明显异常。外周血癌胚抗原168.2ng/mL,CA199 288.09U/mL,CA125 131.5(A、B)2018年5月12日胸部CT:右肺下叶约62mm x 51mm肿块影,两肺另见数枚小于6mm小结节影。(C、D)2018年6月21日胸部CT:两肺多发结节影,右下肺内见团块状影(70mm x 45mm),纵隔内见结节影。

图1 患者2018年5月、2018年6月胸部CT对比
U/mL,较前降低。与患者及家属沟通后,于4月11日再次在CT引导下行经皮肺穿刺右下肺肿块,病理结果为右下肺腺癌。为了解患者EGFR-TKI耐药情况,将患者病理组织切片及外周血均送检进行二代测序(next generation sequencing,NGS),组织测序结果提示:EGFR exon19 c.2236_2250del,突变频率18.73%(图2A);EGFR exon20 T790M,突变频率1.01%(图2B);TP53 exon7 G244D,突变频率16.4%(图2C)。外周血ctDNA测序结果提示:KRAS exon2 G12V,突变频率1.49%(图2D)。4月22日起患者试用奥西替尼(泰瑞莎)口服治疗,剂量80mg/d。
服药后患者咳嗽、咯痰症状无改善,且出现胸闷、胸痛不适。2019年5月20日复查外周血肿瘤指标:癌胚抗原240.3ng/mL,CA199 385.7U/mL,CA125 195.6U/mL,较4月9日升高。5月21日复查胸部CT示:右下肺不规则肿块影,较前未见明显变化;右侧胸腔积液,较前增多;肝脏低密度影;右肩胛骨骨质破坏(图3C、D)。5月25日胸水癌胚抗原>1000ng/mL。胸水送病理找到癌细胞。考虑奥西替尼治疗效果不佳,改治疗方案为贝伐珠单抗600mg D0+多西他赛 130mg D1+卡铂500mg D2。2019年9月15日复查肺部病灶较前无明显变化,部分胸椎见转移灶。目前患者间断化疗维持中。
讨 论
EGFR-TKI靶向药物因其良好的效果和较轻微的副作用而在肺癌治疗领域应用广泛。肺癌患者在应用第一代或第三代EGFR-TKI靶向药物之前,需要检测肿瘤驱动基因,从而预测靶向药物的疗效。本病例男性,晚期肺腺癌患者基因测序检出EGFR敏感突变,在传统化疗出现病情进展后服用第一代EGFR-TKI,但效果不佳,三个月后即出现了症状加重。胸部CT提示出现肺内小结节增大,并出现胸(A、B)2019年3月19日胸部CT:右肺下叶见不规则状肿块影,两肺另见数枚结节影,最大直径约15mm;纵隔内见结节影,增强扫描轻度强化。右侧胸腔沿后壁见略高密度影。(C、D)2019年5月21日胸部CT:两肺多发结节影,右肺下叶不规则肿块影;纵隔内见结节影;右侧胸腔沿后壁见略高密度影。

图2 患者第二次活检基因突变

表1 EGFR和KRAS突变共存的NSCLC患者接受EGFR-TKIs治疗的病例报道
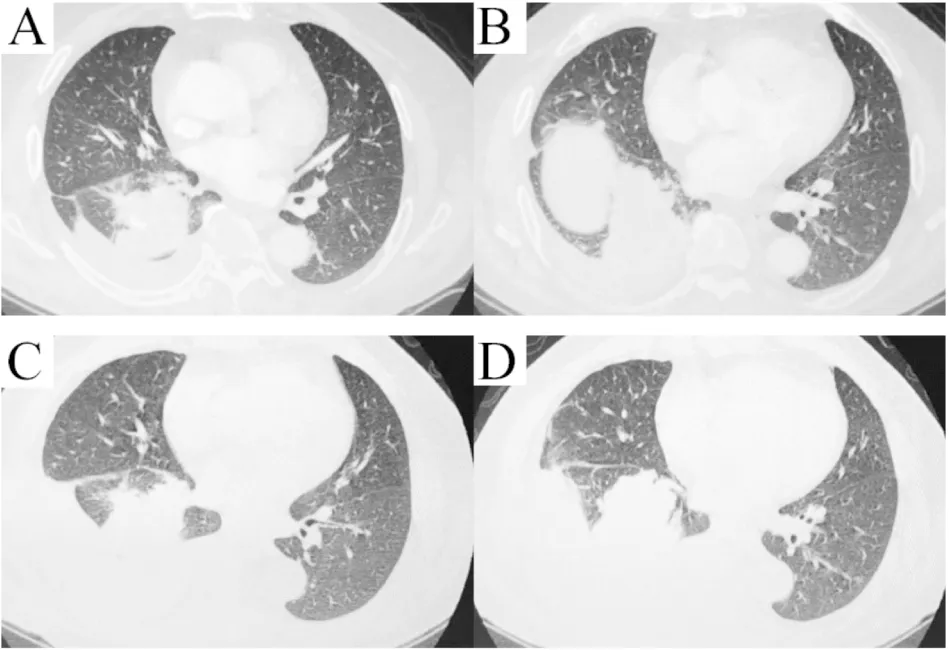
图3 患者2019年3月与5月胸部CT对比
腔、肝脏和骨转移。再次进行了原病灶穿刺活检,并与外周血标本同时送检二代测序。结果提示肿瘤组织存在T790M突变,因而选用第三代EGFR-TKI奥西替尼治疗。但用药后患者出现胸水增多,症状加重,检测肿瘤标志物较前升高,奥西替尼治疗无效。提示肿瘤可能存在其他耐药机制,导致对药物不敏感。
患者二次活检时肿瘤组织同时检出TP53基因exon7 G244D突变,血ctDNA检出KRAS exon2 G12V突变。有研究认为TP53基因的8号染色体出现突变可能对EGFR-TKI治疗带来负面效果[1],而其余位点的突变没有对肺腺癌患者的总体生存率或无进展生存期产生影响。该患者的TP53突变并不能解释EGFR-TKI的耐药,因此推断患者KRAS基因G12V突变造成了奥西替尼治疗无效。
KRAS突变是NSCLC中最常见的突变之一,总体来看KRAS突变被认为与NSCLC患者不良预后相关[2]。虽然2019年ASCO大会公布了安进(Amgen)公司针对KRAS突变的靶向药物AMG510并预示了良好的临床应用前景,然而到目前为止仍没有获得FDA批准上市的靶向治疗药物[3]。吴一龙教授团队2014年发表的一篇综述中提到,综合九项关于中国肺癌患者的研究发现,在KRAS突变的肺癌患者中没有一个存在EGFR突变,两种突变是互斥的[4]。不过,随着测序技术的逐渐发展,2016年Paola Ulivi, et al.发表研究中检测了380例非鳞非小细胞肺癌患者的福尔马林包埋石蜡切片(FFPE)标本,发现EGFR和KRAS共突变的病例占EGFR突变患者的6.8%(3/44),占KRAS突变患者的3.2%(3/92)[5]。在一项2016年Alona Zer, et al.发表的荟萃分析中统计了275例KRAS突变的采用了EGFR-TKI的肺癌患者疗效,其中发现G12C、G12V突变患者在EGFR-TKI治疗后预后更差, 而G12D/G12S KRAS突变患者可能从EGFR-TKI治疗中获益[6]。我们通过在PubMed网站以“KRAS EGFR mutant”为关键词,共筛选出八篇内容为肺癌患者确认KRAS突变阳性后使用了EGFR-TKI的病例报道。除其中一篇使用厄洛替尼治疗达到8年的报道之外[7],EGFR突变合并KRAS基因12编码子突变的NSCLC患者使用EGFR-TKI大多治疗效果不佳(见表1)。
虽然有关于NSCLC患者使用EGFR-TKI后出现继发性KRAS突变的报道,但本病例在首次活检时并没有检测KRAS基因,无法得知KRAS在使用靶向药物前的突变情况,因此无法断定本病例中KRAS突变是否为获得性耐药。值得注意的是,患者肿瘤组织测序与ctDNA测序结果并不重合。患者ctDNA测序没有检出EGFR突变,这一方面可能是由于液体活检相比组织活检存在更高的假阴性率[15],另一方面也可能是因为包含EGFR敏感突变的肿瘤被吉非替尼治疗所压制,释放入血的基因片段较少以致难以检测,这种观点也在上述两篇报道里被提及[7, 14]。同时患者肿瘤穿刺活检没有检出KRAS突变,可能与患者体内存在一个较大肿物和数个小结节,肿瘤存在异质性相关[16]。这显示了肿瘤穿刺活检可能无法反映完整的肿瘤突变情况。
液体活检是近年来开始应用的活检技术,具有取材简单,侵入性小,可在患者一般条件差时实施等优点。液体活检可以通过深度测序探测外周血内极微量的游离DNA片段,通过与正常体细胞DNA比对,来推定是否为肿瘤来源,相对肿瘤穿刺活检可更全面反映肿瘤突变情况。但液体活检也存在例如肿瘤来源指向不明[17],结果假阴性率较肿瘤穿刺活检高等缺点,目前液体活检和肿瘤穿刺活检可以互相作为补充,最终得到更全面的测序结果,为制订肺腺癌患者治疗方案提供有效的助力。
综上所述,本研究报道了1例晚期肺腺癌患者在第一次活检存在EGFR 19del后使用吉非替尼疗效不佳,第二次活检发现EGFR 19del突变合并T790M突变,血ctDNA提示KRAS G12V突变。随后患者使用奥西替尼治疗,但治疗失败。提示合并KRAS G12V突变可能是三代EGFR-TKI耐药机制之一。同时肺腺癌患者发生耐药后再次活检联合液体活检可获得更全面信息,有助于精准治疗策略的实施。

