FIZZ1通过NOTCH信号通路促进肺成纤维细胞转分化
徐芳 王爱利 黄莺
特发性肺纤维化( idiopathic pulmonary fibrosis,IPF)主要病理特征是成纤维细胞(fibroblast,Fb)过度增殖和细胞外基质( extracellularmatrix,ECM) 的大量沉积[1],其中FB的激活及转化为特异性表达平滑肌a-肌动蛋白(a-smooth muscle actin,a-SMA)的肌成纤维细胞(myofibroblast,MFb)是重要的病理机制[2],这种表型转化受多种细胞因子和信号通路调控。本课题组前期研究显示发现于炎症区域分子1(Found in inflammatory zone 1, FIZZ1)在肺纤维化中有高表达[3]。NOTCH信号通路(NOTCH signaling pathway)能够调控细胞分化、增殖及凋亡,参与器官纤维化,在肺纤维化中表达增高[4]。两者是否互相影响相互促进尚不清楚。本课题研究用NOTCH通路抑制剂即γ-分泌酶抑制剂(N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester, DAPT)干预此表型转化过程,观察FIZZ1、NOTCH1对a-SMA的表达的影响,探讨肺间质纤维化的分子机制。
资料与方法
一、实验细胞及仪器试剂
人胚肺成纤维细HELF株(中科院上海生命科学研究院细胞资源中心 )。DAPT(美国Sigma公司),FIZZ1重组蛋白(美国Santa crue公司)、鼠a-平滑肌肌动蛋白抗体(美国Santa crue公司)、NOTCH1抗体(美国Santa crue公司),CCK8 试剂盒(日本同仁公司),Quantscript RT Kit逆转录试剂盒(大连TaKaRa公司),SYBRGreen/Floursecein试剂盒(立陶宛Fermentas公司)。RT-PCR反应体系中的引物设计(武汉巴菲尔生物技术服务有限公司)。
二、肺成纤维细胞的培养与传代
常规复苏HELF细胞后,在含10%胎牛血清( fetal bovine serum,FBS)的DMEM高糖培养基,37℃、50mL/L CO2的条件下培养。当培养瓶内细胞生长达90%汇合度时,吸弃培养基用PBS缓冲液润洗一次,加入1%胰蛋白酶消化,置于细胞培养箱3min,至细胞变圆脱落,加入等量DMEM培养基终止胰酶消化。利用胶头滴管反复、缓慢、轻柔吹打,制成细胞悬液,1 000r/min,离心5 min后弃除上清。加入培养液,将所得HELF制成细胞悬液,分瓶传代,取对数生长状态良好的细胞用于后续实验。
三、CCK8实验检测FIZZ1刺激后细胞增殖活性
将呈对数生长的细胞取出,制成单细胞悬液接种于96 孔板内,每孔100ul(细胞浓度约每毫升含1×105~2×105个细胞),然后加入100ul培养液,37℃、50mL/L CO2继续孵育,贴壁4小时。弃掉旧的培养液,根据加入FIZZ1浓度分组:分别加入不同浓度的FIZZ1(0.25ug/mL,0.5 ug/mL,1ug/mL,2ug/mL),空白组(无血清DMEM),处理24小时后,吸弃孔中培养基,用无血清培养基洗涤2次,每孔分别加入10% CCK8试剂培养基,混匀,放入 CO2培养箱培养4h,测定波长490nm处各组吸光度值(OD值),计算增值率。细胞增值率=实验组OD值/空白组OD值×100%。根据细胞形态及增殖率确定FIZZ1最佳实验浓度做以下实验。
四、观察DAPT对FIZZ1诱导HELF细胞增殖的抑制作用
将细胞重新分组:空白组、FIZZ1组、DAPT干预组。DAPT干预组分别加入不同浓度的DAPT(0.25umol/L,0.5umol/L)预处理4小时,空白组及FIZZ1组用无血清DMEM代替。除空白组外余下各组再加入最佳浓度的FIZZ1处理24小时,计算OD值,并确定DAPT的最佳实验浓度做以下实验。
五、实时荧光定量PCR测定肺成纤维细胞a-SMA、NOTCH的表达
将细胞分成3组,分别按上述实验结果加入相应浓度含不同因子的培养基:对照组(无血清培养基4h+2%PBS 处理24h)、模型组(无血清培养基4h +最佳浓度FIZZ1处理24h)、DAPT组(最佳浓度DAPT的无血清培养基4h +最佳浓度FIZZ1处理24h)。96孔板每组各5个复孔。将细胞消化后离心收集细胞团,用Trizol方法提取细胞总RNA。各样本取相同质量的RNA进行DNA逆转录,RT-PCR方法检测a-SMA、NOTCH的表达。GAPDH基因作为检测基因表达的内参对照。反应体系中的引物设计如下:NOTCH上游序列: 5'-GGGTGGTCAGGAAAATCATGTCA-3',下游序列: 5'-AGTTCACAGTGGGGACCAGTAT-3',扩增长度257bp;a-SMA上游序列: 5′-GACCCAGATTATGTTTGAGACC-3',下游序列: 5'-TCCAGAGTCCAGCACAATACCA-3',扩增长度112bp;GAPDH上游序列:5'-CACGATGGAGGGGCCGGACTCATC-3',下游序列:5'-TAAAGACCTCTATGCCAACACAGT-3' ,扩增长度240bp。循环参数:预变性95℃ 3min,变性95℃ 30s,退火60℃ 30s,延伸72℃ 60s,40个循环。
六、统计学处理
结 果
一、FIZZ1诱导HELF细胞向肌成纤维细胞增殖
用不同浓度FIZZ1刺激HELF后,与对照组相比,见细胞间隙减小,细胞核质比缩小,形态由宽大梭形变成长梭形,细胞数量增多(图1B)。CKK8实验结果显示1ug/mLFIZZ1组OD值最高,较空白组明显增高,差异有统计学意义(t=20.54,P=0.025(表1),作为最佳实验浓度。实时荧光定量PCR显示模型组(1ug/mL FIZZ1)a-SMA表达较对照组显著增高(t=23.42,P=0.031﹚(图2),以上结果均提示FIZZ1刺激能促进HELF向肌成纤维细胞转化。
二、FIZZ1刺激HELF细胞转化中激活NOTCH信号通路
RT-PCR实验显示,用1ug/mLFIZZ1刺激HELF细胞后,与对照组相比,NOTCH1的表达显著增高(t=19.21,P=0.023﹚(图2),说明 FIZZ1 诱导HELF向肌成纤维细胞转化过程中激活NOTCH信号通路。用不同浓度DAPT干预以阻断NOTCH信号通路,与FIZZ1组相比,细胞增殖数量变少(图1C),OD值显著降低(表2),a-SMA表达明显下降(图2),说明NOTCH信号通路抑制剂DAPT能抑制FIZZ1介导HELF细胞增殖。
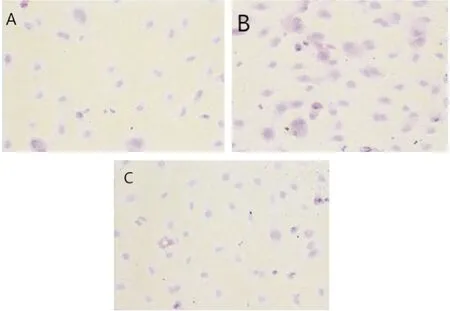
图1 FIZZ1及DAPT对HEFL增殖的影响(×200)
表1 不同浓度FIZZ1对肌成纤维细胞的增殖影响

表2 不同浓度DAPT对FIZZ1诱导HEFL增殖的影响

图2 各组HELF细胞a-SMA、NOTCH mRNA的表达
讨 论
肌成纤维细胞(MFb)被认为是纤维化疾病的“靶细胞”,在正常肺间质中以非活化形式少量存在。大量MFb主要来源是上皮-间质转化(EMT)和原位成纤维细胞(Fb)的激活与转化两种方式。正常肺组织中存在大量原位Fb,在促纤维化因素作用下,Fb被持续激活,大量增殖并产生纤维连接蛋白和胶原,与此同时,Fb获得MFb表型[5],特征性表达a-SMA,参与组织损伤修复,逐渐形成纤维灶。a-SMA表达受到许多转录因子的调控,也受表观遗传学调控[6]。
FIZZ1作为缺氧诱导的有丝分裂因子,在正常肺内特异性表达,但量很少,其兼具炎症因子和生长因子的特性,而在病理情况下,其具有刺激肺动脉平滑肌细胞增殖和血管收缩、促进肌成纤维细胞分化及激活产生细胞外基质等功能[7]。本课题组前期研究已证实在间质性肺纤维化动物模型的肺组织中FIZZ1有高表达[3,8],提示FIZZ1参与肺间质纤维化的形成过程。此次研究为了进一步探讨FIZZ1介导的分子通道对靶细胞的作用机制,我们用不同浓度的FIZZ1刺激HELF细胞,发现细胞增殖率较对照组增高,在1.0ug/mL浓度时最为明显,且细胞外形变大,核更大更圆,具有MFb的外形特点。另外,本研究中RT-PCR结果显示,选用最佳浓度1.0ug/mL FIZZ1刺激后,作为MFb最主要的标志a-SMA mRNA水平明显增高,以上均说明FIZZ1参与成纤维细胞(Fb)向肌成纤维细胞(MFb)的转化过程。
FIZZ1作为新发现的炎症介质可能参与MFb的形成,但是通过何种信号通路发挥作用呢?NOTCH信号通路参与调节细胞的増殖、分化和凋亡等生命活动,影响着动物的生长和发育[9],与肺部疾病密切相关[10]。NOTCH信号通路异常激活可致使成纤维细胞异常增殖,并分化为MFb和细胞外基质[11]。经典NOTCH信号通路主要是通过相邻细胞间的跨膜受体(NOTCH1-4)与膜系配体[Delta-like(Dll1,3-4)和Jagged(Jag)1-2]结合而启动,NOTCH受体的胞外段被基质金属蛋白酶(MMP)切割,胞内段(NICD)被γ-分泌酶裂解并释放转移到细胞核内,与下游效应蛋白CSL结合,激活NOTCH靶基因的转录[12],调控细胞增殖、分化[13]。研究表明,NOTCH信号的激活主要取决于γ-分泌酶的活性,γ-分泌酶特异性抑制剂(DAPT)能够阻断NOTCH受体活化的中心环节,使NOTCH受体分子无法进一步转变为有效的活性片段,进而完全阻断NOTCH信号通路的激活[14]。本研究结果,用FIZZ1刺激HELF细胞后NOTCH的mRNA较对照组增高,用DAPT提前处理后NOTCH的mRNA含量较模型组明显降低,提示FIZZ1刺激HELF表型转化过程中激活NOTCH信号通路,用DAPT阻断NOTCH信号通路可以抑制细胞转化及增殖。
综合上述,FIZZ1可能通过NOTCH信号通路的激活促进成纤维细胞向肌成纤维细胞的转化增殖,导致a-SMA分泌增多,加重肺间质纤维化的发生发展。如果能寻找合适的靶点阻断该通路,可能会减轻肺间质纤维化的进程。

