永久性心房颤动合并阻塞性睡眠呼吸暂停低通气综合征病人血清ox-LDL和T-AOC水平变化
韩 涌,郭香香,张 楠,焦丽琴,潘非非,范晓玲,孙 萌,王 睿
心房颤动并非一种致死性的心律失常,发作时表现为头晕、心悸、心律不齐等,严重时导致脑卒中、心力衰竭、心肌梗死甚至死亡。阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种常见的睡眠障碍性疾病,男性约占4%,女性约占2%,且随着年龄增长发病率日益增高,考虑可能与老年人咽旁肌肉脂肪沉积、咽部软组织松弛有关。目前,心房颤动与OSAHS的相关性成为国内外的研究热点之一,其中,血清氧化型低密度脂蛋白(ox-LDL)和总抗氧化能力(T-AOC)水平可间接反映体内氧化应激损伤程度,且OSAHS病人体内氧化应激损伤明显加重[1]。本研究观察单纯心房颤动病人与心房颤动合并OSAHS病人体内ox-LDL、T-AOC水平变化及临床意义。
1 资料与方法
1.1 研究对象 按照永久性心房颤动的诊断标准,选取2018年1月—2018年6月山西医科大学第一医院诊断为永久性心房颤动病人56例,根据多导睡眠监测结果分为永久性心房颤动合并OSAHS组(试验组,36例)和永久性心房颤动无OSAHS组(对照组,20例),所有病人均排除各种急性、慢性感染(包括近2周有呼吸道感染病史、慢性阻塞性肺疾病)、严重心脑血管疾病、肝肾功能不全、糖尿病、中枢性及混合性睡眠呼吸暂停低通气综合征等疾病。
1.2 诊断标准 OSAHS符合2011年《阻塞性睡眠呼吸暂停诊治指南》制定的诊断标准[2]:每晚至少7 h睡眠过程中呼吸暂停及低通气反复发作30次以上或呼吸暂停低通气指数(AHI)≥5次/h。永久性心房颤动符合《心脏内科疾病诊断治疗指南》[3]制定的诊断标准。
1.3 研究方法
1.3.1 一般资料收集 所有病人身体保持垂直站立,保证空腹时测量身高、体重,同时计算体质指数(BMI)。
1.3.2 多导睡眠图监测 行多导睡眠图监测前24 h禁用安眠药,禁烟、酒、咖啡等,从23:00至次日06:00,共7 h,记录病人睡眠过程中AHI。
1.3.3 标本采集 抽取空腹静脉血5mL,以3000 r/min离心10 min,取上层血清至准备好的干净的Ependorff管中,并及时保存于-80 ℃冰箱中。严格按照说明流程操作,采用酶联免疫吸附法测定血清ox-LDL、T-AOC水平。
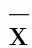
2 结 果
2.1 两组临床资料比较(见表1)
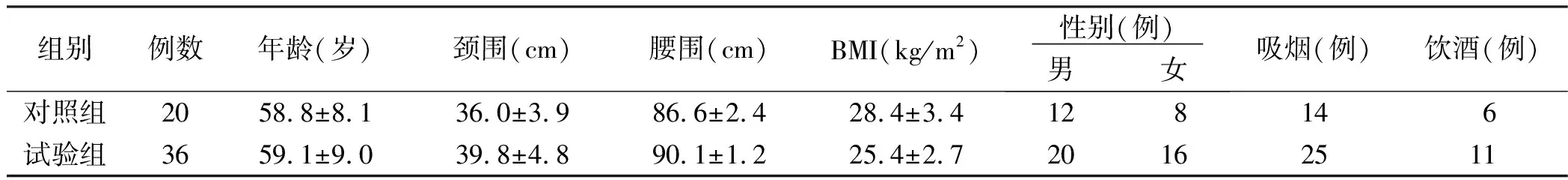
表1 两组临床资料比较
2.2 两组血清ox-LDL、T-AOC水平和AHI比较 试验组血清ox-LDL水平和AHI均高于对照组,试验组血清T-AOC水平低于对照组,差异均有统计学意义(P<0.05)。详见表2。
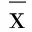
表2 两组血清ox-LDL、T-AOC水平和AHI比较(±s)
2.3 OSAHS病人血清ox-LDL、T-AOC与AHI相关性分析 OSAHS病人血清ox-LDL与AHI呈正相关(r=0.625,P<0.05),血清T-AOC与AHI呈负相关(r=-0.681,P<0.05)。
3 讨 论
心房颤动发病率日益增多,全球超过3 300万人患有心房颤动,且随着人口老龄化,预计到2050年美国有600万~1 200万例心房颤动病人,2060年欧洲约1 790万例心房颤动病人[4]。Guo等[5]研究发现,11年期间心房颤动发生率增加约20倍,心房颤动相关的脑卒中增加13倍;中国成年人中心房颤动终身风险约20%,且随着年龄增长发病率逐年增高。Guilleminault等[1]已提出心房颤动与OSAHS存在一定关联。Gami等[6]纳入312例无心房颤动病人与151例心房颤动病人,结果发现心房颤动病人中近一半伴有OSAHS(49%与32%,P=0.000 4)。一项大型队列研究对比228例OSAHS病人与338名正常人发现,调整年龄、性别、体重等混杂因素后,患有严重OSAHS病人发生各种复杂心律失常风险是正常对照组的2~4倍[7]。
我国关于心房颤动研究起步晚,随着心房颤动发病率(尤其是年龄较大者)、致残率和病死率增加,较多学者进行了深入研究,发现OSAHS可能是心房颤动发病、治疗后复发及病死率增加的一个重要原因。OSAHS可增加心房颤动的发生风险:具有相同的危险因素,如吸烟、饮酒、肥胖等;OSAHS病人体内发生的一系列病理生理变化引起神经、体液等改变,直接影响心脏电生理和结构,从而增加心房颤动发生风险。主要机制包括:①OSAHS病人睡眠过程中,气道反复塌陷与闭塞导致吸气过程胸腔内负压明显增大,从而对薄壁的心房产生牵拉作用,增大心房腔,长期导致心房发生纤维化,影响心房结构和电活动,从而诱发心房颤动;巨大的压力梯度变化引起肺静脉组织牵拉及重构,是心房颤动易发生的病理生理基础[8];支气管内负压激活迷走神经,缩短心房有效不应期,从而增加心房颤动的发生风险[9]。②OSAHS引起自主神经功能紊乱,肺静脉口由肾上腺素能神经与迷走神经支配,与心房颤动发生发展和心房颤动针对性射频消融治疗密切相关[10]; OSAHS的主要病理生理特征,即间歇性低氧(intermittent hypoxia,IH)引起交感神经活性增强,血浆去甲肾上腺素浓度与夜间血氧饱和度降低有关,去甲肾上腺素升高导致心率加快、血压升高,从而诱发心房颤动的发生。③有研究发现,多数OSAHS病人伴有醛固酮增多症,并提出伴有高血压的OSAHS病人均应常规行原发性醛固酮增多症(primary aldosteronism,PA)筛查[11],而醛固酮增加引起电解质紊乱,影响心肌电活动;促进水钠潴留,升高血压,增加心脏后负荷;促进成纤维细胞增殖,引起心肌细胞纤维化,不仅影响心脏结构,扩大心房,尤其是左心房,这一指标可作为心房颤动的预测因素;发生心房内电重构可改变心房内电传导速度和方向,从而引起心房内折返及心房颤动发生。④OSAHS病人体内存在系统性炎症反应,已有研究表明,OSAHS病人血浆C反应蛋白(C-reactive protein,CRP)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子等炎症介质明显升高,且OSAHS严重程度、炎性因子水平、CRP浓度与心房颤动复发风险明显相关[12]。主要是由于OSAHS引起的炎症反应导致心房纤维化,造成心房电活动紊乱,从而引起心房颤动的发生。
脑卒中是心房颤动病人死亡的主要原因之一,且心房颤动病人发生脑卒中风险是正常人的5倍[13]。有研究认为,氧化应激反应是缺血性脑卒中引起脑损伤的重要机制之一,也是影响病人预后的重要因素[14]。分析原因可能是大量自由基释放不仅损伤核酸DNA,导致神经元死亡,而且损伤血管内皮细胞,增加血脑屏障通透性,导致脑组织微循环障碍;另外,脂质过氧化破坏线粒体膜结构,导致线粒体功能受损,呼吸链破坏,最终加剧缺血性脑卒中。
低密度脂蛋白(LDL)经过氧化后,发生一系列自由基链式反应,最终形成ox-LDL。T-AOC是反映机体抗氧化作用的重要指标之一。本研究结果显示,心房颤动合并OSAHS病人血清ox-LDL水平升高,T-AOC水平降低。表明与单纯心房颤动病人相比,心房颤动合并OSAHS病人体内抗氧化物与自由基之间的动态平衡被打破,体内氧化应激损伤明显,病人发生脑卒中风险更大。有研究对5 138例心房颤动病人进行睡眠监测筛选,最终符合标准的心房颤动病人332例,分为合并OSAHS组(283例)和非OSAHS组(49例),结果显示心房颤动合并OSAHS组发生脑卒中风险明显增加,且控制年龄、性别、冠心病相关因素后,这一结论仍有意义[15];亚组分析结果显示,CHADS2评分为0分和CHA2DS2-VASc评分0分或1分的心房颤动合并OSAHS病人发生脑卒中风险升高[15]。本研究结果显示:OSAHS病人血清ox-LDL与AHI呈正相关(r=0.625,P<0.05),血清T-AOC与AHI呈负相关(r=-0.681,P<0.05),表明OSAHS病情越重,病人氧化应激损伤越严重。
OSAHS不仅可增加心房颤动发生风险,且通过检测单纯心房颤动及心房颤动合并OSAHS病人外周血清ox-LDL、T-AOC水平,发现心房颤动合并OSAHS病人体内氧化应激损伤更明显,表明病人发生脑卒中风险更大,且OSAHS病情越严重,其发生脑卒中可能性越大。提示临床医生应重视心房颤动病人,尤其是肥胖、睡眠打鼾的老年病人应常规行多导睡眠监测;对心房颤动合并OSAHS病人应给予积极干预治疗,如持续正压通气、抗凝、抗氧化剂等。本研究存在一些不足,如样本量有限,未设立正常对照组等,今后需要通过更多大样本量、多中心研究分析心房颤动合并OSAHS的发病机制。

