香烟烟雾提取物对可溶性内皮细胞蛋白C受体表达的影响
樊芳芳,胡晓芸
蛋白C系统作为人体抗凝系统的重要组成部分,在血液中以无活性的酶原形式存在,保持正常机体凝血与抗凝功能平衡[1],是体液抗凝的主要成分之一。蛋白C系统参与抗凝的不同阶段,不仅影响蛋白C活化,而且抑制活化蛋白C活性[2-3]。Fukudome等[4]从内皮细胞表面分离出蛋白C和活化蛋白C的结合蛋白——内皮细胞蛋白C受体(endothelialcellprotein C receptor,EPCR),其存在于细胞膜表面的跨膜蛋白,与蛋白C/活化蛋白C特异性结合后将其呈递给邻近的凝血酶/血栓调节蛋白复合物,使蛋白C活化效率提高5倍,同时参与调节血液凝固反应。EPCR有两种存在形式,一种是内皮细胞表面的膜联EPCR(mEPCR),通过与蛋白C结合增强蛋白C/活化蛋白C活性,提高蛋白C活化率[5],但其本身无任何直接的抗凝活性;另一种是存在于血浆的可溶性EPCR(sEPCR),其作用是抑制蛋白C/活化蛋白C活性[5-6]。相关研究发现,血浆sEPCR升高可增加动静脉血栓形成风险[6-7]。本研究将香烟烟雾提取物(CSE)作用于人脐静脉内皮细胞(HUVECs),观察CSE对sEPCR表达的影响。
1 材料与方法
1.1 实验试剂 HUVECs株为ATCC来源细胞株,购自上海门谍塔生物科技发展有限公司;胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;RPMI-1640培养基、HEPES、胰蛋白酶均购自Gibco;青霉素、链霉素均购自华北制药股份有限公司;人sEPCR酶联免疫吸附法测定(ELISA)试剂盒购自上海西唐公司。
1.2 CSE的制备 参照文献[8]方法,将1个50 mL注射器驱动装置连续抽吸两支过滤嘴香烟,每支烟吸5 min,以-5 cmH2O(1 cmH2O=0.098 kPa)负压持续吸引,经三通管另一负压驱动出口将产生的烟雾溶于50 mL磷酸缓冲盐溶液(PBS)制成悬液[5],将获得的CSE溶液通过0.22 μm微孔滤膜过滤,以除去细菌和大颗粒。将CSE-PBS缓冲液以1 mol/L的NaOH调节pH值至7.4,并将获得的储备溶液浓度定义为100%的CSE,并使用PBS将溶液稀释至实验所需的最终浓度。每次实验前立即准备CSE溶液。
1.3 HUVECs培养与分组 将含10%FBS的RPMI-1640培养液与HUVECs共同孵育,培养箱条件为37 ℃、5%CO2,48 h换液1次,观察细胞生长状态,当生长至亚融合状态,以0.25%的胰蛋白酶消化液1∶2传代,将传代的细胞接种于培养板上,每孔约2 mL,待细胞约80%融合后可用于实验[5]。实验分为以下两部分,①不同浓度CSE作用:分别将0%、2.5%、5.0%及10.0%的CSE与HUVECs共同孵育,8 h后收集各浓度组上清液。②同一浓度不同作用时间CSE对细胞的影响:将选出的5.0%CSE与HUVECs分别孵育0 h、4 h、8 h、12 h及24 h,并设立对照组,对照组采用相同体积的PBS同步培养,分别收集各组上清液。实验需保证各组除处理因素外其余实验条件均相同。每个样本均设4个复孔,实验重复3次[1]。
1.4 ELISA检测sEPCR含量 sEPCR标准品浓度分别为4 000 pg/mL、2 000 pg/mL、1 000 pg/mL、500 pg/mL、250 pg/mL、125 pg/mL、62.5 pg/mL,检测过程严格按照试剂盒说明进行。
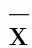
较采用单因素方差分析(ANOVA)及重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 HUVECs形态观察 倒置相差显微镜下观察HUVECs,可见细胞大量贴壁生长,形态不规则,呈椭圆形、多角形、扁平或梭形,为单层鹅卵石镶嵌样排列,细胞单层融合时呈典型的“铺路石”样外观。详见图1。
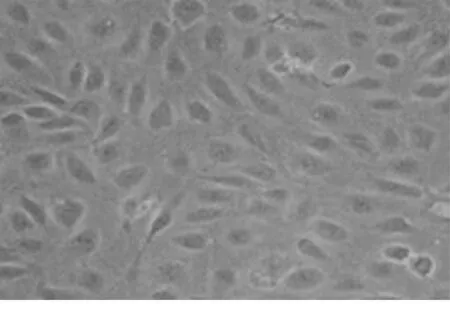
图1 HUVECs显微镜下图像
2.2 不同浓度CSE对HUVECs表达sEPCR的影响 HUVECs与不同浓度CSE孵育8 h后,5.0%、10.0%CSE组sEPCR较0%CSE组升高,差异有统计学意义(P<0.05);2.5%CSE组与0%CSE组sEPCR比较,差异无统计学意义(P>0.05)。详见表1。
表1 各组sEPCR比较(±s) 单位:pg/mL
2.3 同一浓度不同作用时间CSE对sEPCR的影响 显微镜下图像可见10.0% CSE组大部分细胞已死亡,故本研究实验采用5.0%CSE。5.0%CSE与HUVECs分别孵育0 h、4 h、8 h、12 h及24 h后,8 h、12 h及24 h sEPCR表达较对照组升高,差异均有统计学意义(P<0.05)。详见表2。
表2 同一浓度不同作用时间CSE对sEPCR的影响(±s) 单位:pg/mL
3 讨 论
血管内皮是人体重要的组成部分,相关研究已发现其具有多种生理功能,可维持血管通透性、调节白细胞和血小板黏附、维持血管细胞增殖、抗凝等作用,血管内皮既是血液和组织之间的天然屏障,也是人体最大的自分泌和旁分泌器官[1,9],能合成和分泌多种抗凝和促凝因子,对维持凝血系统的平衡具有直接或间接作用,是血栓形成中重要的调节物质。血管内皮对血液成分和血流变化敏感,较多因素和相关疾病如吸烟、高脂血症、高血压、糖尿病等均可引起血管内皮功能障碍[1,10-11],导致凝血和纤溶功能失衡。其中吸烟是重要的危险因素之一。
香烟烟雾包含超过5 600个不同成分[12],其中200多个确定为致癌物和呼吸道毒素。吸烟是心血管疾病的独立危险因素,导致血管内血栓形成,与急性冠脉综合征和心源性猝死发生率增加有关[13]。尸检和临床研究表明,吸烟对受损的内皮细胞具有直接毒性作用,对动脉血栓的形成有重要作用,导致止血系统改变,血小板反应性增加,与动脉粥样硬化血栓形成有关[14-15],血栓形成受抗凝和止血系统影响。然而,吸烟通过抗凝系统引起血栓形成的机制尚不清楚[16]。
血液凝血是一系列酶促连锁反应过程,其中高分子激肽原、因子Ⅴ和因子Ⅷ是血液凝血过程的限速因素。蛋白C系统是针对因子Ⅴ和因子Ⅷ的抑制物,在人体抗凝过程中发挥重要作用,凝血酶激活凝血过程,引起血小板活化,与内皮细胞表面血栓调节蛋白结合后,启动蛋白C抗凝系统。活化蛋白C一方面与辅因子蛋白S结合,灭活因子Ⅴa和Ⅷa,限制凝血酶产生;另一方面通过加速溶解组织纤维蛋白溶解酶原依赖性血凝块,从而发挥纤溶作用。EPCR是体内蛋白C系统新发现的成员[17],可选择性地表达于大血管内皮细胞,不仅与蛋白C和活化蛋白C特异结合,提高蛋白C活化效率,还参与防御炎症反应和抗凋亡等过程,是近年来发现的在炎症和抗凝过程中具有重要意义的多功能糖蛋白[18]。EPCR分为两种,一种是内皮细胞表面的膜联EPCR,一种是血浆中sEPCR,两者对蛋白C/活化蛋白C的亲和力相同,但作用相反,sEPCR抑制蛋白C/活化蛋白C活性,抑制活化蛋白C对凝血因子Ⅴa和Ⅷ的灭活作用。
EPCR表达具有组织特异性,在胎盘、肝、肺和心肌组织呈高表达[1,19],表明血管内皮细胞EPCR表达水平与组织发生血栓概率有关。故本研究选择HUVECs作为细胞模型,通过观察不同实验条件CSE对体外培养的HUVECs表达sEPCR含量变化[1],从细胞水平揭示吸烟对血管内皮凝血功能的影响[16,20]。有研究表明,CSE呈剂量依赖性降低HUVECs存活率[1,21]。本研究结果显示,10.0%CSE组HUVECs存活率与0%CSE组相比明显下降,而5.0%CSE对HUVECs存活率基本无影响,5.0%、10.0%CSE与细胞共同孵育后,与0%CSE组相比,上清液sEPCR明显升高,差异有统计学意义(P<0.05),5.0%与10.0%CSE比较差异无统计学意义(P>0.05),2.5%CSE组与0%CSE组相比,sEPCR表达下降,但差异无统计学意义(P>0.05),说明高浓度CSE与细胞共同孵育后,引起内皮细胞部分死亡,而低浓度CSE对内皮细胞的损害不大,与以往研究结果[1,22]一致。因此,本研究采用5.0%CSE为最佳浓度,以最佳浓度CSE孵育细胞,观察不同时间后sEPCR含量变化,结果显示:随着时间延长,上清液sEPCR含量逐渐增高,且不同时间5.0%CSE组sEPCR蛋白含量均高于对照组,其中8 h、12 h及24 h sEPCR表达较对照组升高,差异均有统计学意义(P<0.05),提示CSE对HUVECs表达sEPCR的影响在一定范围内呈时间依赖性。
综上所述,内皮细胞损伤与CSE作用密切相关,CSE导致sEPCR升高,抑制蛋白C/活化蛋白C活性,引起凝血功能障碍,从而导致血栓性疾病的发生,本研究为进一步探讨血栓性疾病提供了实验基础。

