miR-210介导的Bcl-2下调促进动脉粥样硬化内皮细胞凋亡的机制*
任丽, 刘婷, 吴锡骅
(禅城区中心医院 神经内科, 广东 佛山 528031)
动脉粥样硬化是老年人的常见病,在全球范围内每年约有2 000万人死于该疾病,其主要的病理表现为粥样硬化的动脉局部有高脂质积聚、纤维组织增生、多泡沫细胞和高炎症的特征[1]。动脉粥样硬化的形成机制十分复杂,相关研究显示,血浆中生成大量氧化修饰的低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)是导致动脉粥样硬化生成的主要因素,血管内皮细胞通过ox-LDL的处理可构建动脉粥样硬化细胞模型[2-3]。内皮细胞的损伤和凋亡在动脉粥样硬化的发病和发展中起关键作用,内皮细胞的损伤和凋亡会破坏内皮的完整性,使其不能发挥免疫功能以抵抗炎症,致使斑块不稳定,并最终导致急性冠状动脉闭塞和猝死[4-7]。microRNA(miRNA)是18~22个核苷酸的非编码RNA,相关研究指出miRNA可通过靶向调控细胞凋亡途径中的关键因素而成为动脉粥样硬化发病及发展的重要调控因子[8-10]。最近一项研究指出,miR-210在闭塞性动脉硬化患者的血清样品中过表达,而后又进一步证明了miR-210在人动脉粥样硬化斑块中表达上调,这些可能与动脉粥样硬化的发生有关[11],但其作用机制仍不清楚。本研究根据相关文献对人主动脉内皮细胞(human aortic endothelial cells ,HAECs)进行ox-LDL处理、构建动脉粥样硬化细胞模型,探讨miR-210介导的Bcl-2下调促进动脉粥样硬化内皮细胞凋亡的机制。
1 材料与方法
1.1 材料
人主动脉内皮细胞HAECs购自美国典型培养物保藏中心(ATCC),DMEM培养基、胎牛血清购自美国GIBCO公司,Lipofectamine 2000试剂购自美国Invitrogen公司,miR-210 minic (模拟物)、miR-210 inhibitor (抑制剂)及空对照均购自广州锐博生物技术有限公司,ox-LDL购自北京协生生物科技有限公司,qTR-PCR实验试剂盒均采购自美国TaqMan公司,CCK-8检测试剂盒购自美国Sigma公司,凋亡检测试剂盒购自美国Becton-Dickinson Biosciences公司,BCA试剂盒购自碧云天生物技术研究所,一抗、二抗购自美国CST公司,Bcl-2 3′-UTR报告质粒(pRL-Bcl-2)购自美国Creative Biogene公司,Lipofectamine 2000转染试剂购自美国Thermo公司,萤光素酶报告基因检测试剂盒购自美国Promega公司。
1.2 方法
1.2.1分组 将HAECs在含有10%胎牛血清的DMEM培养基中培养,并放置于37 ℃,5%CO2培养箱中,24 h换1次液,隔天传代1次;取对数生长期细胞根据相关文献[12]用或不用100 ng/L ox-LDL对细胞处理24 h,分为对照组(Control组)、动脉粥样硬化内皮细胞模型组(ox-LDL组)、miR-210模拟物及抑制剂组,每组10个培养皿。
1.2.2CCK-8细胞活力实验 根据试剂盒制造商的说明,将Control组和ox-LDL组细胞以5×107/L的密度接种在96孔板中。24 h后,加入CCK-8溶液(20 mL /孔),在37 ℃下孵育2 h。用酶标仪测定450 nm波长处的吸光度(OD值),并通过下列公式计算细胞活力:细胞活力(%)=[A(加药)-A(空白)]×100%÷[A(不加药)-A(空白)]。
1.2.3细胞凋亡实验 将相应组别细胞分别(5 000个细胞/孔)接种在96孔板中,24 h后收集所有细胞于离心管内,以1 000 r/min离心2次,每次离心5 min,PBS洗涤。按试剂盒说明进行AV/PI抗体孵育,20 min后使用流式细胞仪检测,并分析细胞凋亡率。
1.2.4qRT-PCR实验 根据试剂盒的说明,从不同细胞中提取miRNA;以miRNA为模板,应用反转录试剂盒进行RT-PCR合成cDNA;以合成的cDNA作为模板,按照TaqMan®MicroRNA Assays试剂盒的说明进行qPCR定量相应细胞miR-210的含量;并以GAPDH作为内源对照,引物序列如下:GAPDH上游序列为CCCATGTTCGTCATGGGTGT、下游序列为CCCATTCCCCAGCTCTCATA。miR-210上游序列为CUGUGCGUGUGACAGCGGCU、下游序列为AUUCGGCGACAGUGUGCGUG。
1.2.5Western blot实验 收集相应细胞在蛋白裂解液中裂解30 min,在4 ℃下以12 000 r/min离心15 min;而后根据试剂盒说明定量各组细胞蛋白浓度,使用10%十二烷基硫酸钠-聚丙烯酰胺凝(SDS-PAGE)电泳分离等量的蛋白质,在4 ℃的条件下进行300 mA恒流转膜(PVDF膜);将膜在室温下,5%脱脂牛奶中封闭1 h,在4 ℃下用Bcl-2以及β-actin一抗过夜孵育,加入二抗在室温下保持1 h,显像分析。
1.2.6miRNA靶标的分析及荧光素酶报告基因检测 使用TargetScan算法对miRNA靶标进行了分析[12]。将人主动脉内皮细胞HAECs接种在96孔板中(每孔5×104个细胞),使用Lipofectamine 2000转染试剂将miR-210模拟物(miR-210 mimic)、miR-210抑制剂(miR-210 inhibitor)根据试剂盒的说明分别转染,而后再使用Lipofectamine 2000转染试剂将0.5 μg Bcl-2 3′-UTR报告质粒(pRL-Bcl-2)转染进经miR-210修饰的细胞中;共转染48 h,根据说明书,使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.3 统计学分析
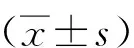
2 结果
2.1 细胞活力
通过CCK-8实验检测细胞活力,结果显示,经ox-LDL处理过的HAECs细胞活力低于对照组,差异有统计学意义(P<0.05)。见表1。
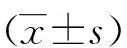
表1 ox-LDL处理后各组HAECs细胞活力Tab.1 The viability of HAECs cells after treatment with ox-LDL in each
2.2 细胞凋亡
通过AV/PI双染法结合流式细胞术实验检测细胞的凋亡,结果显示,经ox-LDL处理过的HAECs细胞的凋亡水平(51.19%±4.15%)高于对照组(15.31%±3.22%),差异有统计学意义(P<0.05)。miR-210抑制剂组细胞的凋亡水平(69.85±5.21)%高于miR-210模拟物组(12.79±2.15)%,差异有统计学意义(P<0.05)。见图1。
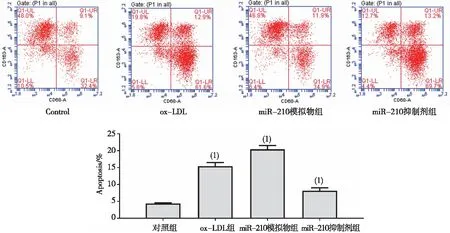
注:(1)与Control组比较,P<0.05。图1 各组HAECs细胞的凋亡水平Fig.1 The apoptosis levels of HAECs cells in each group
2.3 Bcl-2表达
Western blot结果显示,经ox-LDL处理过的HAECs细胞的Bcl-2表达低于对照组,差异有统计学意义(P<0.05)。miR-210抑制剂组Bcl-2表达高于miR-210模拟物组,差异有统计学意义(P<0.05)。见图2。
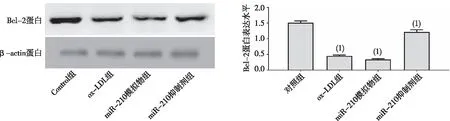
注:(1)与Control组比较,P<0.05。图2 各组HAECs细胞中Bcl-2表达Fig.2 Bcl-2 expression of HAECs cells in each group
2.4 miR-210表达
qRT-PCR结果显示,与对照组(NULL)相比,转染进miR-210模拟物(miR-210 mimic)后,miR-210表达升高,差异有统计学意义(P<0.05);转染进miR-210抑制剂(miR-210 inhibitor)后,miR-210表达降低,差异有统计学意义(P<0.05)。见表2。

表2 各组HAECs细胞的miR-210表达Tab.2 The expression of miR-210 of HAECs
2.5 不同方式转染后HAECs细胞Bcl-2 3′-UTR的相对荧光素酶活性
通过荧光素酶报告基因检测将Bcl-2 3′-UTR报告质粒(pRL-Bcl-2)转染进修饰过miR-210的HAECs细胞后的荧光素酶活性,结果显示,miR-210模拟物能抑制Bcl-2 3′-UTR报告基因的荧光素酶活性,差异有统计学意义(P<0.05);miR-210抑制剂能提高Bcl-2 3′-UTR报告基因的荧光素酶活性,差异有统计学意义(P<0.05)。见表3。

表3 不同方式转染后HAECs细胞Bcl-2 3′-UTR的相对荧光素酶活性Tab.3 The relative luciferase activity of Bcl-2 3′-UTR of HAECs cells with different
3 讨论
动脉粥样硬化是一种复杂的中大型动脉免疫炎性疾病[13]。内皮细胞、巨噬细胞及平滑肌细胞之间的串扰协调了动脉粥样硬化的发展[14-15];相关研究指出,血管内皮的损伤是动脉粥样硬化发病的第一步,而促动脉粥样硬化因子包括高葡萄糖,血管紧张素II,氧反应性物质及通过促进内皮细胞的凋亡进一步加速了病情的发展[16-17],其中ox-LDL的作用途径尚不明确。最近的很多报道都指出,异常表达的miRNA参与了内皮细胞死亡或存活的调控[18]。也有研究指出,miR-210与各种心血管疾病有关[19-20]。例如相关研究提示在高脂饮食的小鼠主动脉中miR-210过表达提高了心血管疾病和胃肠道癌的发病风险[21]。也有报道说,miR-210是在急性外周缺血中调节氧化代谢和氧化应激适应性机制中的关键元素[22],miR-210的过表达与调节脑缺血引起的血管生成有关[23]。研究证明miR-210是诊断动脉粥样硬化的潜在生物标志物[24]。而本研究的结果进一步显示了miR-210在动脉粥样硬化中的调节机制与促进内皮细胞凋亡有关。
miR-210是一种由低氧诱导表达的miRNA,已证实miRNA-210在低氧导致的血管新生过程中表达量明显上升,因此被称为低氧特异性miRNA(hy-poxamir),其表达比较稳定。参与血管生成的内皮miR-NAs,也被称为angiomiRs_2j,其中miR-210在细胞低氧时高表达,在组织缺血时,miR-210对调控内皮细胞血管化具有决定性的作用。有研究表明,miRNA调控内皮细胞凋亡的机制通常归因于靶向关键基因或与细胞凋亡相关的关键途径[25]。Bcl-2是细胞凋亡途径中关键的靶基因,有抑制细胞凋亡的作用,而其表达的降低反而会提高细胞的凋亡水平[26-27]。在本研究中,HAECs细胞经ox-LDL处理构建动脉粥样硬化细胞模型后,其细胞活力下降,凋亡水平升高,并且细胞中miR-210的表达升高,但抗凋亡关键蛋白Bcl-2下降,这表明动脉粥样硬化相关的内皮细胞凋亡可能是由增强的miR-210结合并抑制Bcl-2 mRNA的翻译而导致的Bcl-2下调所致。而后又通过生物信息学分析确认了Bcl-2是miR-210的潜在靶点,并通过实验对其进行了进一步验证,发现miR-210在动脉粥样硬化过程中通过介导抗凋亡蛋白Bcl-2调控内皮细胞凋亡。
综上所述,miR-210介导的Bcl-2下调促进了动脉粥样硬化内皮细胞的凋亡。对此,靶向miR-210可作为治疗动脉粥样硬化的创新疗法,课题组也将在后续的研究中不断进行探索。

