亚砷酸钠诱导SH-SY5Y细胞凋亡及硫化氢的干预作用*
潘际刚, 吴昌学, 齐晓岚, 范海琼, 李成, 朱卫
(1.贵州医科大学 基础医学院 生理学教研室, 贵州 贵阳 550025; 2.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
2019年7月23日,砷及砷化合物被列入有毒有害水污染物名录。贵州省属于地方性燃煤污染型砷中毒较严重病区[1],砷在神经系统的累积将引起活性氧的增加从而造成神经毒性损害。大脑由于不饱和脂肪酸的存在、解毒酶活性的降低等因素易遭受氧化应激损伤[2-3],本课题组前期实验已发现砷引起神经细胞的损害机制与H2S合成酶-巯基丙酮酸转移酶(MST)表达降低有关[4]。本次实验通过Hoechst33342/PI双染法和流式细胞术检测,发现NaHS对砷诱导的SH-SY5Y细胞凋亡有明显拮抗效应,从而验证外源性H2S的保护作用。
1 材料和方法
1.1 材料
SH-SY5Y细胞购于美国ATCC公司,DMEM培养基、胎牛血清购于美国Hyclone公司,NaHS、NaAsO2购于美国Sigma公司,细胞凋亡与坏死检测试剂盒购于碧云天生物技术研究所,AnnexinV FITC细胞凋亡检测试剂盒购自美国BD公司。
1.2 方法
1.2.1细胞培养及分组 取对数生长期SH-SY5Y细胞分为对照组、NaHS组、NaAsO2(20或40 μmol/L)组及NaHS+NaAsO2(NaHS预处理30 min)组,于10%胎牛血清和1%双抗的DMEM培养基中、37 ℃、5%CO2的培养箱中分别培养24、48 h后,进行后续检测。
1.2.2染色 取1.2项实验获得的SH-SY5Y细胞,PBS洗涤1次后取PI染色液5 μL、染色缓冲液1 mL和Hoechst33342液5 μL加入每孔。4 ℃孵育30 min进行染色,然后用PBS洗涤1次,在荧光显微镜下随机选取8个视野计算凋亡细胞数和细胞总数(每组不少于1 000个),计算凋亡率。
1.2.3细胞凋亡实验 取1.2项试验获得的SH-SY5Y细胞将1-5×106/mL细胞收集到10 mL的离心管中离心(1 000 r/min)5 min,弃去上清、用孵育缓冲液洗涤1次、等速离心5 min后,用标记溶液100 μL重悬细胞。在室温下避光孵育10 min、再次离心5 min、缓冲液洗1次后,再加入SA-FLOUS荧光溶液4 ℃孵育20 min。流式细胞术检测细胞凋亡,激发波长488 nm,FITC荧光波长515 nm,PI荧光波长大于560 nm。
1.2.4Western blot检测蛋白表达 提取细胞总蛋白,上样、12%SDS-PAGE电泳、转移至 PVDF膜上经脱脂奶粉封闭2 h后,加—抗(Cleaved caspase-12、Caspase-12和β-actin,1 ∶1 000)及二抗(1 ∶3 000、ECL显色曝光检测cleaved Caspase-12及Caspase-12蛋白表达。
1.3 统计学分析
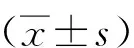
2 结果
2.1 Hoechst33342/PI双染对SH-SY5Y细胞凋亡形态的影响
荧光显微镜检测显示,随染砷浓度增加,24或48 h后SH-SY5Y 细胞核荧光染色显著增加(P<0.05);NaHS预处理可以逆转20或40 μmol/L NaAsO2暴露48 h对SH-SY5Y细胞核荧光增强效应(P<0.05,图1);NaHS预处理对24 h同等浓度砷暴露诱导的SH-SY5Y 细胞凋亡无明显影响(P>0.05,图1)。
注:(1)与对照组比较,P<0.05;(2)与20 μmol/L NaAsO2组比较,P<0.05;(3)与40 μmol/L NaAsO2组比较,P<0.05。图1 Hoechst33342/PI双染检测NaAsO2和NaHS对SH-SY5Y细胞的影响(200×)Fig.1 Effect of NaAsO2 and NaHS in SH-SY5Y cell apoptosis by Hoechst33342/PI double staining(200×)
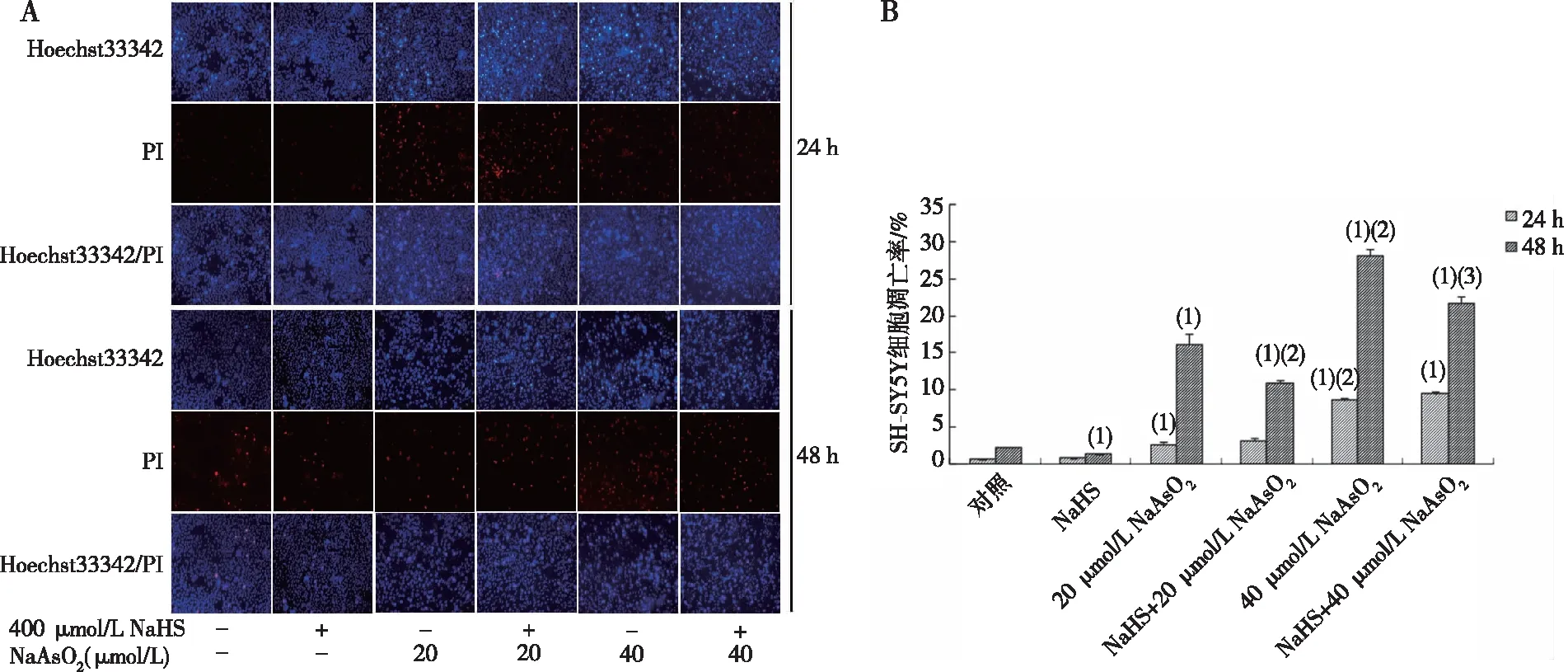
2.2 NaAsO2和NaHS对细胞凋亡的影响
流式细胞术结果显示,20和40 μmol/L NaAsO2作用24 h或48 h可浓度依赖性增加SH-SY5Y细胞的凋亡率,分别从(18.93±0.28)%升高到(37.8±1.46)%,从(33.13±0.57)%升高到(53.93±2.46)%(P<0.05,图2)。NaHS预处理可以逆转20和40 μmol/L NaAsO2暴露48 h对细胞凋亡率的影响,使NaAsO2诱导的凋亡率分别下降至(29.80±0.10)%和(40.53±2.94)%(P<0.05,图2);但对NaAsO2暴露24 h后增加的细胞凋亡无显著影响。

注:与对照组比较,(1)P<0.05, (2)P<0.01;(3)与20 μmol/L NaAsO2组比较,P<0.05;(4)与40 μmol/L NaAsO2组比较,P<0.05。图2 流式细胞术检测NaAsO2和NaHS对细胞凋亡的影响Fig.2 Effects of NaAsO2 and NaHS on cellular apoptosis by flow cytometric

注:(1)与对照组比较,P<0.05;(2)与20 μmol/L NaAsO2组比较,P<0.05;(3)与NaAsO2 40 μmol/L组比较,P<0.05;A为 NaAsO2暴露24 h, B为NaAsO2暴露48 h。图3 NaAsO2和NaHS对cleaved/Caspase-12 expresion的影响(Western blot)Fig.3 Effects of NaAsO2 and NaHS on cleaved/Caspase-12 expression levels (Western blot)
3 讨论
研究报道,H2S在健康和疾病的哺乳动物细胞中发挥着各种生物调节作用[6-10]。H2S通过增强谷胱甘肽底物、合成的限速酶活性、清除活性氧等来抵抗氧化应激带来的损害[11-14]。在本实验中通过H2S的供体NaHS对SH-SY5Y细胞砷暴露后的神经损伤进行干预,结果表明外源性H2S能拮抗氟诱导的细胞凋亡,这与本研究前期过表达MST增加内源性H2S发挥的保护效应相一致[5]。
Hoechst33342/PI双染法发现仅仅NaHS暴露48 h可降低细胞凋亡率,而流式细胞术检测,NaHS预处理24或48 h均不影响细胞凋亡率,似乎矛盾。实际上,本研究分析可能原因是荧光双染法镜下拍照是局部,侧重定性、形态学表现;而流式是针对所有细胞,侧重计数、较准确,两种检测手段不同因此出现这种差别。在本实验中,NaHS不能逆转低浓度20 μmol/L NaAsO2造成的细胞凋亡,但却能逆转高浓度40 μmol/L NaAsO2引起的细胞凋亡。研究表明,砷对人胚胎肺纤维母细胞存在双向效应,低浓度通过激活ERK1/2促进细胞生长;而高浓度则激活JNK促进细胞凋亡[15]。低浓度砷暴露的HaCat细胞通过GSK-3β/Cyclin D1,p21 and p27磷酸化促进细胞周期从G1向S/G2M期转换、促进细胞增殖[16]。这些实验结果提示,低浓度NaAsO2引起凋亡的机制不同于高浓度[17],或许是不能被H2S所逆转的一个原因。
Caspase-12是一种内质网膜结合蛋白,可以通过内质网应激多种途径激活,是内质网应激诱导细胞凋亡的特异性的调节因子;Caspase-12一旦被激活就可以启动下游的凋亡路径[18-19]。本实验中,砷暴露无论24还是48 h均可抑制Caspase-12蛋白表达;但是只有24 h砷暴露后cleaved Caspase-12表达升高,而48h砷暴露后cleaved Caspase-12蛋白表达无显著改变,提示剪切激活的Caspase-12仅在应激早期发生改变;并且在此时间窗口内增加的cleaved Caspase-12蛋白表达可被H2S拮抗。有报道,创伤引起的继发性心脏损伤时caspase-12最早激活,活性和表达在创伤后3 h明细升高,6 h达高峰;予caspase-12特异性抑制剂Z-ATAD-FMK则心肌凋亡明显降低[20]。然而,本实验发现,砷暴露48 h后cleaved Caspase-12未见改变,但细胞凋亡率可被H2S拮抗。有可能是过了Caspase-12激活的时间窗口所致。然而,砷暴露24 h后cleaved Caspase-12显著增加,可被H2S拮抗,但细胞凋亡率却未被拮抗,是何原因?目前尚不明了,有待进一步实验加以研究。

