MST过表达及亚砷酸钠对SH-SY5Y细胞的影响*
潘际刚, 吴昌学, 齐晓岚, 范海琼, 李成, 朱卫
(1.贵州医科大学 基础医学院 生理学教研室, 贵州 贵阳 550025; 2.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
研究表明,砷暴露可干扰人及大鼠神经祖细胞发育、导致学习和记忆障碍,砷对神经系统的损害已引起人们越来越多的关注[1-4]。本课题组前期研究发现,亚砷酸钠损伤神经细胞、抑制巯基丙酮酸硫转移酶-MST(内源性硫化氢合成酶)表达、增加细胞S期比例、升高P53蛋白水平,CyclinA、CDC25A与CDK2表达均下降;而外源性过表达MST蛋白可以拮抗砷所致的细胞S期阻滞、神经毒性损伤[5-6],然而,内源性H2S对抗神经细胞砷毒性损害的凋亡机制仍不十分清楚。本实验以MST基因过表达细胞为研究对象,建立NaAsO2损伤神经细胞模型,对砷诱导SH-SY5Y细胞凋亡的相关蛋白含量和活性进行分析,进一步探讨内源性H2S对抗砷诱导细胞损伤的保护机理。
1 材料与方法
1.1 材料
细胞来源于本室构建的稳定转染MST基因重组慢病毒载体的SH-SY5Y细胞株[7]。NaAsO2(美国Sigma公司),DMEM培养基、胎牛血清(美国Hyclone公司),抗Bcl-2多克隆抗体、抗Bax多克隆抗体(美国ImmoLunoWay公司),GAPDH多克隆抗体(杭州贤至公司),山羊抗兔IgG二抗(北京中杉金桥公司),Caspase3活性试剂盒(上海贝博公司),蛋白定量试剂盒(美国Thermo公司),ECL发光试剂(美国MilliPore公司)。
1.2 方法
1.2.1细胞分组及处理 将空载体转染细胞、MST基因过表达细胞各分为对照组、NaAsO2组、TUDCA(牛磺熊脱氧胆酸)组及TUDCA+NaAsO2组,将细胞暴露于0或50 μmoL/L NaAsO224 h后进行检测。TUDCA预处理细胞24 h后进行后续染砷实验。
1.2.2MTT检测细胞活力 将各组细胞铺96孔板,培养24 h后加药。于培养结束前4 h各培养孔加入5 mg/L MTT 10 μL培养4 h后,吸出每孔液体并加入150 μL DMSO,震荡10 min,用全自动酶标仪于波长570 nm处测定各孔吸光度值。
1.2.3Western blot检测凋亡相关蛋白 提取细胞总蛋白,将细胞蛋白上样、12%SDS-PAGE电泳、转移至 PVDF膜上经脱脂奶粉封闭2 h后,加—抗(Bcl-2、Bax和GAPDH,1 ∶1 000)及二抗(1 ∶3 000),ECL显色曝光。
1.2.4Caspase-3活性检测 收集细胞,用PBS洗涤3次,加入裂解缓冲液、涡旋震荡15 s、4 ℃离心5 min,上清转移离心管中。取上清液10 μL用酶标仪检测各组细胞中的Caspase-3活性。
1.3 统计学处理
2 结果
2.1 空转组细胞活力
NaAsO2处理空转染组细胞24 h后细胞活力明显下降,差异有统计学意义(P<0.01);而用1 mmoL/L内质网应激阻断剂TUDCA预处理细胞24 h后,则NaAsO2诱导的细胞损伤被有效逆转,差异有统计学意义(P<0.01)。见图1。

注:(1)与对照组比较, P<0.01;(2)与NaAsO2组比较,P<0.01。图1 空转组细胞活力在NaAsO2和TUDCA处理后的变化Fig.1 Changes of the cell viability after treatments with NaAsO2 and TUDCA in cells transfected with empty vector
2.2 空转组细胞Bcl-2、Bax表达和Caspase-3活性
如图2检测结果所示,空转染细胞在NaAsO2暴露24 h后,Bcl-2蛋白表达明显减少,Bax蛋白的表达明显增加,差异有统计学意义(P<0.01);NaAsO2诱导Bcl-2蛋白表达的下降和Bax蛋白的表达升高可被TUDCA预处理明显逆转(P<0.01)。同时,Caspase-3活性检测表明,NaAsO2诱导空转染细胞Caspase-3活性明显升高,差异有统计学意义(P<0.01),却被TUDCA预处理所完全逆转(P<0.01)。见图3。

注:(1)与对照组比较,P<0.01; (2)与NaAsO2组比较,P<0.01。图2 空转组Bcl-2和Bax表达在NaAsO2和TUDCA处理后的变化Fig.2 Changes of the protein expression levels of Bcl-2 and Bax after treatments with NaAsO2and TUDCA in cells transfected with empty vector

注:(1)与对照组比较,P<0.01;(2)与NaAsO2组比较,P<0.01。图3 空转组Caspase-3活性在NaAsO2和TUDCA处理后的变化Fig.3 Changes of the Caspase-3 activity after treatments with NaAsO2 and TUDCA in cells transfected with empty vector
2.3 MST过表达细胞活力
MTT结果表明,过表达MST蛋白的细胞经NaAsO2暴露24 h,细胞活力并无显著性改变,差异无统计学意义(P>0.05);TUDCA预处理对NaAsO2暴露或不暴露细胞活力均无显著性影响,差异无统计学意义(P>0.05)。见图4。
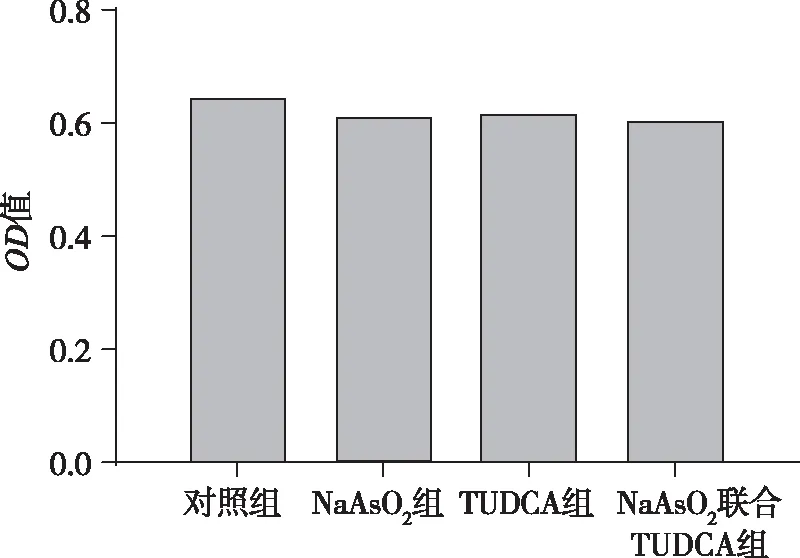
图4 MST过表达细胞活力在NaAsO2和TUDCA处理后的变化Fig.4 Effects of MST overexpression on the cell viability after treatments with NaAsO2 and TUDCA
2.4 MST过表达细胞Bcl-2、Bax表达和Caspase-3活性
Western Blot结果表明,NaAsO2诱导过表达MST蛋白的细胞Bcl-2表达明显增加,差异有统计学意义(P<0.01,图5A);而Bax蛋白表达比较,差异无统计学意义(P>0.05,图5B)。TUDCA预处理则逆转了NaAsO2对Bcl-2蛋白的升高效应,差异有统计学意义(P<0.01,图5A),但不影响Bax蛋白的表达(P>0.05,图5B)。Caspase-3活性检测显示,过表达MST蛋白的细胞经NaAsO2暴露24 h,Caspase-3无显著变化,差异无统计学意义(P>0.05);并且TUDCA预处理后暴露或不暴露于NaAsO2对Caspase-3活性均没有影响,差异无统计学意义(P>0.05)。见图6。

注:(1)与对照组比较, P<0.01; (2)与NaAsO2组比较,P<0.01。图5 MST过表达对SH-SY5Y细胞Bcl-2和Bax的影响Fig.5 Effects of MST overexpression on the protein expressions of Bcl-2 and Bax in the SH-SY5Y cells

图6 MST过表达对SH-SY5Y细胞Caspase-3活性的影响Fig.6 Effects of MST overexpression on Caspase-3 activity in the SH-SY5Y cells
3 讨论
在生物体内存在促凋亡和抗凋亡双向调节,决定细胞生存或凋亡。Bcl-2家族中的促凋亡蛋白Bax和抗凋亡蛋白Bcl-2在调控凋亡方面发挥着重要的作用[8]。研究发现,Bcl-2的降低和Bax的增加参与了As2O3诱导的肿瘤发生[9-10]。据报道,在饮水染砷动物模型,NaAsO2诱导了大鼠Morris水迷宫学习记忆的损害,导致血清、脑组织同型半胱氨酸(Hcy)含量显著增加,同时海马CA1区GRP78、Caspase-12等内质网应激标记蛋白的增加、Caspase-3表达上调、TuNEL阳性细胞增多,提示砷暴露造成海马内质网应激介导的细胞凋亡[11]。在本实验中进一步阻断内质网应激后,50 μmoL/L NaAsO2所诱导细胞活力下降、Bax表达、Caspase-3酶活性升高及Bcl-2表达水平的降低均被逆转,提示NaAsO2对SH-SY5Y神经细胞的毒性损害与内质网应激的诱导有关。
胱硫醚-β-合酶、胱硫醚-γ-裂解酶和MST是H2S的3种内源性合成酶。其中MST在体内具有重要的生理功能[12-16]。同型半胱氨酸(Homocycteine,Hcy)是阿尔茨海默病高发因素;而H2S供体NaHS能够拮抗Hcy对PC12细胞的损伤发挥一定保护效应[17-18]。有报道,腹腔注射NaHS可增加铀暴露大鼠抗凋亡蛋白Bcl-2,而减少促凋亡蛋白Bax的表达,升高 Bcl-2/Bax比值[19]。本课题组发现,NaAsO2可逐渐降低PC12细胞内的H2S水平;NaAsO2增强促凋亡蛋白Bax的表达及抑制抗凋亡蛋白Bcl-2的表达效应可被外源性H2S所逆转。过表达MST在SH-SY5Y细胞能发挥同样的保护效应,提示H2S参与保护SH-SY5Y神经细胞砷毒性损伤可能与降低Hcy水平、Bax表达,增加Bcl-2表达有关。有意思的是,MST过表达并不改变细胞活力、Bax蛋白含量及Caspase-3活性在细胞染砷后的变化,而且Bcl-2的表达水平仍高于染砷前,但可被TUDCA所拮抗;然而TUDCA单独处理并不影响细胞活力、凋亡相关蛋白及Caspase-3的活性。这提示砷诱导SH-SY5Y神经细胞发生内质网应激依赖的细胞损害;然而,内质网应激可能参与MST过表达拮抗砷所致毒性损伤的现象仍有待进一步的实验加以证实。
——疾病防治的新靶标

