经颈动脉、尾静脉骨髓间充质干细胞移植治疗慢性肾脏病大鼠效果对比观察
万珊杉,马逸群,吴思颖,简远熙,杨帆,张文卿,王丽娟,王家平
1云南昆钢医院 大理大学第七附属医院,昆明650300;2昆明医科大学第二附属医院
慢性肾脏病(CKD)是各种肾脏疾病的终末阶段,尚缺乏有效的治疗手段[1]。多项研究证实,具有多向分化潜能的干细胞具有向受损组织、器官趋化的潜能,可以高度增殖,被认为是促进组织再生修复、治疗全身疾病的潜力治疗方法[2]。目前针对骨髓间充质干细胞(BMSC)的研究较多,然而不同方式移植BMSC对CKD的治疗效果有所差异。2019年3~10月,本研究对比观察了经颈动脉、尾静脉BMSC移植治疗CKD大鼠的效果。现报告如下。
1 材料与方法
1.1 动物与主要实验材料 雄性SD大鼠122只,其中4周龄大鼠2只,体质量(55±5)g,用于BMSC制备;14周龄大鼠120只,体质量(320±20)g,用于治疗实验观察。阿霉素购自Sigma公司,胎牛血清、L-DMEM、PBS缓冲液购自Gibco公司,PE10导管购自福州赛思生物有限公司,造影剂购自辰欣药业有限公司。Siemens AXIOM-Artist DSA机,日立7170A型全自动生化分析仪。
1.2 BMSC的分离、培养 将2只4周龄SD大鼠脱颈处死,大鼠置于乙醇溶液中浸泡5 min,取股骨和胫骨,充分分离肌肉组织,剪去两侧干骺端,用PBS反复冲洗骨髓腔,收集细胞悬液于50 mL离心管中,以1 000 r/min离心5 min。倒掉上清液,用完全培养基重悬沉淀细胞后接种于25 cm2细胞培养瓶并置于37 ℃、5% CO2培养箱中,此后每2~3 d换液1次,10 d后传代。取第4~6代细胞备用。BMSC混悬液置于4 ℃保存,将细胞自冰箱取出到入体时间间隔控制在2 h内。
1.3 模型制作与分组处理 120只大鼠中,30只大鼠不制作模型,为正常组。90只大鼠按照杨维娜等[3]的方法建立CKD模型,模型制作成功标准参考文献[4]。将造模成功后的大鼠随机分为颈动脉组、尾静脉组和生理盐水组各30只。造模成功后的大鼠术前禁食8 h。颈动脉组采用1%戊巴比妥钠腹腔注射麻醉大鼠,取仰卧位固定;自甲状软骨下缘沿正中线偏左0.5 cm处做切口,分离暴露舌骨肌群;于气管左侧打开颈动脉鞘,分离左颈总动脉2 cm,穿两根丝线备用;结扎远端缝合线,将动脉下的近心端缝合线提起,镊柄平托分离动脉段,用显微剪在颈总动脉上做“V”形切口;X线透视下将导管送入左颈总动脉,经主动脉弓、降主动脉到达腹主动脉;造影确定导管位于肾动脉开口处,输注2 mL混悬液,BMSC总数2×106个。尾静脉组采用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,进行尾静脉穿刺,向尾静脉注射BMSC,剂量同颈动脉组。生理盐水组经颈动脉插管输注等量生理盐水。
1.4 大鼠生存情况观察 术后密切观察大鼠的生命体征、活动状态及毛发颜色。注意大鼠保暖,给予充足的饮用水和饲料,及时更换垫料。每日记录各组大鼠体质量变化、腹泻情况及有无腹水。
1.5 肾功能指标监测 收集各组术后1、7、14 d的24 h尿液离心去除沉淀,在全自动生化分析仪上检测24 h尿蛋白。采集大鼠眼内眦静脉血,获得血清,在全自动生化分析仪中检测肌酐(Cr)、尿素氮(BUN)、白蛋白。
1.6 肾组织病理观察 各组大鼠于术后15 d脱颈处死并取肾脏,多聚甲醛固定并经乙醇梯度脱水后采用石蜡包埋,将标本用石蜡切片机切成6 μm厚度切片。脱蜡后苏木精染色3 min,水冲洗后再用伊红染色1 min,中性树胶封片,镜下观察肾组织病理变化。
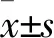
2 结果
2.1 大鼠生存情况 颈动脉组、尾静脉组、生理盐水组大鼠均于术后2~3 h苏醒,术后6 h左右基本清醒,术后24 h可正常活动及进食,手术切口于术后3~4 d愈合,未发现切口感染。各组大鼠均存活。颈动脉组、尾静脉组、生理盐水组大鼠于注射阿霉素后第4天陆续出现腹泻,第14天开始出现腹水。经BMSCs移植治疗后,颈动脉组与尾静脉组食欲较生理盐水组旺盛,体质量增长较快,毛发较光滑;生理盐水组明显食欲不佳,毛发毛糙,体质量增长较慢。
2.2 各组肾功能指标比较 由表1可见,颈动脉组、尾静脉组术后7、14 d血BUN和24 h尿蛋白量、血清白蛋白水平逐渐降低,Cr呈增高趋势(P均<0.05)。颈动脉组、尾静脉组术后14 d血BUN、Cr、24 h尿蛋白量低于生理盐水组,血清白蛋白水平高于生理盐水组;颈动脉组术后14 d血BUN、Cr、24 h尿蛋白量低于尾静脉组,血清白蛋白水平高于尾静脉组(P均<0.05)。
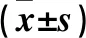
表1 各组术后不同时点血BUN、Cr、白蛋白、24 h尿蛋白水平比较
2.3 各组肾组织病理变化比较 正常组肾小球、肾小管和肾间质未见明显病理改变(图1a)。生理盐水组可见肾小球系膜区增宽,系膜细胞不同程度增生,肾间质有局灶纤维化,可见萎缩肾小管,部分肾小管出现空泡变性征象,肾小球出现局灶节段性硬化,部分肾小管上皮细胞脱落(图1b)。颈动脉组肾小球、肾小管改变较生理盐水组明显改善,肾间质可见炎细胞浸润,部分肾小管扩张,且肾小管无明显萎缩,肾间质纤维化不明显,较少出现炎细胞(图1c)。尾静脉组较生理盐水组肾小球无明显黏连,肾小球毛细血管襻扩张(图1d)。

注:1a为正常组;1b为生理盐水组;1c为颈动脉组;1d为尾静脉组。
3 讨论
CKD是一个日益严重的全球公共卫生问题,具有高致残率和高病死率[5]。再生医学的飞速发展为肾脏疾病的治疗提供了新的手段[6]。BMSC是一类来源于骨髓的、具有高度自我更新能力和多分化能的多能干细胞。BMSCs具有免疫调节能力,在一定诱导条件下,BMSC在体内外均可分化为成骨、软骨、脂肪、心肌、神经等组织,可定向迁移至损伤或炎症部位,改善组织学损伤程度,并增强受损器官功能[7]。另外,BMSC不会诱导T细胞反应性增生,所以不会引起异体免疫排斥[8]。由于BMSC具有自我更新特性、免疫原性低、体外扩增能力强、不涉及伦理道德问题、易于转染外源基因及可多向分化等特点,BMSC移植成为一种治疗肾病非常具有前景的方法,并日益得到重视。
向CKD动物模型输注干细胞是常用的实验步骤,传统采用操作简单的经尾静脉注射法缺点是难以确定经静脉循环到达双肾干细胞的具体剂量,只能粗略估计输注至大鼠体内的总量,难以通过实验数据精准获得干细胞治疗CKD所需剂量[9]。选择靶器官血管(肾动脉)注射的方法,在实践过程并不可行,动物常因无法止血而死亡。有学者[10]报道了经左侧颈动脉插管、开腹后将肠管取出,用棉签辅助导管插管进入肾动脉进行靶向注射的方法,但该方法在实践中操作困难,实验完成后大鼠可能因腹腔感染、肠梗阻等原因死亡。结合临床常用介入手术材料自制新型导管应用于大鼠实验亦可见报道[11],但实践难度略高,需结合大量操作经验和反复实验才能普及。
本实验选用的颈动脉输注干细胞的方法结合并改良了其他实验者的经验[12,13],我们选择经介入手术穿刺后靶向插入导管,在肾动脉开口处输注BMSC,至腹主动脉水平,导管管径与大鼠腹主动脉管径大致相同,由于顺血流方向,绝大部分BMSC将流入双侧肾动脉。在无需开腹前提下,此法可视为较为精准而损伤小的干细胞靶向输注方法。为提高大鼠术后存活率,操作中应注意以下几点:将导管尖端剪一斜口,在操作中应使尖端稍向内侧,避免损伤血管壁造成血肿或大出血;当导管前端到达主动弓时,很容易误入升主动脉造成导管盘入心脏发生意外,当阻力明显时可退回稍加旋转,使导丝弯头弯向左,这样导管能顺势进入降主动脉;操作过程中为减少出血,助手可用止血钳轻轻钳夹靠近心脏部分血管,为插管暴露清晰视野;术中在大鼠身下垫一恒温毯保暖,有助于大鼠术后恢复;游离颈总动脉长时间暴露于空气中会使血管壁紧贴导管,使导管进退时损伤、撕裂血管,可用生理盐水浸泡后的湿纱布覆盖切口,保持湿润。
本实验结果显示,经BMSC移植治疗后,颈动脉组与尾静脉组食欲较生理盐水组旺盛、体质量增长较快、毛发较光滑,而生理盐水组明显食欲不佳、毛发毛糙、体质量增长较慢,表明BMSC移植后起到一定效果,大鼠生存情况良好。我们分别于术后1、7、14 d检测各组血BUN、Cr、24 h尿蛋白、血清白蛋白,结果显示,颈动脉组、尾静脉组术后14 d血BUN、Cr、24 h尿蛋白量低于生理盐水组,血清白蛋白水平高于生理盐水组,其中,颈动脉组术后14 d血BUN、Cr、24 h尿蛋白量低于尾静脉组,血清白蛋白水平高于尾静脉组,这提示颈动脉组治疗效果较尾静脉组更具优势。在肾组织病理变化方面,颈动脉组和尾静脉组肾组织病理变化较生理盐水组减轻,其中颈动脉组肾小球、肾小管病变较生理盐水组明显改善,尾静脉组较生理盐水组肾小球无明显黏连,肾小球毛细血管襻扩张,进一步验证了BMSC移植的确切疗效。
结合上述结果,我们认为,经颈动脉和尾静脉BMSC移植治疗CKD大鼠均成功、有效,且经颈动脉BMSC移植效果优于经尾静脉途径。我们推测,这与BMSC靶向到达肾脏修复损伤细胞有一定关系。经尾静脉输注干细胞,细胞会随大鼠的血液循环流向全身,难以估计最终到达肾脏的干细胞数量。若能靶向输注干细胞至肾脏,将提高研究准确性及治疗效率,令研究结果更为可靠。因此,改良的经颈动脉靶向输注BMSC法在大鼠存活率及提高实验效率方面具有一定优势。

