蜂胶乙醇提取物通过p38 MAPK/NOX4信号通路对1型糖尿病大鼠肾脏的保护作用
罗影,左中夫,张俏,薛坤,刘畅,闵连秋
1型糖尿病(type 1 diabetes mellitus,T1DM)多发于儿童和青少年,其发病机制复杂,随着病程的延长,多引起糖尿病肾病(diabetic nephropathy,DN)[1]。DN为T1DM患者死亡的主要原因。T1DM患者发生DN多与遗传和环境因素有关,但仅仅针对以上因素并不能完全阻止DN的发生。氧化应激可使糖尿病患者机体代谢紊乱[2],从而引起活性氧异常增加,为DN发病的重要原因[3]。通过抑制T1DM小鼠氧化应激反应可明显减轻其引起的DN损伤[4]。蜂胶乙醇提取物(ethanol extract of Chinese propolis,EECP)富含黄酮类物质,是一种天然的抗氧化剂[5]。研究发现,EECP能降低血糖并发挥抗氧化功能[6]。EECP可直接调节糖尿病大鼠血糖,同时也可降低丙二醛(MDA),提高超氧化物歧化酶(SOD),对抗视网膜氧化应激损伤[7]。然而,EECP对T1DM大鼠肾脏的影响及作用机制尚不清楚。本研究通过链脲佐菌素(STZ)制备T1DM模型,对大鼠进行灌胃治疗,进而探讨EECP对T1DM大鼠肾脏的影响。
1 材料与方法
1.1 实验动物和主要试剂仪器SPF级雄性SD大鼠68只,6周龄,体质量180~220 g,购自锦州医科大学,编号:SCXK(辽)2009-2017。STZ购自美国Sigma公司;盐酸二甲双胍(施贵宝制药公司,规格0.5 g/片);EECP(西安西海生物科技公司,纯度98%);NADPH氧化酶4(NOX4)一抗(兔抗鼠)、pp38丝裂原活化蛋白激酶(MAPK)一抗(兔抗鼠)、p38 MAPK一抗(兔抗鼠)购自英国Abcam公司;MDA、SOD含量检测试剂盒购自北京索莱宝公司;HE染色试剂盒及Western blot山羊抗兔二抗购自北京碧云天公司。倒置显微镜(日本Olympus公司);石蜡切片机(德国SLEE公司);水平电泳仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 实验动物分组及模型制备大鼠采用单次腹腔注射质量分数为1.5%的STZ(55 mg/kg)诱导1型糖尿病大鼠模型,72 h后检测大鼠尾静脉空腹血糖,>16.7 mmol/L作为糖尿病模型[8]。其中,模型制备成功50只,失败8只,成模率为86.2%。将成功的糖尿病大鼠模型采用随机数字表法分成模型组、EECP 50 mg/kg组、EECP 100 mg/kg组、EECP 200 mg/kg组及二甲双胍组,每组10只。另外10只大鼠作为正常组。动物成模1周后给药灌胃,每日1次。依据文献[7],EECP 50 mg/kg、100 mg/kg、200 mg/kg组给予相应剂量EECP灌胃治疗,二甲双胍组给予二甲双胍75 mg/kg灌胃,药物溶剂为双蒸水,正常组和模型组给予等剂量双蒸水,给药体积为10 mL/g。实验期间监测大鼠血糖变化。未见大鼠死亡,实验遵循国家《实验动物管理条例》。12周后,处死大鼠用于各项指标检测。
1.2.2 标本采集12周治疗结束后,在同一时间点检测大鼠尾静脉空腹血糖,大鼠处死前麻醉固定,于心尖搏动最强处进针,利用心脏跳动血液进入注射器,每只大鼠取心脏血1 mL,离心取上清-20℃冻存,待测血肌酐(Scr)和尿素氮(BUN)。12周后,每组随机取5只大鼠,打开大鼠腹腔,用4%多聚甲醛经心脏固定自身组织,固定完成后取出肾脏进行石蜡包埋、切片。剩余5只大鼠处死后取完整肾脏做冠状切面,其中1/2依据质量加蛋白裂解液,冰上剪碎,4℃离心25 min后取上清,-20℃保存用于Western blot;另1/2与生理盐水按1∶4制成匀浆,3 000 r/min离心5 min,上清用于肾组织MDA含量、SOD活性检测。
1.2.3 血Scr和BUN及 肾 组 织MDA含 量、SOD活 性 的 检测Scr和BUN采用全自动生化分析仪检测,MDA含量、SOD活性采用相应试剂盒,具体步骤按照说明书执行。
1.2.4 HE染色经1.2.2制备的大鼠肾脏切片脱蜡后PBS洗3次;苏木素浸染,2 min,自来水冲洗;伊红浸染1 min,自来水冲洗;脱水透明后封片,倒置显微镜拍照观察大鼠肾脏病理改变。
1.2.5 免疫组化检测大鼠肾脏NOX4表达经1.2.2制备的大鼠肾脏石蜡切片脱蜡后于PBS洗3次;3%H2O2室温12 min,PBS洗3次,每次3 min;3%山羊血清室温孵育30 min;滴加兔抗大鼠NOX4(1∶800),4℃过夜;PBS洗3次,每次3 min;滴加二抗(1∶500),室温30 min;PBS洗3次,每次3 min;滴加SABC试剂,室温30 min;PBS洗3次,每次3 min;DAB显色,复染、脱水、透明封片后显微镜拍照,以胞质中出现棕褐色为阳性染色,每张切片在显微镜下取5个高倍视野,各计数200个细胞,计算平均阳性细胞百分比为NOX4表达阳性率。
1.2.6 Western blot检测大鼠肾脏NOX4、p-p38 MAPK及p38 MAPK相对表达量BCA法测定蛋白含量,电泳时加入15 μL样品;120 V电压电泳,转膜后1%BSA封闭2 h;加入一抗NOX4(1∶10 000)、p-p38 MAPK(1∶5 000)、p38 MAPK(1∶5 000),4℃孵育过夜;TBST洗4次,每次5 min;加入二抗室温孵育2 h;TBST洗4次,每次5 min;ECL显影,以β-tublin为对照,image J软件分析灰度值,蛋白相对表达=蛋白灰度值/内参灰度值×100%。
1.3 统计学方法采用SPSS 22.0统计软件进行分析,计量资料以均数±标准差(±s)表示,多组间计量资料比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
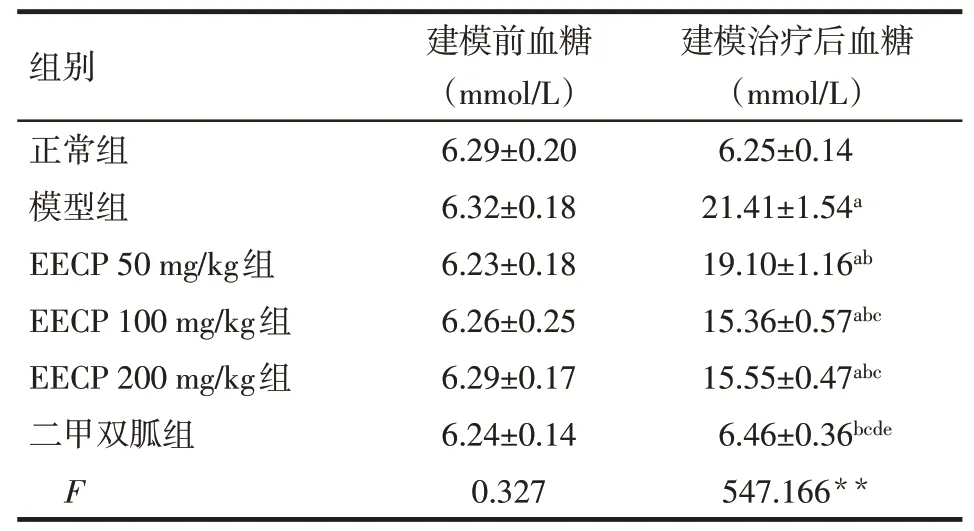
2.1 EECP对大鼠血糖的影响与正常组比较,模型组建模后血糖明显升高(P<0.05);与EECP 50 mg/kg组比较,EECP 100 mg/kg组、EECP 200 mg/kg组、二甲双胍组血糖明显降低(P<0.05);与EECP 100 mg/kg组和EECP 200 mg/kg组比较,二甲双胍组血糖明显降低(P<0.05);EECP 100 mg/kg组与EECP 200 mg/kg组、正常组与二甲双胍组建模后血糖比较差异无统计学意义,见表1。
Tab.1 Comparison of blood glucose before and after modeling in 6 groups of rats表1 6组大鼠建模前后血糖的比较(n=10,±s)
Tab.1 Comparison of blood glucose before and after modeling in 6 groups of rats表1 6组大鼠建模前后血糖的比较(n=10,±s)
**P<0.01,a与正常组比较,b与模型组比较,c与EECP 50 mg/kg组比较,d与EECP 100 mg/kg组比较,e与EECP 200 mg/kg组比较,P<0.05;表2~4同
组别正常组模型组EECP 50 mg/kg组EECP 100 mg/kg组EECP 200 mg/kg组二甲双胍组F建模前血糖(mmol/L)6.29±0.20 6.32±0.18 6.23±0.18 6.26±0.25 6.29±0.17 6.24±0.14 0.327建模治疗后血糖(mmol/L)6.25±0.14 21.41±1.54a 19.10±1.16ab 15.36±0.57abc 15.55±0.47abc 6.46±0.36bcde 547.166**
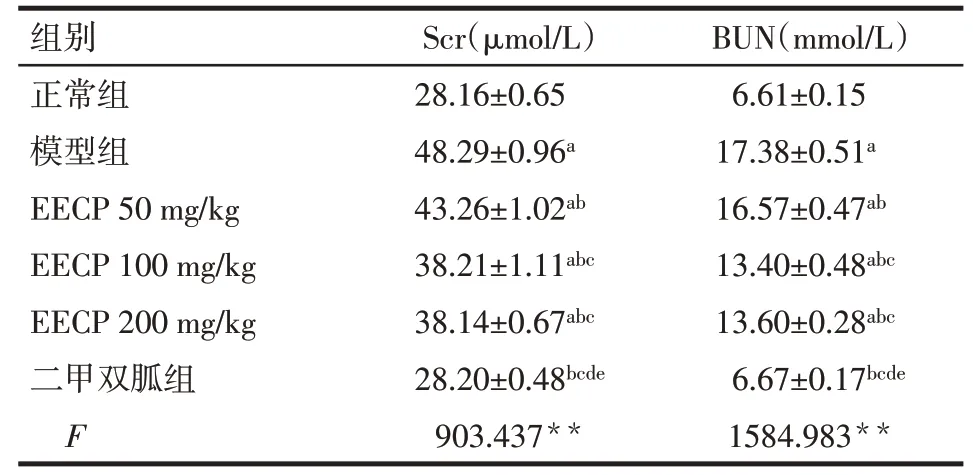
2.2 EECP对大鼠Scr与BUN含量的影响与正常组比较,模型组Scr、BUN明显升高(P<0.05);与EECP 50 mg/kg组比较,EECP 100 mg/kg组、EECP 200 mg/kg组、二甲双胍组Scr、BUN明显降低(P<0.05),与EECP 100 mg/kg组和EECP 200 mg/kg组比较,二甲双胍组Scr、BUN明显降低;EECP 100 mg/kg组与EECP 200 mg/kg组、正常组与二甲双胍组Scr、BUN比较差异无统计学意义,见表2。
Tab.2 Comparison of Scr and BUN contents between 6 groups of rats表2 6组大鼠Scr与BUN含量的比较(n=10,±s)
Tab.2 Comparison of Scr and BUN contents between 6 groups of rats表2 6组大鼠Scr与BUN含量的比较(n=10,±s)
组别正常组模型组EECP 50 mg/kg EECP 100 mg/kg EECP 200 mg/kg二甲双胍组F Scr(μmol/L)28.16±0.65 48.29±0.96a 43.26±1.02ab 38.21±1.11abc 38.14±0.67abc 28.20±0.48bcde 903.437**BUN(mmol/L)6.61±0.15 17.38±0.51a 16.57±0.47ab 13.40±0.48abc 13.60±0.28abc 6.67±0.17bcde 1584.983**
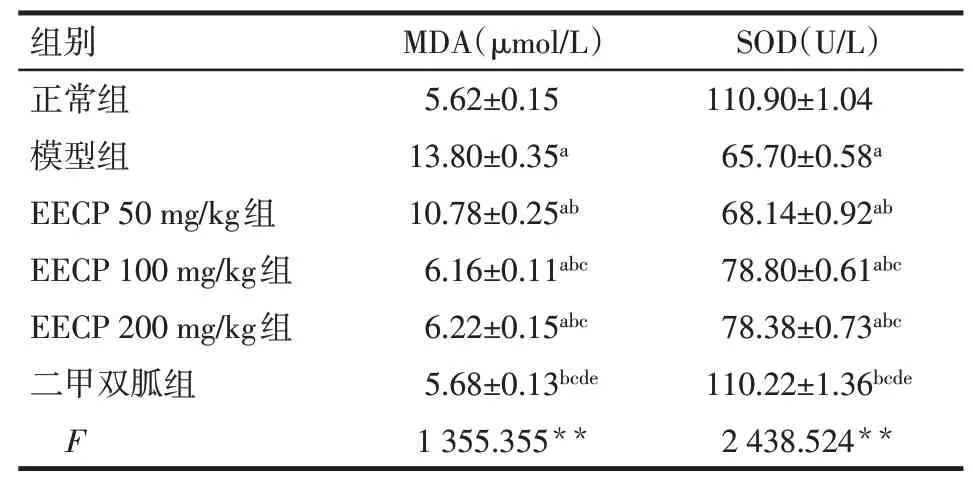
2.3 EECP对大鼠肾组织氧化应激的影响与正常组比较,模型组MDA升高、SOD降低(P<0.05);与EECP 50 mg/kg组比较,EECP 100 mg/kg组、EECP 200 mg/kg组、二甲双胍组MDA降低、SOD升高(P<0.05);与EECP 100 mg/kg组和EECP 200 mg/kg组比较,二甲双胍组MDA降低、SOD升高(P<0.05);EECP 100 mg/kg组与EECP 200 mg/kg组、正常组与二甲双胍组MDA、SOD比较差异无统计学意义,见表3。
Tab.3 Comparison of oxidative stress indexes between 6 groups of rats表3 6组大鼠氧化应激指标的比较(n=10,±s)
Tab.3 Comparison of oxidative stress indexes between 6 groups of rats表3 6组大鼠氧化应激指标的比较(n=10,±s)
组别正常组模型组EECP 50 mg/kg组EECP 100 mg/kg组EECP 200 mg/kg组二甲双胍组F MDA(μmol/L)5.62±0.15 13.80±0.35a 10.78±0.25ab 6.16±0.11abc 6.22±0.15abc 5.68±0.13bcde 1 355.355**SOD(U/L)110.90±1.04 65.70±0.58a 68.14±0.92ab 78.80±0.61abc 78.38±0.73abc 110.22±1.36bcde 2 438.524**
2.4 EECP对大鼠肾脏病理学的影响与正常组比较,模型组肾小球体积增大,细胞外基质增生,并可见肾小管上皮细胞水肿;与模型组相比,EECP 100 mg/kg组、EECP 200 mg/kg组及二甲双胍组肾小球体积明显减小,水肿明显减轻,见图1。
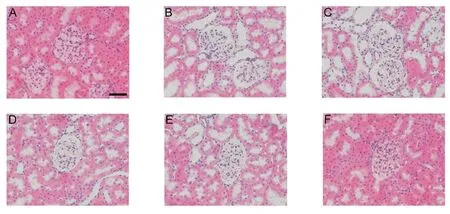
Fig.1 Effects of EECP on renal tissue structure of rats(HE staining,×400)图1 EECP对大鼠肾脏组织结构的影响(HE染色,×400)
2.5 EECP对大鼠肾 组 织NOX4、p-p38 MAPK及p38 MAPK蛋白相对表达的影响各组之间p38 MAPK表达差异无统计学意义(P>0.05)。与正常组比较,模型组NOX4阳性率、NOX4蛋白相对表达量、p-p38 MAPK蛋白相对表达量明显升高(P<0.05);与EECP 50 mg/kg组比较、EECP 100 mg/kg组、EECP 200 mg/kg组、二甲双胍组NOX4阳性率、NOX4蛋白相对表达量、p-p38 MAPK蛋白相对表达量明显降低(P<0.05);与EECP 100 mg/kg组和EECP 200 mg/kg组比较,二甲双胍组NOX4阳性率、NOX4蛋白相对表达量、p-p38 MAPK蛋白相对表达量明显降低(P<0.05);EECP 100 mg/kg组与EECP 200 mg/kg组、正常组与二甲双胍组比较差异无统计学意义,见图2、3,表4。
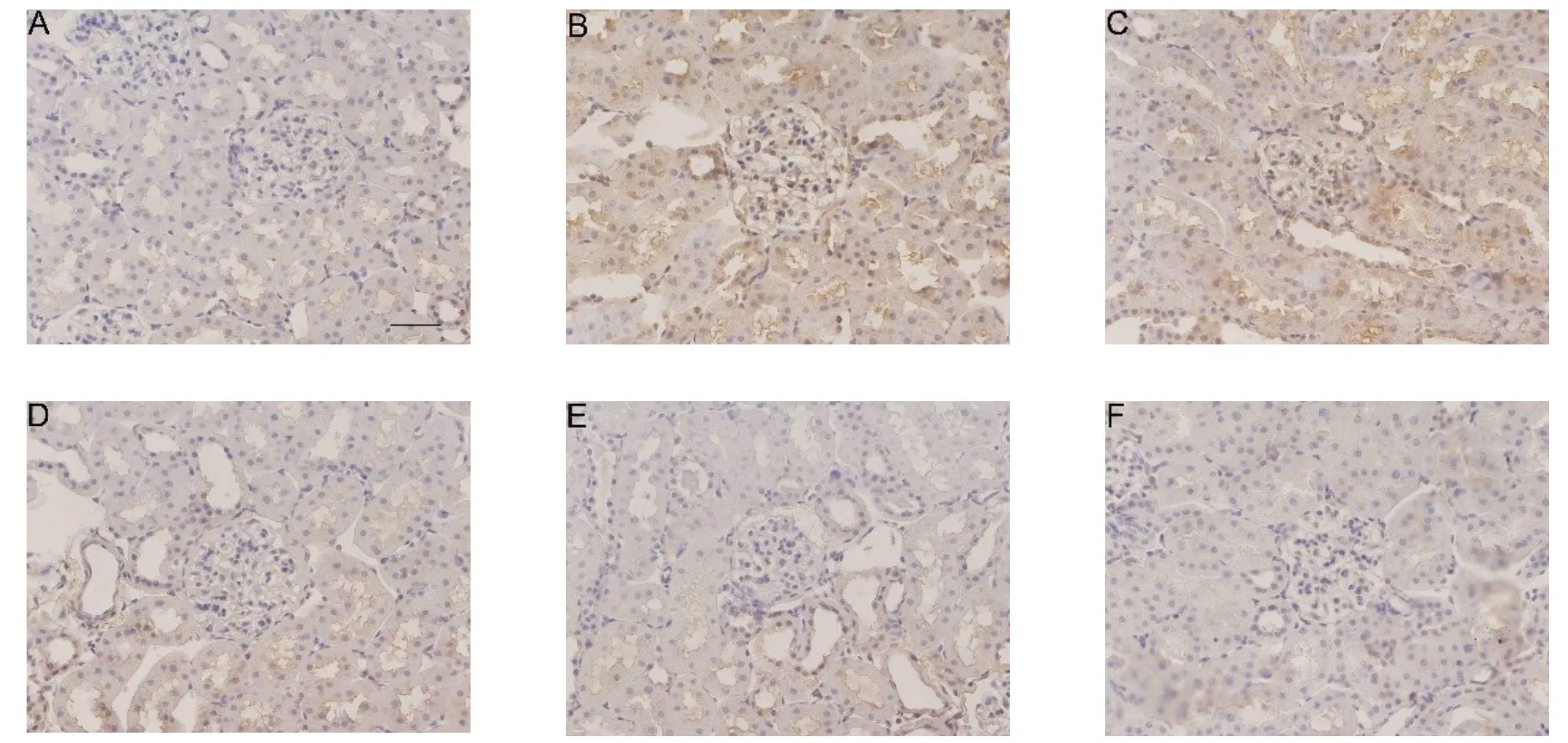
Fig.2 Effects of EECP on the expression of NOX4 in rat kidney(immunohistochemistry,×400)图2 EECP对大鼠肾脏组织NOX4表达的影响(免疫组织化学染色,×400)
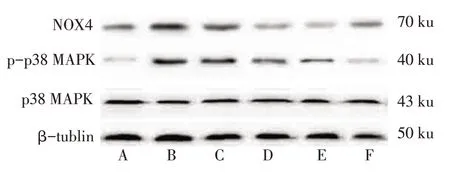
Fig.3 Western blot analysis the protein expressions of NOX4 and pp38 MAPK in rat kidney图3 Western blot检测大鼠肾组织NOX4及p-p38 MAPK蛋白相对表达
Tab.4 Comparison of the expressions of NOX4 and pp38 MAPK in the kidney tissues between 6 groups of rats表4 6组大鼠肾组织NOX4及p-p38 MAPK表达的比较(n=5,%,±s)
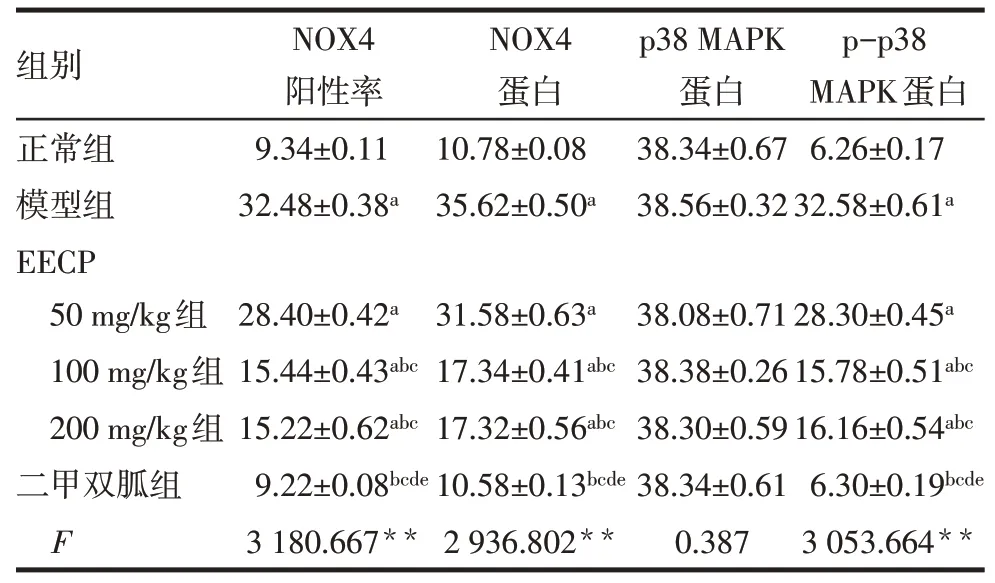
Tab.4 Comparison of the expressions of NOX4 and pp38 MAPK in the kidney tissues between 6 groups of rats表4 6组大鼠肾组织NOX4及p-p38 MAPK表达的比较(n=5,%,±s)
组别正常组模型组EECP 50 mg/kg组100 mg/kg组200 mg/kg组二甲双胍组F NOX4阳性率9.34±0.11 32.48±0.38a NOX4蛋白10.78±0.08 35.62±0.50a p38 MAPK蛋白38.34±0.67 38.56±0.32 p-p38 MAPK蛋白6.26±0.17 32.58±0.61a 28.40±0.42a 15.44±0.43abc 15.22±0.62abc 9.22±0.08bcde 3 180.667**31.58±0.63a 17.34±0.41abc 17.32±0.56abc 10.58±0.13bcde 2 936.802**38.08±0.71 38.38±0.26 38.30±0.59 38.34±0.61 0.387 28.30±0.45a 15.78±0.51abc 16.16±0.54abc 6.30±0.19bcde 3 053.664**
3 讨论
DN是世界范围内慢性肾损伤的主要病因之一,为血管性疾病的高危因素。DN的功能特点是肾小球滤过功能障碍和肾小球肥大。尿白蛋白排泄增加、Scr水平升高是评估DN患者肾功能的重要指标[9]。STZ诱导的糖尿病大鼠模型已广泛应用于其相关并发症的研究[10]。本研究成功地建立了DN大鼠模型,结果显示,模型组血Scr和BUN水平明显增加,肾小球体积增大,细胞外基质增生等病理改变,与以往关于DN的文献[11]报道相符。蜂胶具有多种药理作用,包括抗菌、免疫调节、抗氧化及抗炎等。EECP为蜂胶的提取物,其含有大量的酚醛和多酚化合物,因此具有较强的抗氧化活性[5]。EECP可直接调节糖尿病大鼠血糖,同时也可降低MDA含量、提高SOD活性进而对抗视网膜氧化应激损伤[7]。在本实验中,EECP100 mg/kg、200 mg/kg组及二甲双胍组可明显降低T1DM大鼠血糖、Scr和BUN水平,同时HE染色显示大鼠肾组织损伤程度明显减轻,验证了EECP对T1DM大鼠的治疗作用。然而,EECP100 mg/kg和200 mg/kg治疗效果之间差异并不明显,说明提高药物的剂量并不能增加其治疗效果。
慢性高血糖诱导的氧化应激在DN的进程中有重要作用。氧化应激的程度主要取决于活性氧的生成,特别是O2-和H2O2的生成,以及SOD和MDA在内的抗氧化防御系统之间的平衡[12]。文献报道,DN患者内源性抗氧化分子(包括SOD和谷胱甘肽过氧化物酶)明显减少,而MDA含量明显增加,最终引起活性氧增加,加速肾损伤进程[13]。肾脏容易受到氧化应激影响,活性氧水平的升高可直接造成肾脏损伤。Sameni等[14]研究发现,EECP可明显降低糖尿病大鼠体质量、血糖水平、肾小球基底膜厚度和肾小球面积,同时还可显著降低MDA含量,提高SOD,从而提高总抗氧化能力,这与本研究结果相一致。本研究发现,对DN大鼠给予EECP 50 mg/kg、100 mg/kg、200 mg/kg灌胃治疗后,显示出了明显的抗氧化作用,MDA含量明显下降,SOD活性明显增加,这提示EECP可能通过抗氧化应激对DN大鼠产生保护作用,但具体机制不清。
NOX4为肾细胞产生活性氧的重要分子,通过催化电子从NAPDH转移到分子氧而产生超氧阴离子[15]。NOX4引起的活性氧升高被认为能够促进肾脏系膜细胞和肾小管细胞细胞外基质的积累[16]。在STZ诱导的DN中,NOX4定位于肾皮质细胞的膜和线粒体,并大量表达[17]。此外,NOX4近来被认为能够加速DN动物模型肾损伤的进程,是糖尿病早期肾脏活性氧的主要来源,在足细胞中由于高血糖诱导而上调,下调NOX4对DN小鼠模型具有肾脏保护作用[18]。此外,NOX4抑制剂GKT137831可通过抑制肾小球肥大、减少尿白蛋白排泄和足细胞丢失而缓解DN的肾脏损伤[19]。有文献报道,MAPK家族中p38 MAPK表达的变化对氧化应激损伤尤为重要[20]。本研究进一步证实,DN状态下大鼠肾脏pp38 MAPK和NOX4表达明显上调,而给予EECP治疗后,可明显促进p-p38 MAPK和NOX4表达下调。在p-p38 MAPK和NOX4表达下调的同时,MDA含量明显下降,SOD活性明显增加,这提示EECP在一定程度上可以抑制p-p38 MAPK和NOX4的表达,进而通过抗氧化作用保护DN大鼠的肾脏。
综上所述,EECP可通过降低T1DM大鼠血糖、Scr和BUN水平,增强大鼠抗氧化能力进而缓解T1DM大鼠肾脏损伤,其机制可能与降低血糖和抑制p38 MAPK/NOX4信号通路有关。EECP治疗效果虽没有达到正常组标准,与二甲双胍治疗效果尚有差距,但为新药开发提供了更多的思路。

