IL-6、GATA6在大鼠肺动脉平滑肌细胞中的表达及对细胞增殖的影响
罗杰,刘维佳
肺动脉高压(pulmonary arterial hypertension,PAH)是由多种病因引起的以肺动脉压力和肺血管阻力进行性增高为特征的疾病[1]。肺血管重构是PAH重要的病理学改变,导致肺血管重构的关键在于肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)的异常增殖[2]。研究表明,炎症因子白细胞介素(IL)-6在促血管重构方面发挥重要作用[3]。此外,GATA6是唯一表达于血管平滑肌细胞(vascular smooth muscle cells,VSMC)的GATA家族转录因子,在细胞的增殖和分化中发挥调控作用。本研究通过血小板源性生长因子(platelet derived growth factor,PDGF)-BB诱 导 原 代 大 鼠PASMCs增殖,检测IL-6及GATA6表达水平变化,初探两者在PASMCs增殖中的作用及机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物8周龄SPF级雄性SD大鼠2只,体质量250~300 g,购自第三军医大学动物实验中心。
1.1.2 主要试剂DMEM细胞培养基、胎牛血清购自美国GIBCO公司;青-链霉素、胰蛋白酶购自美国Hyclone公司;Ⅰ型胶原酶粉购自美国Sigma公司;PDGF-BB为美国Peprotech产品;CCK8试剂为日本Dojindo产品;细胞周期检测试剂盒、BCA试剂盒为碧云天产品;IL-6、GATA6、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体,山羊抗小鼠IgG(Cy3)二抗为美国Abcam产品;GAPDH抗体、山羊抗兔二抗为武汉三鹰产品;反转录试剂盒为美国Thermo产品;RNA提取试剂盒、荧光Mix为日本TaKaRa产品。
1.1.3 主要仪器CO2培养箱、超微量紫外可见分光光度仪、酶标检测仪(美国Thermo公司),荧光倒置显微镜(日本Nikon公司),荧光定量PCR仪(美国Bio-Rad公司),台式冷冻离心机(美国Beckman公司),超净工作台(苏净安泰公司)。
1.2 方法
1.2.1 PASMCs原代培养将大鼠麻醉后,取出心肺组织,仔细剥离出主动脉干和左右肺动脉,于体视显微镜下去除动脉外膜结缔组织,用显微剪纵向剪开肺动脉,使内膜朝上,用眼科弯镊刮除内膜,将中膜剪成1 mm2细小组织块,转移至预先盛有0.2%Ⅰ型胶原酶的离心管中,将离心管放入CO2培养箱,每20 min摇动一次,关注消化状态,消化2~3 h肺动脉组织碎块消化成为透明絮状物,1 000 r/min离心5 min,弃上清,加入5 mL含20%FBS的DMEM培养基,吹打混匀移入25 mm2培养瓶,于CO2培养箱中培养。3 d后可见少量细胞贴壁生长,6 d细胞大量增殖,9 d细胞呈“峰谷状”生长达到90%融合可进行细胞传代,每3 d换一次培养基,传至3~10代可用于细胞实验。
1.2.2 台盼蓝检测PASMCs活力消化后收集细胞,细胞悬液与0.4%台盼蓝溶液以9∶1混匀,取1滴用血细胞计数板计数,统计存活率。活细胞无色透明、形态正常,死细胞被染成蓝色、体积胀大。细胞存活率(%)=活细胞总数/观察的细胞总数×100%。
1.2.3 培养细胞的鉴定采用倒置显微镜进行活细胞形态学观察。α-SMA免疫荧光染色鉴定:将原代细胞消化后接种于24孔板,待细胞融合到60%~70%时进行免疫荧光染色,PBS漂洗3次,室温下4%多聚甲醛固定细胞15 min,PBS漂洗,0.25%TritonX-100透化处理15 min,PBS漂洗3次,加入1%BSA常温孵育30 min,用小鼠α-SMA单克隆抗体,稀释比例为1∶200,室温孵育1 h,PBS漂洗5次,每次5 min,Cy3标记的山羊抗小鼠IgG抗体,稀释比例为1∶100,室温避光孵育2 h(产生红色荧光),PBS漂洗5次,每次5 min,DAPI室温下染色5 min(产生蓝色荧光),于倒置荧光显微镜下观察染色情况,以不加一抗孵育的细胞为对照。
1.2.4 CCK-8检测细胞增殖将体外分离培养的PASMCs分为6组:0μg/L组,含10%FBS的DMEM培养基孵育细胞及15、30、45、60、75μg/L组,分别使用15、30、45、60、75μg/L PDGF-BB孵育细胞。将细胞按2×103/孔接种于96孔板,待细胞贴壁,加无血清DMEM培养液培养24 h同步化,弃培养液,PBS洗2次,按分组要求处理细胞12、24、48 h,弃培养液,每孔加入100μL培养液、10 mL CCK-8溶液,置于CO2培养箱继续培养2 h,用酶标仪轻柔振荡1 min,测定在450 nm处的光密度(OD)值,参照波长为650 nm,每组设6复孔、3空白孔。
1.2.5 流式细胞术检测PDGF-BB对PASMCs细胞周期的影响诱导细胞增殖12、24、48 h后将细胞分为2组:对照组(含10%FBS的DMEM培养基);PDGF-BB组(30μg/L PDGFBB)。取对数生长期细胞培养于6孔板,待贴壁,用无血清培养基培养24 h同步化后,加入30μg/L PDGF-BB处理48 h收集细胞,按试剂盒说明书操作。
1.2.6 Western blot检测IL-6、GATA6的蛋白表达用RIPA裂解细胞提取蛋白,用BCA定量试剂盒检测蛋白浓度,SDSPAGE后转移至PVDF膜上,用5%脱脂奶粉封闭1 h,分别加入IL-6(1∶1 000)、GATA6(1∶1 000)、GAPDH(1∶10 000)一抗,4℃孵育过夜,TBST洗膜后加二抗,室温孵育1 h,洗膜后ECL发光液显影,用Image J软件分析条带灰度值,以IL-6/GAPDH、GATA6/GAPDH的比值表示蛋白表达水平。
1.2.7 qPCR检测IL-6、GATA6mRNA的表达诱导细胞增殖12、24、48 h后取对数生长期PASMCs细胞,按照试剂盒说明书提取细胞总RNA,应用分光光度计分别测定RNA样品的浓度和纯度。按ReverAid First Strand cDNA Synthesis Kit说明书进行反转录。按TB Green Premix Ex TaqTMⅡ说明书进行qPCR。引物序列见表1。

Tab.1 Primers used in this study表1本研究中所用引物序列
1.3 统计学方法 采用SPSS 18.0软件对数据进行处理,定量资料以均数±标准差(±s)表示。2组间比较用t检验,多组间比较采用单因素方差分析,多重比较采用LSD法,相关性行Pearson分析,以P<0.05为差异有统计学意义。
2 结果
2.1 PASMCs形态观察培养3 d可见少量细胞分散贴壁生长(图1a);6 d贴壁细胞胞质延伸,透明度增高,细胞边界不清,生长旺盛,少数细胞密集处形成团簇(图1b);9 d细胞呈“峰谷状”生长,即部分细胞多层重叠生长呈“峰”状,细胞层数少的部分呈“谷”状(图1c)。

Fig.1 Image of rat PASMCs under inverted phase contrast microscope(×100)图1大鼠PASMCs在倒置相差显微镜下图像(×100)
标准去骨瓣减压联合内减压术对大面积脑梗死患者血流动力学及预后的影响
2.2 台盼蓝染色结果共计约1 220个细胞,其中43个为阳性细胞(蓝色),细胞存活率>96%。
2.3 细胞免疫荧光染色培养的细胞强染α-SMA呈红色荧光,原代细胞的细胞质中充满红色的线状纤维,纤维多为直线呈束状排列(图2),在只加Cy3标记的山羊抗小鼠IgG抗体的细胞中未见红色荧光,证实所培养细胞为平滑肌细胞。
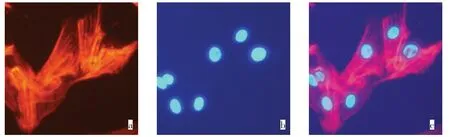
Fig.2 Image of PASMCs immunofluorescence under inverted fluorescence microscope(×100)图2 PASMCs免疫荧光在倒置荧光显微镜下图像(×100)
2.4 PDGF-BB诱 导PASMCs增 殖CCK-8细 胞 增殖检测结果表明,同一水平PDGF-BB刺激PASMCs后,随着诱导时间延长,细胞增殖加快,具有一定时间依赖性。15~60μg/L的PDGF-BB诱导PASMCs 24 h、48 h增殖显著,其中以30μg/L诱导48 h效果最佳(P<0.05),见表2。
Tab.2 Effects of different PDGF-BB concentrations on the proliferation at different time points of PASMCs表2不同PDGF-BB水平组对不同时点PASMCs增殖的影响 (n=6,OD值,±s)
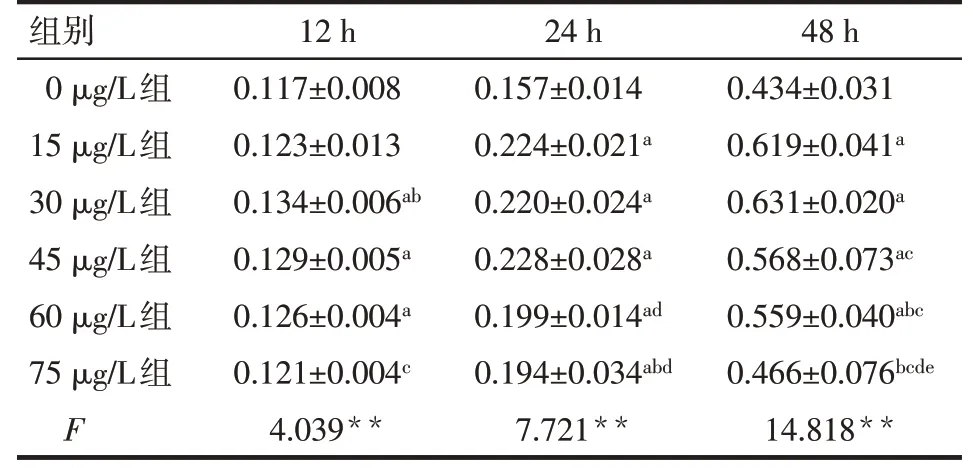
Tab.2 Effects of different PDGF-BB concentrations on the proliferation at different time points of PASMCs表2不同PDGF-BB水平组对不同时点PASMCs增殖的影响 (n=6,OD值,±s)
**P<0.01;a与0μg/L组比较,b与15μg/L组比较,c与30μg/L组比较,d与45μg/L组比较,e与60μg/L组比较,P<0.05
组别0μg/L组15μg/L组30μg/L组45μg/L组60μg/L组75μg/L组F 12 h 0.117±0.008 0.123±0.013 0.134±0.006ab 0.129±0.005a 0.126±0.004a 0.121±0.004c 4.039**24 h 0.157±0.014 0.224±0.021a 0.220±0.024a 0.228±0.028a 0.199±0.014ad 0.194±0.034abd 7.721**48 h 0.434±0.031 0.619±0.041a 0.631±0.020a 0.568±0.073ac 0.559±0.040abc 0.466±0.076bcde 14.818**
2.5 PDGF-BB对PASMCs细胞周期的影响 流式结果显示,与对照组相比,PDGF-BB组细胞G1期百分比显著下降,而S期和G2期百分比明显增加(均P<0.01),见表3、图3。
Tab.3 Effects of 30μg/L PDGF-BB on cell cycles of PASMCs表3对照组与PDGF-BB组对PASMCs细胞周期的影响(n=3,%,±s)
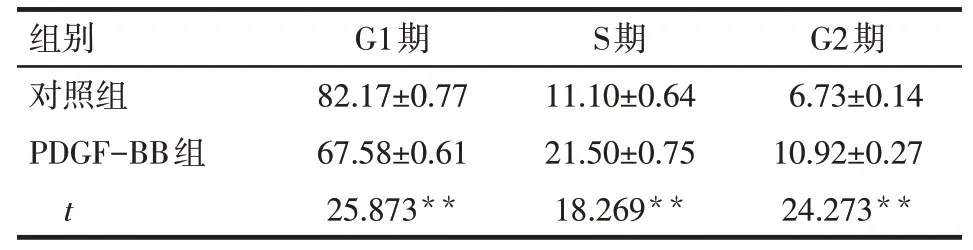
Tab.3 Effects of 30μg/L PDGF-BB on cell cycles of PASMCs表3对照组与PDGF-BB组对PASMCs细胞周期的影响(n=3,%,±s)
**P<0.01
组别对照组PDGF-BB组t G1期82.17±0.77 67.58±0.61 25.873**S期11.10±0.64 21.50±0.75 18.269**G2期6.73±0.14 10.92±0.27 24.273**
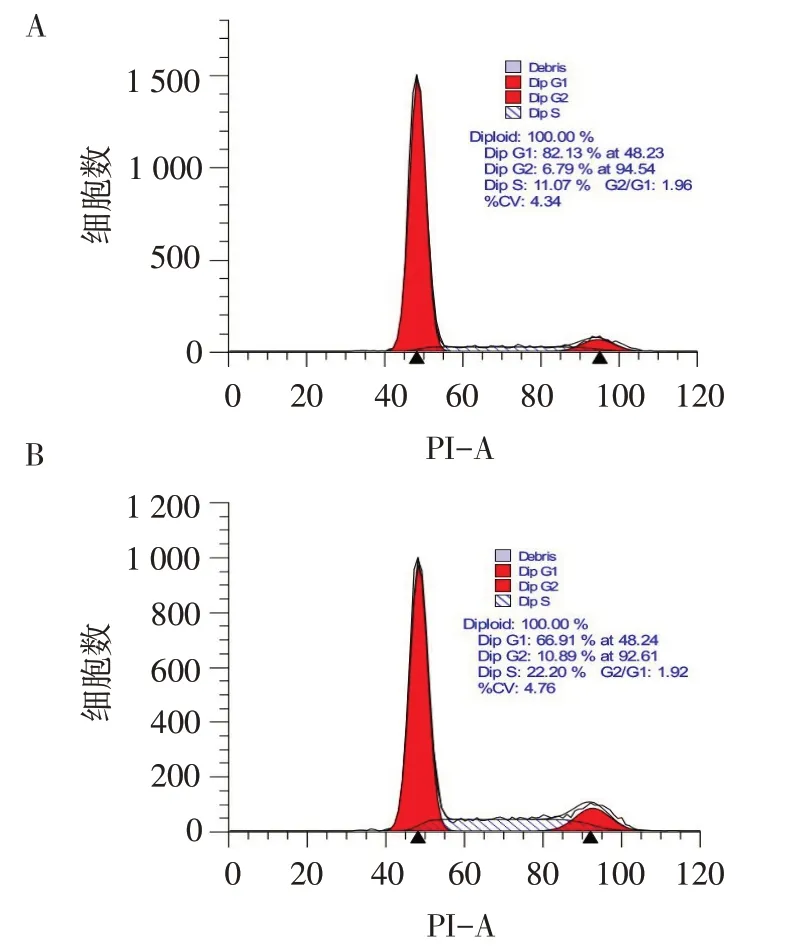
Fig.3 Proportion of cell cycle after 30μg/L PDGF-BB stimulation of PASMCs for 48 h图3 30μg/L PDGF-BB刺激PASMCs 48 h后细胞周期比例情况
2.6 IL-6与GATA6蛋白表达情况Western blot结果显示,与对照组相比,PDGF-BB组24 h、48 h后IL-6水平明显增高(P<0.01),且随着诱导时间的延长而逐渐上升,见图4、表4。与对照组相比,PDGFBB组12 h的GATA6水平降低(P<0.05),且随着诱导时间的延长在24 h、48 h表达进一步降低(P<0.01),见图4、表5。
2.7IL-6与GATA6mRNA在PDGF-BB诱导PASMCs增殖中的表达qPCR结果显示,与对照组相比,在30μg/L PDGF-BB刺激细胞24 h、48 h后IL-6mRNA的表达增高,且呈上升趋势;GATA6mRNA的表达降低,且呈下降趋势,见表6、7。
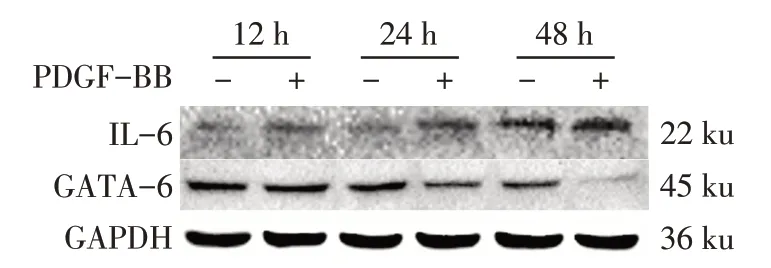
Fig.4 IL-6 and GATA6 protein expressions at various time points图4各时间点IL-6与GATA6蛋白表达情况
Tab.4 Expression of IL-6 protein at different time points in control group and PDGF-BB group表4对照组与PDGF-BB组不同时点IL-6蛋白的表达情况 (n=3,±s)
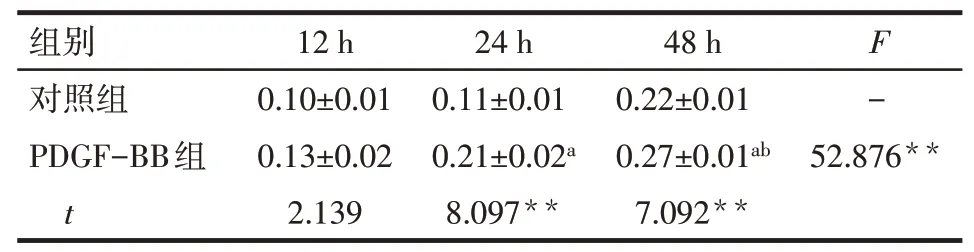
Tab.4 Expression of IL-6 protein at different time points in control group and PDGF-BB group表4对照组与PDGF-BB组不同时点IL-6蛋白的表达情况 (n=3,±s)
**P<0.01;a与12 h PDGF-BB组比较,b与24 h PDGF-BB组比较,P<0.05
组别对照组PDGF-BB组t 12 h 0.10±0.01 0.13±0.02 2.139 24 h 0.11±0.01 0.21±0.02a 8.097**48 h 0.22±0.01 0.27±0.01ab 7.092**F-52.876**
Tab.5 Expression of GATA6 protein at different time points in control group and PDGF-BB group表5对照组与PDGF-BB组不同时点GATA6蛋白的表达情况 (n=3,±s)
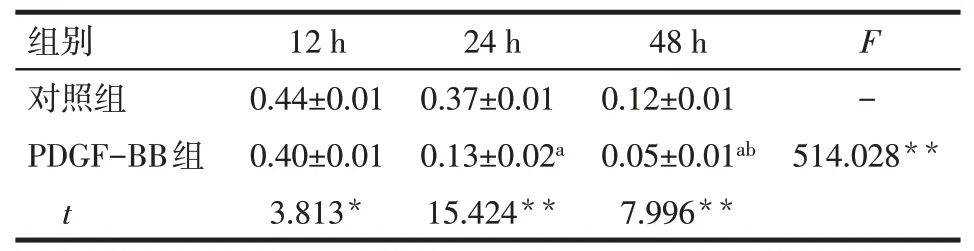
Tab.5 Expression of GATA6 protein at different time points in control group and PDGF-BB group表5对照组与PDGF-BB组不同时点GATA6蛋白的表达情况 (n=3,±s)
*P<0.05,**P<0.01;a与12 h PDGF-BB组 比 较,b与24 h PDGF-BB组比较,P<0.05
组别对照组PDGF-BB组t 12 h 0.44±0.01 0.40±0.01 3.813*24 h 0.37±0.01 0.13±0.02a 15.424**48 h 0.12±0.01 0.05±0.01ab 7.996**F-514.028**
Tab.6 The IL-6 mRNA expression at different time points in control group and PDGF-BB group表6对照组与PDGF-BB组不同时点IL-6 mRNA的表达情况 (n=3,±s)
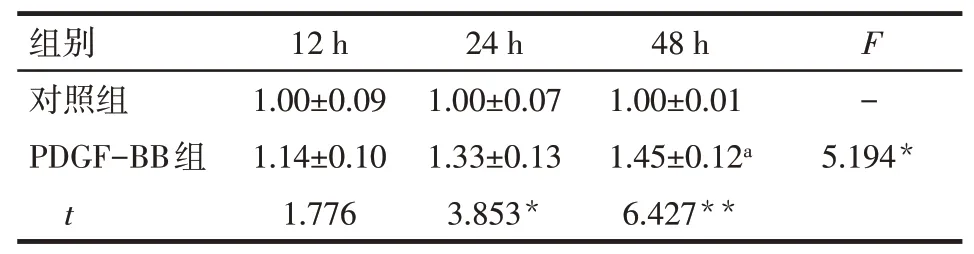
Tab.6 The IL-6 mRNA expression at different time points in control group and PDGF-BB group表6对照组与PDGF-BB组不同时点IL-6 mRNA的表达情况 (n=3,±s)
*P<0.05,**P<0.01;a与24 h PDGF-BB组比较,P<0.05
组别对照组PDGF-BB组t 12 h 1.00±0.09 1.14±0.10 1.776 24 h 1.00±0.07 1.33±0.13 3.853*48 h 1.00±0.01 1.45±0.12a 6.427**F-5.194*
Tab.7 Expression of GATA6 mRNA at different time points in control group and PDGF-BB group表7对照组与PDGF-BB组不同时点GATA6 mRNA的表达情况 (n=3,±s)
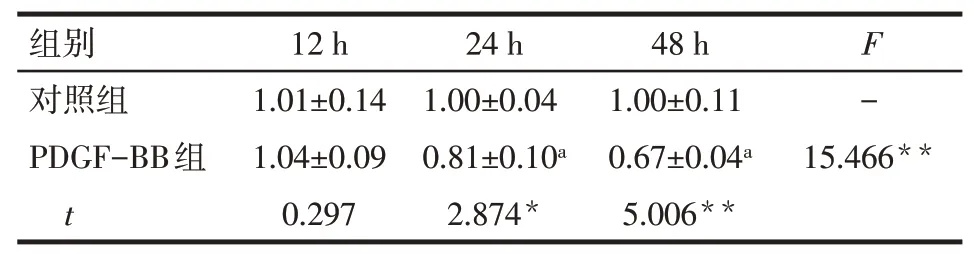
Tab.7 Expression of GATA6 mRNA at different time points in control group and PDGF-BB group表7对照组与PDGF-BB组不同时点GATA6 mRNA的表达情况 (n=3,±s)
*P<0.05,**P<0.01;a与12 h PDGF-BB组比较,P<0.05
组别对照组PDGF-BB组t 12 h 1.01±0.14 1.04±0.09 0.297 24 h 1.00±0.04 0.81±0.10a 2.874*48 h 1.00±0.11 0.67±0.04a 5.006**F-15.466**
2.8IL-6、GATA6表达与PDGF-BB诱导PASMCs增殖的相关性分析30μg/L PDGF-BB诱导的PASMCs增殖与IL-6mRNA表达呈正相关(r=0.538,P<0.05),与GATA6mRNA表达呈负相关(r=-0.647,P<0.01)。IL-6与GATA6的表达呈负相关(r=-0.705,P<0.01)。
3 讨论
3.1 PDGF-BB体外诱导大鼠PASMCs增殖肺动脉高压是一组由多种病因引起的以肺小动脉重构、肺血管阻力持续增加为特征的临床-病理生理综合征。PASMCs异常增殖是PAH肺小动脉重构的中心环节[4]。PASMCs存在2种表型,即收缩表型(静止表型)和合成表型(增殖表型),在正常生理条件下PASMCs处于静止表型,当外界因素发生变化时,平滑肌细胞不同表型之间可以相互转化。PDGF是VSMC的最有效促有丝分裂因子,其中最有效的亚型为PDGF-BB,通过与PDGF受体(PDGFR)结合使PASMCs由静止表型转化为增殖表型[5]。吴珊珊等[6]通过研究PDGF-BB诱导大鼠PASMCs表型转化中的细胞骨架变化来探讨PASMCs表型转化的机制。Zhang等[7]以PDGF-BB诱导大鼠PASMCs增殖为模型,研究异槲皮素通过抑制PASMCs增殖对肺动脉高压的保护作用。本研究分别采用15、30、45、60、75 μg/L PDGF-BB刺激体外培养的原代大鼠PASMCs,观察到15~60μg/L的PDGF-BB诱导24 h、48 h后PASMCs增殖显著,其中以30μg/L诱导48 h增殖最明显,且能加快G1期向S期的过渡,提示PDGF-BB能在体外诱导大鼠PASMCs增殖。
3.2 IL-6与PASMCs异常增殖的关系近年来,越来越多的证据表明细胞因子驱动的炎症过程和免疫失衡在PASMCs异常增殖引起的肺血管重构中具有重要作用。IL-6是一种多效细胞因子,由多种细胞分泌,包括淋巴细胞、巨噬细胞和平滑肌细胞。PASMCs在正压或高氧条件下培养24 h,其炎症介质IL-6分泌增高[8]。低氧诱导的衰老PASMCs可通过旁分泌IL-6促进PASMCs增殖,进而促进PAH肺血管重构。Ramakrishnan等[9]发现IL-6会增加铁调素(hepcidin,一种抗菌肽激素)的转录和释放,从而介导细胞铁积累,促进人肺动脉平滑肌细胞(hPASMCs)增殖。在骨形态发生蛋白受体2(BMPR2)信号通路中,IL-6下调BMPR2的表达,促进PASMCs增殖[10]。本研究中,IL-6随着PDGF-BB诱导细胞增殖时间的延长表达量逐步上升,表达量的改变呈现出一定的时间依赖性,相关性分析也显示PASMCs的增殖与IL-6mRNA表达呈正相关,提示IL-6参与了PASMCs异常增殖的发生和发展。有研究表明,除IL-6外,IL-8、IL-1β等因子也参与了PAH过程[11],但是否通过促进PASMCs增殖来诱导这一过程本文未进行研究,因此在研究因子的选择上较为局限。
3.3 GATA6与PASMCs异常增殖的关系GATA转录因子家族在细胞的增殖和分化调控中起着重要作用,其中GATA6主要表达于血管平滑肌,也是唯一表达于血管平滑肌的GATA家族转录因子。在VSMC中GATA6缺失可促进损伤诱导的VSMC从收缩向增殖合成表型的转化,导致新生内膜的形成和增加[12]。GATA6在体内外均对VSMC具有较强的抗增殖、促分化作用,GATA6基因敲除可使平滑肌细胞保持收缩表型的能力降低[13]。GATA6通过使PASMCs进入静止状态来调节有丝分裂的发生,血清素可下调GATA6的表达,诱导PASMCs增殖。在本研究中GATA6随着PDGF-BB诱导细胞增殖时间的延长,表达量呈下降趋势,且相关性分析显示PASMCs的增殖与GATA6mRNA表达呈负相关,提示GATA6参与了PDGF-BB诱导PASMCs异常增殖的发生和发展。
3.4 IL-6与GATA6可能的潜在关系Wang等[14]刺激小鼠卵巢颗粒细胞Notch信号后,上游转录因子(SF1、Wt1、GATA4、GATA6)的表达受到抑制,IL-6的表达与Notch信号的激活或抑制呈正相关,与上述转录因子的表达呈负相关。IL-6能选择性地诱导基因的启动子区CpG岛甲基化,伴随靶基因的低表达,导致靶基因沉默[15]。GATA6启动子CpG岛甲基化可导致GATA6失去对下游靶基因的调控,引起细胞增殖/凋亡异常[16]。本研究观察到在PASMCs异常增殖的过程中,IL-6与GATA6的表达呈负相关,与本课题组在大鼠肺组织中的研究[17]结果一致。然而本文在设计上尚有不足,未通过IL-6过表达或转染IL-6 siRNA等方法来进一步检测细胞增殖及GATA6的表达变化。另外,IL-6与GATA6之间是通过何种信号传导途径来调控PASMCs的异常增殖有待深入研究。
综上,IL-6、GATA6参与了PDGF-BB诱导的PASMCs增殖过程;且PASMCs的增殖与IL-6mRNA表达上调及GATA6 mRNA表达下调相关。

