HJURP基因促进肾癌细胞增殖迁移的机制研究
杨柳,熊吟,余永红,胡显锋,石园园,江文凛,李艳兰,杜艳华△
肾细胞癌(renal cell carcinoma,RCC)是起源于肾实质泌尿小管上皮系统的恶性肿瘤,临床80%~90%的肾脏恶性肿瘤都是肾细胞癌[1]。其发病占所有恶性肿瘤的2%~3%,在我国泌尿系肿瘤中仅次于膀胱肿瘤[2-3]。肾细胞癌起病隐匿,早期临床表现不明显。尽管诊断技术的改善提高了偶发性肾细胞癌的诊断率,依然有25%~30%的患者在确诊时已出现远处转移;而晚期转移患者治疗效果不够理想,生活质量较差[4]。深入探究肾癌发生进展的机制,寻找临床更有效的生物标志物和治疗靶标对肾癌的早期诊断和治疗显得尤为重要。
HJURP基因位于2号染色体,其与真菌蛋白Scm3结构和功能相似且高度保守,作为分子伴侣与着丝粒蛋白A(CENPA)结合,介导CENPA与染色体着丝粒的结合,从而参与调节染色体的稳定性[5-7]。目前在肿瘤研究中已经发现,HJURP在肝癌及肺癌中高表达,并且可以作为肿瘤的预后标志物[8-9],在神经胶质瘤中敲低HJURP基因可影响细胞增殖能力且增强肿瘤放射敏感性[10]。但HJURP在人肾癌中的作用尚未见报道。本文通过检测HJURP基因在恶性肾癌组织和细胞系中的表达,并敲减肾癌细胞CAKI-1中HJURP基因,分析HJURP基因敲减后细胞增殖、周期及迁移的变化,旨在研究HJURP对肾癌细胞生物学特性的影响。
1 材料与方法
1.1 基因芯片数据提取从TCGA数据库下载肾癌测序基因数据(TCGA-KIRP),利用R软件读取原始文件后,使用Affy包中的RMA算法标准化数据后得到基因的表达矩阵,将预处理后得到的基因表达矩阵文件读入R软件,利用R软件中limma包对肾癌组织样本和癌旁组织样本基因进行差异表达分析,并应用贝叶斯检验方法进行多重检验校正。差异基因判定标准:表达值倍数变化(fold change,FC)≥2或≤-2且P<0.01。同时提取TCGA肿瘤数据库肾癌患者生存预后信息,根据HJURP表达的中位数将患者分为HJURP低表达组及HJURP高表达组。
1.2 实验材料组织标本选自武汉市第四医院2016年1月—2019年10月收治的20例肾癌患者肾癌组织与对应癌旁组织标本,其中男12例,女8例,年龄38~80岁,平均(52.30±7.24)岁。肾癌细胞株CAKI-1、786O、A498及正常化肾小管细胞HK2购自中国科学院典型培养物保藏委员会细胞库,RPMI 1640培养基购自Hyclone公司,胎牛血清购自中国四季青公司。HJURP-靶特异性siRNA(si-HJURP)由吉凯基因合成。为避免脱靶效应,实验共设计3条si-HJURP序列:siRNA1,5′-ATCGAGCATCATCAGTATG-3′;siRNA2,5′-TAGCGCTGTATGAGACCAGTCAA-3′;siRNA3,5′-TACAGCACATGTCTGTGACAGAC-3′。空载体对照序列5′-CCTAAGGTTAAGTCGCCCTCG-3′。HJURP一抗购自英国Abcam公司,钙黏附蛋白E(E-cadherin)、钙黏附蛋白N(N-cadherin)、蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)、糖原合成酶激酶3β(GSK-3β)及磷酸化糖原合成酶激酶3β(p-GSK3β)一抗均购自美国CST公司。GAPDH内参抗体购自美国Santa cruz公司。TRIzol试剂盒购自美国Invitrogen公司;RNA反转录试剂盒购自东洋纺(上海)科技有限公司,SYBR mix购自美国Bio-Rad公司。LipofectamineTM2000脂质体转染试剂盒购自美国Invitrogen公司,MTT试剂盒购自北京百奥莱博科技有限公司,流式周期试剂盒和Transwell小室购自美国BD公司。
1.3 细胞培养及实时荧光定量PCR(qPCR)检测HJURP表达CAKI-1、786O、A498及正常化肾小管细胞HK2培养于含10%胎牛血清的RPMI 1640培养基,于37℃、5%CO2培养箱中常规培养。取对数生长期的4种细胞,TRIzol法提取总RNA并反转录成cDNA。以cDNA为模板,利用Primer Bank数据库(https://pga.mgh.harvard.edu/primerbank/)查询并设计相应引物,HJURP引物上游5′-CCACGCTGACCTACGAGAC-3′,下游5′-CTCACCGCTTTTTGAATCGGC-3′,内参GAPDH引物上游5′-TGCACCACCAACTGCTTAG-3′,下游5′-GATGCAGGGATGATGTTC-3′。反应体系:cDNA模板1μL,SYBR mix 10μL,上、下游引物(20μmol/L)各1μL,无RNA酶水7 μL。反应条件:95℃5 min;95℃30 s,60℃30 s,40个循环;72℃30 s,72℃10 min。目的mRNA的相对表达量用内参GAPDH进行均一化,采用2-ΔΔCt法进行数据处理。
1.4 肾癌细胞株转染实验及siRNA敲减效率验证取对数生长期的CAKI-1细胞接种于6孔板,待细胞密度融合度约60%时将细胞分为HJURP基因siRNA转染组(si-HJURP组)及对照序列转染组(NC组),分别进行小干扰RNA及对照序列空载体siRNA转染。转染后48 h采用qPCR检测HJURP表达水平,检测方法同1.3。根据qPCR结果筛选出敲减效果最佳的siRNA用于后续实验。
1.5 细胞克隆形成实验取si-HJURP组及NC组CAKI-1细胞,制备单细胞悬液,以800个/孔接种于6孔板,细胞培养箱温育静置培养2周。待细胞克隆形成,终止培养,使用4%多聚甲醛固定克隆细胞,0.1%结晶紫对细胞群落进行染色,显微镜下观察并统计细胞克隆形成数量。
1.6 MTT法检测CAKI-1细胞增殖活性取si-HJURP组及NC组转染的CAKI-1细胞,以3 000个/孔接种于96孔板培养,培养24 h后,每隔1 d在每个孔中加入20μL MTT在37℃孵育4 h弃培养液,各孔再加入DMSO 150μL,室温振荡10 min。通过酶标仪测量490 nm处的光密度(OD)值,实验重复3次。
1.7 流式细胞周期检测将si-HJURP组及NC组细胞消化离心后加入含有5%的PI和2%的RNaseA的PBS重悬并调整细胞浓度为1×106/mL,并用锡箔纸包裹离心管避光37℃孵育30 min,然后通过流式细胞仪检测各实验组细胞周期分布情况,实验重复3次。
1.8 Transwell实验检测CAKI-1细胞侵袭能力消化转染后的对数生长期细胞,制备单细胞悬液,离心后用不含血清的培养液重悬细胞计数,然后在24孔板中加入600μL含10%胎牛血清的RPMI 1640培养液,取Transwell小室置于24孔板,在小室中加入200μL密度为3×105/mL的细胞悬液,培养24 h后取出Transwell小室,4%多聚甲醛固定细胞,0.1%结晶紫进行染色。显微镜下采集图像,计数迁移细胞,实验重复3次。
1.9 Western blot检测上皮间质转化(EMT)及AKT通路蛋白表达水平变化取2组转染后的细胞,RIPA裂解液裂解细胞提取蛋白,BCA法检测蛋白浓度后每孔40μg蛋白上样,行十二烷基硫酸钠聚丙烯凝胶电泳(SDS-PAGE),电泳结束后湿转法(恒流17 mA转膜过夜)将蛋白转移于PVDF膜上,次日切取含目的条带的PVDF膜用5%脱脂奶粉室温封闭2 h。孵育HJURP、E-cadherin、N-cadherin、AKT、p-AKT、GSK3β及p-GSK3β一抗与GAPDH内参抗体(均为1∶10 000稀释)于4℃过夜,TBST洗膜10 min×3次,室温孵育二抗(1∶10 000稀释)2 h,再用TBST洗膜10 min×3次,ECL显影、拍照后计算目的蛋白的相对表达量,实验重复3次。
1.10 统计学方法采用Graphpad Prism 8软件对数据进行统计分析,符合正态分布的计量资料使用均数±标准差(±s)比较。2组间比较采用独立样本t检验,多组比较使用单因素方差分析,组间多重比较使用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1HJURP在肾癌中的表达及其对生存预后的影响从TCGA数据库获取533例肾癌患者基因测序数据的基因表达信息,经生物信息学统计分析显示HJURP在肾癌组织中明显上调(t=12.623,P<0.05),见图1A。进一步分析不同肿瘤分期HJURP的表达情况,发现随着肾癌病理分期升高,HJURP表达量也增高(F=15.868,P<0.05),见图1B。Kaplan-Meier生存曲线分析显示HJURP高表达组患者总生存率和无病生存率较HJURP低表达组降低(P<0.01)。见图1C、D。

Fig.1 The expression of HJURP in renal cancer and its effect on prognosis analyzed by TCGA database图1 TCGA数据库分析HJURP在肾癌中的表达及对预后的影响
2.2 肾癌组织及细胞中HJURP的表达水平qPCR结果显示HJURP在肾癌组织中的表达水平显著高于癌旁组织(1.606±0.610vs.0.996±0.160;t=3.758,P<0.01),见图2A。同样,肾癌细胞株A498、786O和CAKI-1中HJURP基因表达水平高于正常化肾小管上 皮HK2细 胞株(F=14.484,P<0.01),且 在CAKI-1细胞系中表达量最高(图2B),因此后续细胞实验采用CAKI-1细胞系。

Fig.2 The expressions of HJURP in renal cancer tissues and renal cancer cells图2组织及细胞验证HJURP在肾癌中的表达
2.3HJURP基因敲减后CAKI-1细胞活力及克隆形成受限qPCR结果显示3个HJURP特异性siRNA序列转染CAKI-1细胞后,HJURP表达水平显著低于NC组(F=205.121,P<0.01)。其中siRNA-1的敲减效果最佳,因此后续实验采用siRNA-1进行HJURP敲减。MTT实验结果显示,si-HJURP组转染后第2天开始CAKI-1细胞活性显著低于NC组。细胞克隆形成实验也表明,与NC组相比,si-HJURP组CAKI-1细胞的克隆形成能力显著降低,细胞克隆形成集落显著减少(个/视野:86.33±7.37vs.168.00±9.54,t=11.732,P<0.01)。见图3。
2.4HJURP基因影响CAKI-1细胞周期HJURP敲减后CAKI-1肾癌细胞的G2期细胞比例明显升高[(20.48±6.24)%vs.(53.33±7.53)%,t=14.122,P<0.01];G1期的细胞比例下降[(58.67±3.25)%vs.(33.32±5.33)%,t=16.848,P<0.01];S期的细胞比例差异 无统 计学 意 义[(18.29±1.22)%vs.(16.33±2.01)%,t=1.819,P=0.143],见图4。
2.5HJURP影响CAKI-1肾癌细胞的体外迁移能力Transwell实验结果显示,si-HJURP组的细胞迁移数量显著低于NC组[(103.0±3.5)个/视野vs.(152.3±8.7)个/视 野,t=4.714,P<0.01],见 图5。Western blot结果显示,HJURP敲减后CAKI-1细胞促进肿瘤细胞迁移相关的蛋白N-cadherin明显下降,抑制肿瘤细胞迁移相关的蛋白E-cadherin明显上调,同时AKT通路关键蛋白p-AKT及p-GSK3β明显下调,见图6。
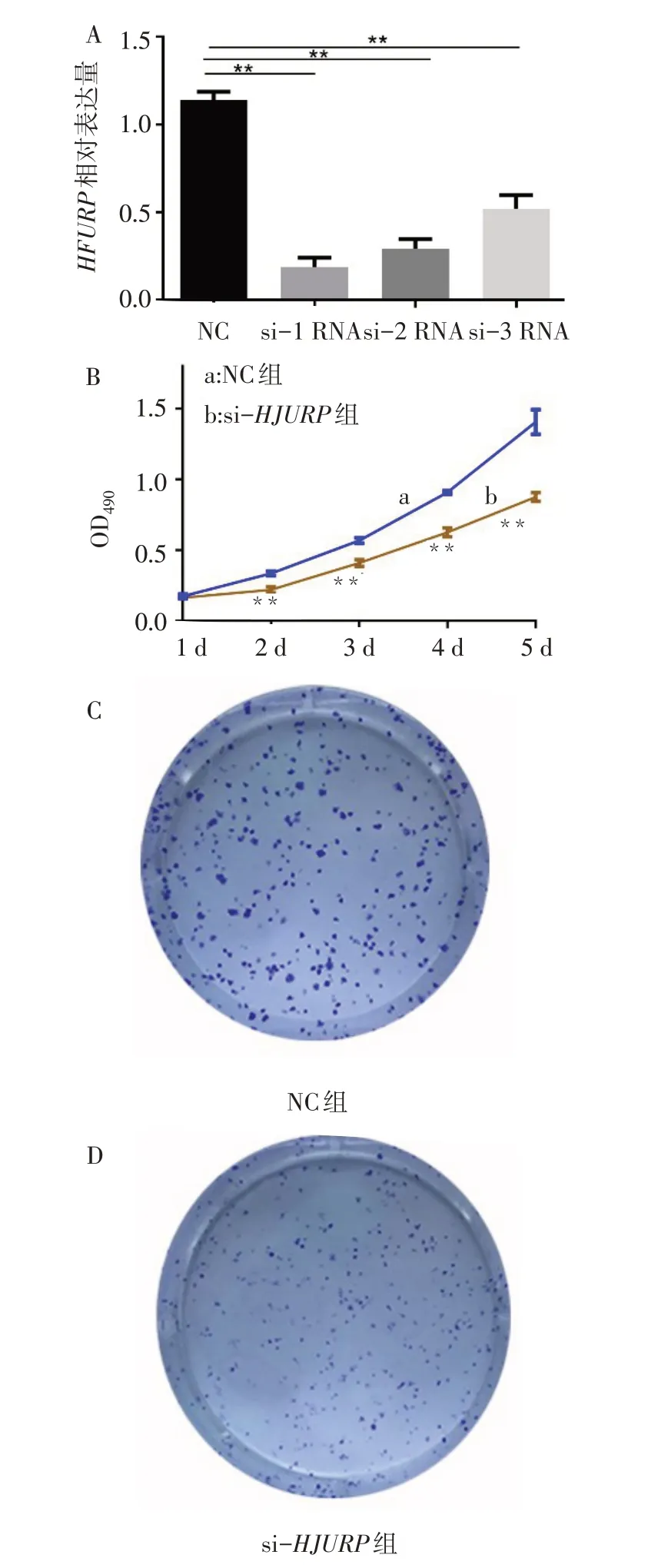
Fig.3 HJURP knockdown represses CAKI-1 viability and clone formation图3 HJURP基因敲低降低CAKI-1细胞活力及克隆形成
3 讨论
HJURP是近年来发现的一个原癌基因,在多种肿瘤中发挥重要作用。Chen等[11]发现HJURP在肝癌组织中高表达,且与肝癌患者的预后密切相关,同时通过体外细胞实验证明HJURP通过MAPK/ERK1/2及AKT/GSK3β信号通路破坏抑癌基因P21蛋白的稳定性,从而促进肝癌细胞增殖、迁移和侵袭。在膀胱癌的研究中发现,HJURP作为原癌基因促进肿瘤的生长及转移,敲除HJURP基因后,肿瘤细胞发生周期阻滞,增殖减缓,进一步的机制研究显示HJURP可能通过PPARγ-SIRT1通路影响肿瘤的代谢[12]。此外另一项研究显示HJURP在人乳腺癌细胞系和原发性乳腺癌中高表达,HJURP的表达水平影响乳腺癌患者的预后且与其放射治疗结果相关,HJURP水平高的患者对放疗更为敏感;体外实验同样表明,高表达HJURP的细胞对放射治疗更为敏感,并且其凋亡率更高[13]。然而HJURP在肾癌的发生发展中的作用机制目前尚不清楚。
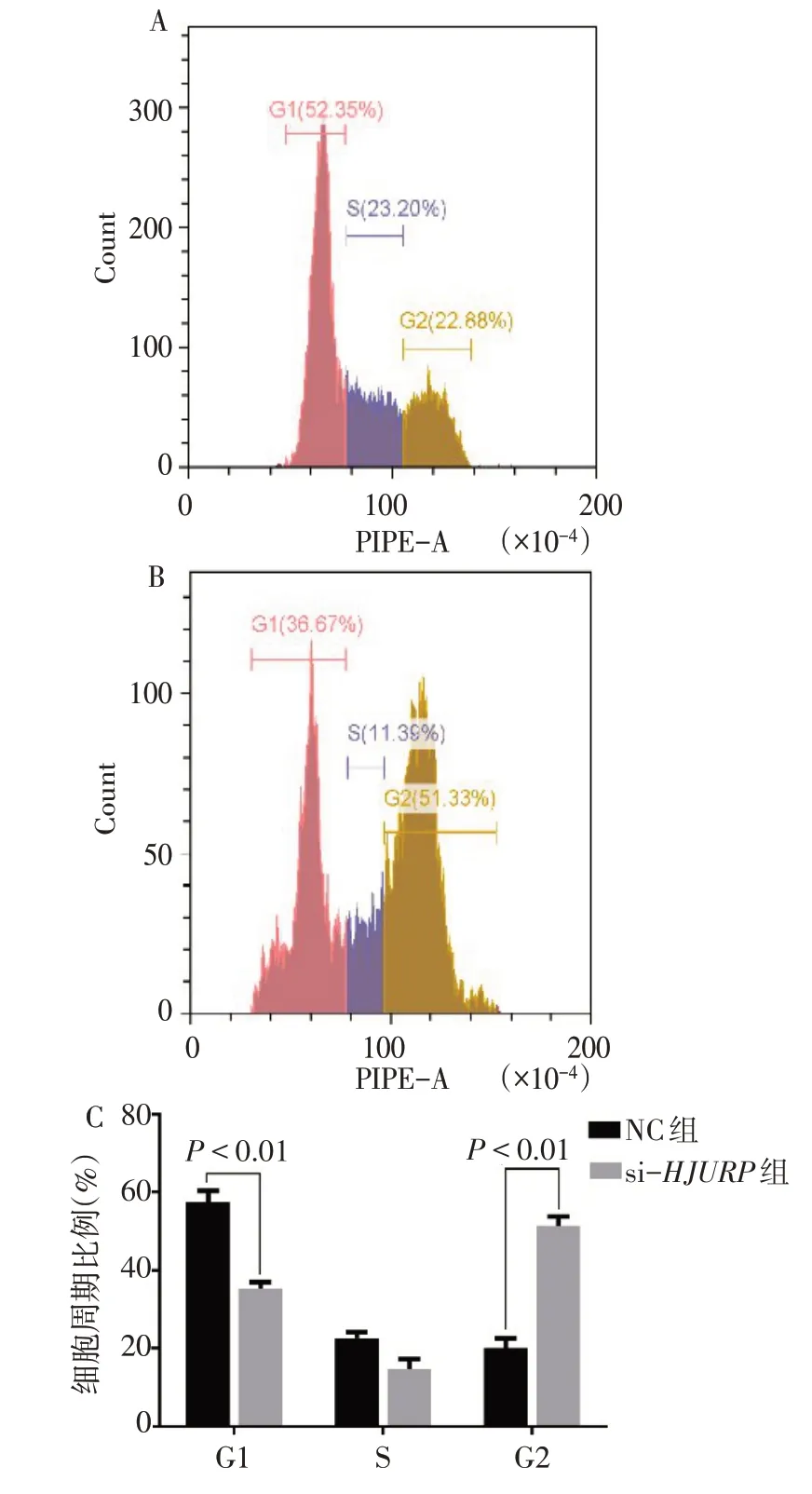
Fig.4 Flow cytometry results of HJURP knockdown in two groups图4 si-HJURP组和NC组细胞周期分布流式图
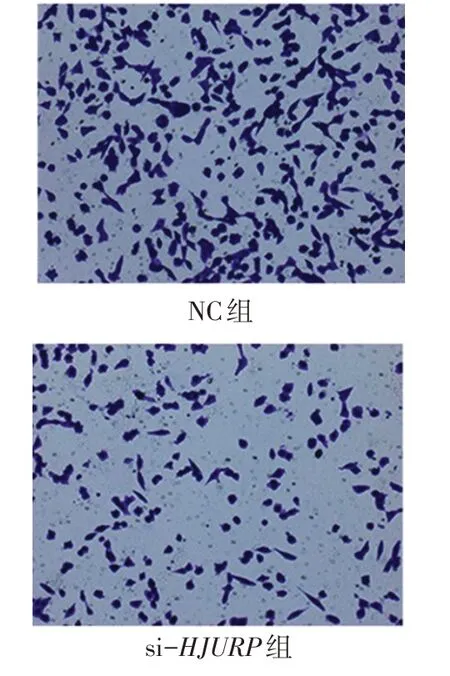
Fig.5 Changes of cell migration ability in si-HJURP group and NC group(×200)图5 si-HJURP组和NC组细胞迁移能力变化(×200)

Fig.6 The key protein changes of EMT and AKT pathway after HJURP knockdown图6 HJURP敲减后EMT及AKT通路蛋白表达变化
本研究利用TCGA肿瘤数据库分析发现HJURP在肾癌中显著高表达,生存及预后分析结果显示,HJURP高表达组患者较低表达组预后明显较差。进一步的临床肾癌组织标本结果同样证实,HJURP在肾癌组织中表达明显高于癌旁组织,提示HJURP可能作为原癌基因参与肾癌肿瘤的形成及进展。
为进一步确定HJURP是否作为功能性的原癌基因参与肾癌进展,笔者检测了HJURP过表达对肾癌细胞增殖和迁移的影响。HJURPsiRNA转染CAKI-1细胞株后,发现沉默HJURP表达后肾癌细胞的增殖、侵袭和克隆能力明显下降。细胞周期与细胞增殖密切相关,细胞周期的异常调节对肿瘤发生机制具有重要意义[14]。本研究中,沉默HJURP后引起肾癌细胞G2期阻滞,表明HJURP表达下调后可将肾癌细胞阻滞在G2期,从而抑制其在体内外的增殖能力。蛋白免疫印迹实验结果显示si-HJURP组促进肿瘤细胞迁移相关的蛋白N-cadherin明显下降,抑制肿瘤细胞迁移相关的蛋白E-cadherin明显增加,蛋白水平验证了HJURP的表达水平确与肾癌细胞的迁移能力相关,提示HJURP可能通过EMT途径促进肾癌细胞的侵袭迁移。AKT是在肿瘤细胞代谢、凋亡及细胞迁移等多种过程中起到重要作用的一种丝氨酸/苏氨酸特异性蛋白激酶[15-16],AKT过度激活可促进各种肿瘤的生长与转移。本实验通路蛋白检测结果显示,HJURP基因下调后AKT通路关键功能蛋白p-AKT及p-GSK3β明显下调,说明HJURP可能通过AKT通路促进肾癌细胞的侵袭迁移。
综上所述,肾癌组织中HJURP的表达水平较癌旁正常组织升高,敲减HJURP表达可以抑制肾癌细胞的增殖转移,其可作为肾癌的潜在临床诊治靶点及预后标志物。

