老年小鼠伏隔核多巴胺D1受体表达下调参与异氟醚麻醉后苏醒延迟
张益,桂欢,胡浪,刘程曦,张洁,梁小丽,3△
苏醒延迟是指在全身麻醉结束1 h后,患者仍然对指令或刺激缺乏有意识反应的现象[1],常发生于老年患者。近来的研究显示,老年患者发生全麻后苏醒延迟的原因除肝肾功能退化导致药物代谢与排除减慢以外,大脑的老年性改变导致对全麻药物反应性的减退也可能是重要原因[2-3]。大脑中多巴胺能通路在自然睡眠和全身麻醉的苏醒过程中均扮演着重要的角色,其中位于腹侧纹状体的伏隔核(NAc)含有大量的多巴胺受体,是脑内重要的多巴胺能相关核团之一。新近的研究发现,通过光遗传学方法激活伏隔核中表达多巴胺D1受体的中型棘突神经元(MSNs)可导致动物从自然睡眠中觉醒[4]。同时,静脉注射多巴胺D1受体激动剂可显著缩短大鼠异氟醚麻醉后的恢复时间[5],提示伏隔核内的多巴胺D1受体可能在全身麻醉的苏醒过程中发挥重要作用。另一方面,脑内多巴胺能通路易受到老年化的影响,老年动物大脑中多个区域的多巴胺能神经元、各种亚型的多巴胺受体以及多巴胺递质与青年动物相比均显著减少,其中就包括了伏隔核内的多巴胺D1受体[6]。然而,老年动物麻醉后苏醒延迟与伏隔核中多巴胺D1受体的老年性改变是否有关目前尚不明确。因此,本研究通过比较老年和青年小鼠经异氟醚诱导麻醉后的苏醒时间、皮层脑电活动以及伏隔核D1受体在异氟醚麻醉中促觉醒的能力,探讨老年动物麻醉后苏醒延迟的相关机制,为寻求更加安全的老年麻醉方案及药物提供新的思路。
1 材料与方法
1.1 材料SPF级雄性C57BL/6老年小鼠(18~22月龄)及青年小鼠(5~8月龄)各26只,购自长沙天勤生物技术有限责任公司[许可证号:SCXK(湘)2014-0011]。异氟醚购自山东鲁南贝特制药公司;D1受体激动剂SKF-82958与拮抗剂SCH-23390购自美国Sigma-Aldrich公司;D1受体一抗及相应二抗购自英国Abcam公司。主要仪器:Model3000微电极放大器(美国A-M system公司),Micro1401数模转换器(英国CED公司),气体监测仪(上海德尔格医疗设备有限公司),小动物麻醉盒及脑立体定位仪(深圳瑞沃德生命科技有限公司)。微量注射泵(Legato®130,美国KD科技公司)。
1.2 方法
1.2.1 老年和青年小鼠苏醒时间及皮层脑电测定采用随机数字表法抽取老年小鼠与青年小鼠各8只,腹腔注射50 mg/kg戊巴比妥钠麻醉后,固定于脑立体定位仪上,切开头皮暴露颅骨,于前额叶皮层(前囟前1.8 mm,中线0.0 mm,深度2.5 mm)中放置皮层脑电记录电极,电极植入手术后待伤口恢复1周行正式实验。正式实验时,将小鼠置于小动物麻醉盒中,给予3%异氟醚诱导至翻转反射消失,连接脑电记录装置并将异氟醚浓度调整至1.4%,运载气体为1 L/min氧气+1 L/min空气,维持30 min后运用抽气泵将麻醉盒内废气抽出,直至异氟醚浓度为0。由此刻至小鼠翻转反射恢复的时间记为苏醒时间,同时记录麻醉和恢复过程的皮层脑电图(electroencephalogram,EEG)。
1.2.2 微注射模型的建立取剩余小鼠,腹腔注射戊巴比妥钠50 mg/kg麻醉后,将小鼠固定于脑立体定位仪上,切皮暴露颅骨,根据小鼠脑图谱[7]将双侧伏隔核微注射引导套管置于伏隔核上方0.5 mm处(前囟前1.54 mm,中线旁开±0.7 mm,深度4.50 mm)。同时将皮层脑电电极置于前额叶皮层中,通过骨水泥固定。术后前3 d,每日注射青霉素20 000 U抗感染,术后恢复1周开始正式实验。共建立老年和青年微注射模型各18只,老年组随机分为老年激动剂组(A-ago组)、老年拮抗剂组(A-ant组)和老年对照组(A-C组)3个亚组;青年组同样随机分为青年激动剂组(Y-ago组)、青年拮抗剂组(Y-ant组)以及青年对照组(Y-C组)3个亚组,每个亚组6只。
1.2.3 微注射模型行为学实验及脑电记录将小鼠置于小动物麻醉盒中,给予3%异氟醚诱导翻转反射消失,将微注射套管与动物头部的引导套管相连,同时连接脑电记录系统。此后将异氟醚调整为1.4%并维持。在第28 min时,老年和青年激动剂组通过微注射泵注射D1受体激动剂SKF-82958(5μg/0.5μL每侧),老年和青年拮抗剂组注射D1受体拮抗剂SCH-23390(5μg/0.5μL每侧),老年和青年对照组给予相同体积的生理盐水。注射完成后,微注射套管继续留置于注射部位1 min,以便药物有效扩散。拔出注射套管后停止异氟醚吸入并抽出废气,记录苏醒时间和EEG。实验结束后,所有小鼠采用60 mg/kg戊巴比妥钠麻醉,由心脏灌注生理盐水后,再缓慢灌注4%多聚甲醛进行固定,随后取脑组织放置于4%多聚甲醛中24 h,再置于30%蔗糖溶液中脱水直至沉于溶液。随后行伏隔核冠状切片,确定微注射套管位置是否准确。若导管位置不在伏隔核内,则剔除该实验动物数据。实验过程中置管不准确4只,微注射模型死亡1只,均及时补充相同鼠龄小鼠,重新建立模型行相应实验。
1.2.4 脑电分析皮层脑电图分析采用Spike2软件包(英国CED公司)完成。将原始脑电信号通过高通滤波分为慢波(0~1 Hz),δ(>1~4 Hz),θ(>4~8 Hz),α(>8~12 Hz),β(>12~25 Hz)和γ(>25~60 Hz)频段。每只小鼠所有频段能量与自身总能量比值作归一化处理,比较不同组间各频段的相对能量值。
1.2.5 Western blot法检测伏隔核多巴胺D1受体蛋白表达水平行为学及脑电记录完成后,腹腔注射60 mg/kg戊巴比妥钠麻醉,快速断头取脑,分离伏隔核。在伏隔核组织中加入细胞裂解液,提取蛋白,通过BCA法行蛋白定量。取等量的蛋白样本通过SDS-PAGE电泳分离,经转膜和封闭后,加入多巴胺D1受体一抗(1∶500)于4℃下孵育过夜,经洗膜后加入驴抗兔二抗(1∶8 000),室温下孵育1 h后通过增强化学发光法(ECL)曝光成像。运用Image J软件检测蛋白条带灰度值,通过目标条带与内参蛋白β-actin灰度值的比值来反映D1受体的相对表达水平。
1.3 统计学方法统计分析作图均采用Graphpad Prism 6.01软件完成。正态性检验通过Kolmogorov-Smirnov检验完成,符合正态分布的计量资料以均数±标准差(±s)表示,老年与青年小鼠指标比较采用t检验,各组内3个亚组之间的比较采用单因素方差分析,组间两两比较采用Sidak法。P<0.05为差异有统计学意义。
2 结果
2.1 老年和青年小鼠异氟醚麻醉后苏醒时间及皮层脑电图变化老年组小鼠麻醉后苏醒时间较青年组显著延长;同时在苏醒期老年组小鼠δ频段的能量较青年小鼠显著升高,而其α、β和γ频段的能量较青年小鼠明显降低(P<0.05或P<0.01),见表1。
Tab.1 Comparison of emergence time after isoflurane anesthesia and power of all bands in cortical EEG between aged mice and young mice表1老年和青年小鼠异氟醚麻醉后苏醒时间及皮层EEG各频段能量的比较 (n=8,±s)
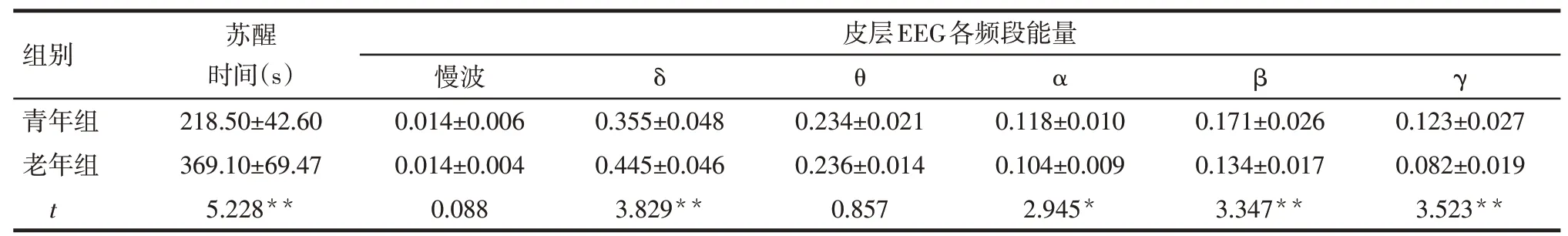
Tab.1 Comparison of emergence time after isoflurane anesthesia and power of all bands in cortical EEG between aged mice and young mice表1老年和青年小鼠异氟醚麻醉后苏醒时间及皮层EEG各频段能量的比较 (n=8,±s)
*P<0.05,**P<0.01
组别青年组老年组t苏醒时间(s)218.50±42.60 369.10±69.47 5.228**皮层EEG各频段能量慢波0.014±0.006 0.014±0.004 0.088 δ θ α β γ 0.355±0.048 0.445±0.046 3.829**0.234±0.021 0.236±0.014 0.857 0.118±0.010 0.104±0.009 2.945*0.171±0.026 0.134±0.017 3.347**0.123±0.027 0.082±0.019 3.523**
2.2 老年和青年小鼠麻醉后觉醒能力变化 在青年小鼠中,Y-ago组的苏醒时间明显短于Y-C组,同时在皮层EEG上δ频段能量减少,β、γ频段能量增加;Y-ant组的苏醒时间则明显长于Y-C组,皮层EEG上δ频段能量增加,见表2。在老年小鼠中,Aago组与A-ant组的苏醒时间和皮层EEG变化与AC组相比差异均无统计学意义,见表3。
Tab.2 The effects of microinjecting D1 agonist and antagonist into the nucleus accumbens on the emergence time and power of all bands in cortical EEG in young mice表2青年小鼠伏隔核给予D1受体激动剂和拮抗剂对异氟醚麻醉后苏醒时间及皮层EEG各频段能量的影响(n=6,±s)
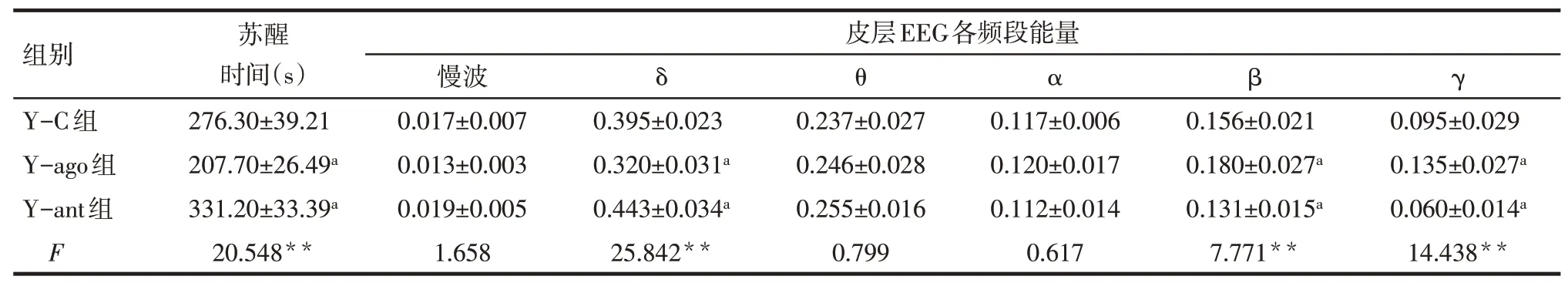
Tab.2 The effects of microinjecting D1 agonist and antagonist into the nucleus accumbens on the emergence time and power of all bands in cortical EEG in young mice表2青年小鼠伏隔核给予D1受体激动剂和拮抗剂对异氟醚麻醉后苏醒时间及皮层EEG各频段能量的影响(n=6,±s)
**P<0.01;a与Y-C组比较,P<0.05
组别Y-C组Y-ago组Y-ant组F苏醒时间(s)276.30±39.21 207.70±26.49a 331.20±33.39a 20.548**皮层EEG各频段能量慢波0.017±0.007 0.013±0.003 0.019±0.005 1.658 δ θ α β γ 0.395±0.023 0.320±0.031a 0.443±0.034a 25.842**0.237±0.027 0.246±0.028 0.255±0.016 0.799 0.117±0.006 0.120±0.017 0.112±0.014 0.617 0.156±0.021 0.180±0.027a 0.131±0.015a 7.771**0.095±0.029 0.135±0.027a 0.060±0.014a 14.438**
Tab.3 The effect of microinjecting D1 agonist and antagonist into the nucleus accumbens on the emergence time and power of all bands in cortical EEG in aged mice表3老年小鼠伏隔核给予D1受体激动剂和拮抗剂对异氟醚麻醉后苏醒时间及皮层EEG各频段能量的影响(n=6,±s)
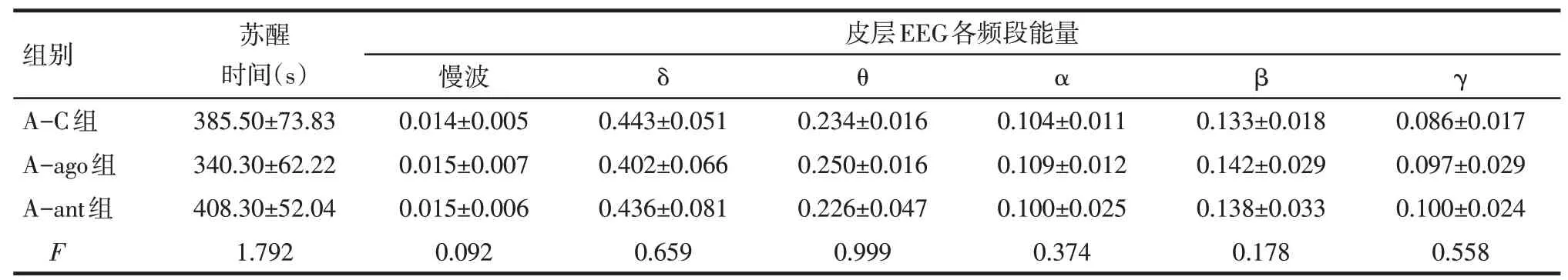
Tab.3 The effect of microinjecting D1 agonist and antagonist into the nucleus accumbens on the emergence time and power of all bands in cortical EEG in aged mice表3老年小鼠伏隔核给予D1受体激动剂和拮抗剂对异氟醚麻醉后苏醒时间及皮层EEG各频段能量的影响(n=6,±s)
均P>0.05
组别A-C组A-ago组A-ant组F苏醒时间(s)385.50±73.83 340.30±62.22 408.30±52.04 1.792皮层EEG各频段能量慢波0.014±0.005 0.015±0.007 0.015±0.006 0.092 δ θ α β γ 0.443±0.051 0.402±0.066 0.436±0.081 0.659 0.234±0.016 0.250±0.016 0.226±0.047 0.999 0.104±0.011 0.109±0.012 0.100±0.025 0.374 0.133±0.018 0.142±0.029 0.138±0.033 0.178 0.086±0.017 0.097±0.029 0.100±0.024 0.558
2.3老年和青年小鼠伏隔核中多巴胺D1受体的表达水平的比较与青年小鼠相比,老年小鼠伏隔核中多巴胺D1受体的表达明显下调(t=4.294,P<0.01),见图1。
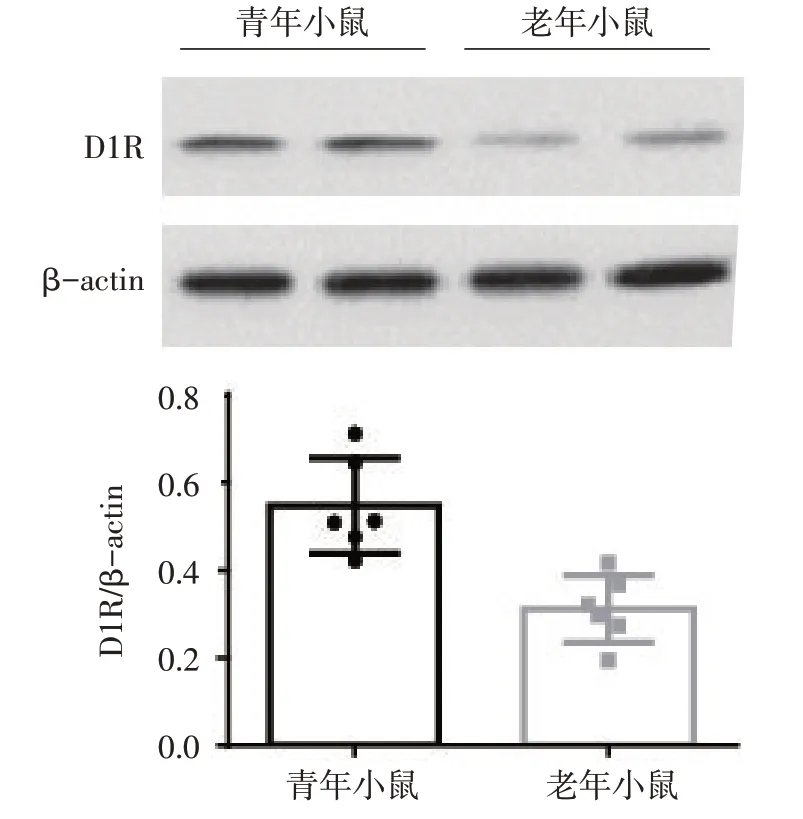
Fig.1 Comparison of D1 receptor expressions in NAc between aged and young mice图1老年和青年小鼠伏隔核中多巴胺D1受体的表达比较
3 讨论
研究显示,大脑的老年化改变可增加其对全身麻醉药物的敏感性,从而导致麻醉后苏醒延迟[2]。本研究也发现,老年小鼠在异氟醚麻醉后苏醒时间较青年小鼠明显延长,同时在皮层脑电图上慢波较青年小鼠增强而快波减弱,在大脑层面提示其苏醒期麻醉水平更深,说明老年小鼠大脑在苏醒期对异氟醚麻醉的反应和青年小鼠存在着明显的差异,但其具体的神经机制尚不明确。
伏隔核中95%以上的神经元为MSNs,MSNs是一种γ-氨基丁酸(GABA)能的抑制性神经元,其上表达有大量的多巴胺D1和D2受体[8]。近来的研究发现伏隔核在睡眠觉醒过程中发挥着重要的作用,其中表达多巴胺D1受体的MSNs兴奋后可促进自然睡眠的觉醒[4],但伏隔核的多巴胺D1受体是否也在全身麻醉的觉醒过程中发挥重要作用,目前尚少见相关报道。本研究发现,向伏隔核中微注射多巴胺D1受体的激动剂可以明显缩短异氟醚麻醉后的苏醒时间,而拮抗其中的多巴胺D1受体又可延长其苏醒时间,提示伏隔核D1受体可能是脑内调控全身麻醉觉醒的结构之一。激活MSNs上表达的D1受体可将神经元膜电位去极化,由此兴奋MSNs[9]。伏隔核的MSNs兴奋后抑制其投射区域,如中脑腹侧被盖区(VTA)的GABA能中间神经元,使VTA内的多巴胺能神经元去抑制[10];而VTA的多巴胺神经元已被证实是全身麻醉觉醒的重要神经集合,激活后可促进多种麻醉药物的苏醒过程[10-11],这可能是伏隔核D1受体促麻醉觉醒的重要机制之一。
本研究还发现,在老年动物的大脑中,伏隔核D1受体促进麻醉觉醒的能力明显降低,向伏隔核中注射D1受体激动剂和拮抗剂对老年小鼠异氟醚麻醉后的苏醒时间和皮层EEG均无明显影响,其机制可能与老年小鼠伏隔核中D1受体的表达减少有关。大脑内多巴胺受体的表达极易受到老年化的影响,包括D1受体在内的多种多巴胺受体亚型的表达在自然衰老的大脑中均有明显减少[12]。尽管多巴胺递质的合成能力并不受老年化的影响[13],但由于可结合的受体密度下降,各脑区内与多巴胺受体相关的功能将随着年龄的增加而减弱。
综上所述,伏隔核中多巴胺D1受体兴奋可促进异氟醚麻醉的苏醒,但D1受体的这种促觉醒作用在老年大脑中显著减弱,可能与老年小鼠伏隔核中D1受体表达减少有关。

