人和猪神经脱细胞基质蛋白质组学差异
蒋永生,张梦佩,韩春婵,黄立江
(温州医科大学附属象山医院,浙江 宁波 315700,1.科教管理中心;2.消化内科)
外周神经损伤(peripheral nerve injury,PNI)会导致支配区域出现运动和感觉的丧失并诱发剧烈的神经疼痛,严重影响患者的生活质量[1]。临床治疗中,自体神经移植仍然被视为修复缺损神经的“金标准”[2]。但由于存在来源受限、获取组织的个体差异及术后并发症等原因,致其应用受限[3-4]。 为解决这一难题,研究人员尝试利用去细胞后的异种组织对PNI进行修复。由于猪神经和人神经的基因序列和结构形态极为相似,故将自体神经及其制备的产品替换为去细胞后的猪神经组织并运用于PNI的修复成为目前研究的热点[5]。本研究通过蛋白质组学分析方法,对人神经脱细胞基质(human decellularized nerve matrix,hDNM)和猪神经脱细胞基质(porcine decellularized nerve matrix, pDNM)存在的差异蛋白进行GO和Pathway分析,同时绘制2组脱细胞基质相关蛋白的热图,为开发猪神经生物材料并运用于PNI的临床治疗提供支撑。
1 材料和方法
1.1 材料 hDNM购自广州中大医疗器械有限公司[商品名:神桥;批准文号:国食药监械(准)字2012第3460641号]。pDNM委托广州中大医疗器械有限公司生产。
1.2 方法
1.2.1 蛋白质提取:pDNM(3个样)和hDMN(6个样)共计9个样品,4 ℃冻融并用预冷的PBS清洗2次,以去除样本中残留液体。将组织迅速置于-80 ℃ 预冷的研磨钢管中,加入钢珠,使用上海净信全自动样品快速研磨仪(型号:JXFSTPRP-32),研磨 1 min。往研磨钢管中加入1 mL的SDS裂解液(上海碧云天,P0013G),于冰上反应30 min(每隔10 min涡旋1 min)。将研磨钢管中的蛋白质裂解液转移至新的EP管,170 000×g,4 ℃离心30 min,取上清液至新的EP管中并运用BCA法检测各样本蛋白质浓度。
1.2.2 蛋白质酶解:将各个样品50 μg的蛋白质转移到新试管中,加入DTT到样品中使其终浓度为 20 mmol/L,在37 ℃中反应1 h。随后,加入 60 mmol/L的IAA,避光于室温进行烷基化反应 30 min。反应完成后加入6倍体积的冷丙酮, -20 ℃沉淀5 h。然后,于4 ℃中1 000×g离心收集蛋白沉淀,再用冷丙酮洗一次沉淀体。加入 20 ng/μL的胰酶25 μL,涡旋沉淀使其溶解,于 37 ℃反应过夜,最后将酶切好的多肽用C18除盐小柱除盐。
1.2.3 TMT标记肽段混合物:采用TMT-10Plex (Thermo Scientific,美国)标记定量试剂盒,遵照说明书进行标记。标记肽段样品混合后冻干。
1.2.4 高pH反相分离肽段:混合物重溶于Solvent A(Solvent A:20 mmol/L甲酸铵水溶液,氨水调 节至pH 10.0)后用Ultimate 3000系统(Thermo Fisher Scientific,美国)连接反向柱(XBridge C18 column,4.6 mm×250 mm,5 μm,Waters Corporation,美国)进行高pH分离,分离使用线性梯度,40 min内5% B至45% Solvent A(B:80% ACN中加入20 mmol/L甲酸铵,氨水调节至pH 10.0)。柱子在初始条件下平衡15 min,柱流速维持在0.8 mL/min, 柱温维持在30 ℃。收集到12个fraction,各个fraction在真空浓缩仪中干燥待用。
1.2.5 nano-HPLC-MS/MS分析:各fraction重溶于30 μL solvent C(C:0.1%甲酸水溶液)后由配备在线纳喷离子源的LC-MS/MS进行分析。整套系统为串联EASY-nano-LC的Orbitrap Fusion质谱仪 (Thermo Scientific,美国)。5 μL(1 μg)肽段样品以4 μL/min流量上样到捕集柱(Thermo Scientific Acclaim PepMap C18,100 μm×2 cm),随后在分析柱(Acclaim PepMap C18,75 μm×15 cm)中以 90 min梯度分离:由7% D升至32% D,3~79 min,梯度时间76 min(D:0.1%甲酸ACN溶液)。柱流量控制在300 nL/min,电喷雾电压2.1 kV。Orbitrap Fusion质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS采集间切换,3 s一个周期。在60 K质量分辨率下获得全扫描谱图(m/z 350-1550),随后在50 K分辨率下进行后续HCD MS/MS扫描,AGC target 为8e4,最大注入时间120 ms。设置为n=1后实施动态排除,时间为45 s。
1.2.6 数据处理:Protein Discoverer 2.1 SP1进行搜库分析,使用的数据库为人类及猪的同源肽段数据库并构建同源肽段数据库,其原则为:数据库进行胰酶理论酶解,过滤所有非同源肽段,对筛选到两个物种中100%序列匹配的特异肽段(unique peptide)进行合并得到同源肽段库。搜库参数如下:MS1的容差值为0.001%,二级碎片的容差值为 0.02 Da,允许的最大漏切数为2,半胱氨酸 Carbamidomethyl为固定修饰,甲硫氨酸氧化,N端乙酰化为可变修饰,蛋白鉴定控制FDR<0.01,特异肽至少大于1。
2 结果与分析
2.1 数据质控 本研究使用pDNM组的6个样品组和hDNM的3个样本定量蛋白的强度数据进行主成分分析,由图1A的结果可知,2组样本分布在二位空间不同的区域区分明显,说明2组样本间存在差异。层次聚类进行样本间的Pearson相关性系数分析(见图1B),得出组内、组间样本间的相关性绝大多数都达到了0.75以上,表明2组组样本的生物学均一性较好,组内相关性很高。

图1 试验样本的数据控质
2.2 差异表达蛋白鉴定结果 LC-MS/MS检测分析了2组样品可信蛋白1 448个,其相对含量绘制成热图(见图2A),结果表明:2组蛋白都能明显区分,组内重复性良好,表达模式存在差异,且相较于hDNM组,pDNM组整体上调。对组间差异表达蛋白进行筛选,筛选条件为:组内重复数据进行t检验,P<0.05的蛋白被认为差异显著,且蛋白丰度差异倍数达到2倍以上或者0.5倍以下。筛选结果表明,相比hDNM组,pDNM组表达上调蛋白456个,表达下调蛋白170个(见图2B)。
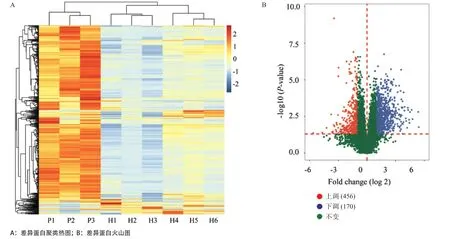
图2 pDNM和hDNM不同蛋白的定量差异
2.3 差异蛋白生物信息功能分析 对pDNM上调的456个蛋白进行GO分析,结果显示,上调蛋白主要集中在细胞迁移、细胞骨架组织、轴突发育和神经系统发育的调节等生物过程;主要涉及生长锥、轴突、神经元胞体和突触部分等细胞组分;参与的生物过程主要与生物功能调节、细胞骨架的结构组成、肌动活性和细胞外基质(extracellular matrix,ECM)结构协同等方面相关。KEGG通路分析显示,2组间的差异蛋白主要介入的功能包括肌动蛋白细胞骨架的调节、轴突的引导、ECM受体相互作用和营养因子信号通路等。这些富集通路中上调和下调的蛋白数目分别为24、26、25、19和13、9、14、10。见图3。

图3 差异蛋白生物信息功能分析
2.4 ECM相关蛋白含量组间差异 ECM由多种蛋白质和多糖及可溶性因子组成,其中,层粘连蛋白、胶原蛋白和纤维粘连蛋白可以为细胞的生长创造良好的微环境,进而促进神经纤维的再生和神经功能的修复[6]。糖胺聚糖(glycosaminoglycans,GAGs)和肝素带有大量负电荷,易与各类生长因子相结合进而调控细胞的生长行为和特定的生物学过程[7]。由蛋白质组学定量的结果可知,上述ECM相关蛋白在组内含量较为一致,组间差异较为显著。与hDNM组相比,pDNM含有更多的粘连蛋白、胶原蛋白和纤维粘连蛋白,但GAGs和肝素的含量较少(见图4)。

图4 组间ECM相关蛋白表达差异热图
3 讨论
在临床实践中,将捐献者的神经脱细胞后,再与患者断裂的神经进行桥接被认为是修复周围神经缺损的策略之一,将该去细胞同种异体神经开发成临床治疗PNI的产品包括神桥和Avance®[8-9]。然而,人的脱细胞神经不能广泛运用于PNI的修复,受限的原因主要包括[10]:①来源有限。获取的途径主要通过志愿者的捐赠,数量较少。②质量层次不齐。捐赠的神经来源于不同年龄、不同健康程度的人群,且存放时间不同,导致供体神经的质量无法保证。③术后并发症。存在移植后供体神经与配体神经大小不匹配、手术过程中的技术差异等原因导致的术后神经疼痛、神经肿瘤甚至无显著功能恢复的情况。
为解决上述问题,科研人员已经将研究的重点转移到猪组织材料产品的开发上。因为猪和人的基因序列极为相似,利用猪的心脏器官制备的水凝胶(临床批准号:NCT 0230562)可通过重塑缺血心脏内部的微环境进而促进心肌细胞的浸润与生存,达到预防和(或)治疗心肌梗死的目的[11]。另外,在解剖学中,猪神经的构造和形态与人神经较为类似,且在农业高度发达的今天,家猪的饲养已成规模化和商业化,故猪神经的来源较为广泛且价格适 宜[5]。因此,猪神经组织产品的开发为人类PNI的修复提供了一条有吸引力的可替代途径[12-13]。已有研究报道,可成功制备猪的脱细胞神经,并检测出内部DNA的含量较低且保留主要的ECM相关蛋白(包括胶原、层粘连蛋白和纤维连接蛋白)[14]。KVIST等[15]利用猪神经(异种)和鼠神经(异体)分别移植入大鼠10 mm缺损坐骨神经的两端并进行10 d 的修复,发现二者均可有效地促进轴突的生长和髓鞘相关蛋白的表达。
尽管猪神经组织运用于PNI的修复存在一定的前景,但该组织的直接运用可能无法达到修复损伤神经的目的,因为猪神经含有引起免疫排斥反应的生物大分子,包括a(1,3)-半乳糖[α(1,3)-galactose,α-gal]和主要组织相容性复合物I (majorhistocompatibility complex class I,MHC I),以及一些内毒素[16]。这些物质必须尽量地去除以保证移植体内后的生物安全。脱细胞技术可通过化学和物理的方法去除神经组织中的细胞,形成无免疫原性或低免疫原性的神经材料。因此,在修复PNI的临床运用中,需要对猪神经组织的原材料进行脱细胞化。已有研究报道称,将pDNM制备成生物水凝胶涂抹在纳米纤维的表面可促进施旺细胞(Schwann cells,SCs)的迁移和轴突的再髓鞘化[17]。也有研究证实,将该生物水凝胶灌注于神经导管的表面可显著提高外周神经缺损动物神经纤维的再生和功能的恢复[18]。这些研究结果表明,利用猪神经制备的生物材料对外周神经的保护和再生疗效显著。但是在脱细胞的过程中,除去免疫原性物质的同时,一些神经组织内部含有的ECM蛋白,比如层粘连蛋白、胶原蛋白和纤维粘连蛋白,也不可避免地被去除[7],而这类物质可营养细胞并为神经的再生创造良好的微环境。因此,对脱细胞后的基质内部各类蛋白的有无和含量进行检测对评价该类产品的质量和有效性至关重要。
本研究采用TMT标记定量蛋白质谱技术,对pDNM和hDNM含有的各类蛋白进行定量并进行差异化分析,结果发现,pDNM选取的3个样本和hDNM选取的6个样本均呈现组内均一性和重复性良好、组间差异性显著的特征,且pDNM内部含有的各类蛋白的量整体多于hDNM。造成这种结果的原因包括:①猪神经本身具有的蛋白含量高于人神经;②由于在脱细胞过程中,人神经比猪神经更加容易除去自身的各类蛋白,导致pDNM含有的各类蛋白含量高于hDNM。故选择适宜的脱细胞方法和试剂,尽可能地除去组织器官内的免疫原性大分子,并尽量保留能促进细胞生长和组织发育的结构和功能蛋白,对脱细胞产品的医学运用至关重要。
本研究利用生物信息学对差异蛋白进行GO富集化和KEGG通路分析,结果显示,上调的pDNM蛋白主要富集于生长锥、轴突、神经元胞体和突触部分,并调控细胞迁移、神经系统和轴突的发育等生物功能,说明pDNM富含的相关蛋白可能对损伤神经的再生和修复具有重要的影响。KEGG通路分析显示,差异蛋白主要介入的功能包括肌动蛋白细胞骨架的调节和轴突引导等方面,且pDNM上调的蛋白数更多,进一步验证上述推论。本研究对为细胞生长提供良好微环境并营养神经和促进其发育的一类ECM相关蛋白在pDNM和hDNM的表达进行了整理并绘制热图,结果发现,虽然pDNM含有的GAGs和肝素含量不及hDNM,但对于粘连蛋白、胶原蛋白和纤维粘连蛋白这些主要的ECM蛋白在pDNM的含量更高,可能这些ECM蛋白的丰富存留是猪神经去细胞材料具有优越修复PNI的重要缘由。
综上,pDNM含有的各类蛋白的量总体高于hDNM, 且具有促进细胞生长和组织发育的ECM相关蛋白在pDNM富含更多。基于此,我们的研究可以为猪神经去细胞材料替代人神经去细胞产品提供更多地数据支持。

