非综合征型耳聋的不同听力学表型与常见致聋基因的相关性
张初琴,陈波蓓,伊松,刘学军,项海杰
(1.温州医科大学附属第二医院育英儿童医院 耳鼻咽喉科,浙江 温州 325027;2.温州医科大学附属口腔医院 正畸科,浙江 温州 325027)
耳聋患者中有50%~70%的感音神经性聋与遗传因素有关[1]。在我国,耳聋基因突变以GJB2和线粒体DNA(mtDNA)A1555G较为常见。目前,关于致聋基因与不同听力学表型两者关系的文献较少,本研究将致聋基因与听力受损者的发病年龄、病情进展情况、有无家系及听力学特征等不同的听力学表型相结合进行分析,探讨两者之间的相关性。
1 对象和方法
1.1 对象 收集2012年3月至2017年3月间就诊于温州医科大学附属第二医院育英儿童医院耳鼻咽喉科的269名非综合征型耳聋(non-syndromic hearing loss,NSHL)患者,男147例,女122例,年龄3个月~
84岁,平均12.9(3.6,32.0)岁,平均发病年龄2.0
(0.6,10.0)岁。通过详细的病史采集和体格检查,排除综合征型耳聋患者以及有明确致聋因素的患者,同时进行纯音测听(pure tone audiometry,PTA),针对幼儿及无法配合的患者,进行听觉脑干反应(auditory brainstem response,ABR)、多频稳态反应(auditory steady-state responses,ASSR)。本研究经医院伦理委员会批准,所有患者或家属均签署知情同意书。
1.2 方法
1.2.1 分组方法:按耳聋表型分组,听力学表型判断标准参照《关于非综合征型遗传性听损伤家系遗传学及听力学描述术语建议案》[2-4]:①听力损失程度按照听力较好耳的0.5~4 kHz听阈平均听阈分为轻、中、重、极重度听力损失,范围分别是20~40 dB、40~70 dB、70~95 dB、>95 dB;②听力损失类型根据听力损失的频率分为高频、中频、低频、全频听力损失型,频率段分别是2~8 kHz、 0.5~2 kHz、0.25~0.5 kHz、0.25~8 kHz听力下降为主;③听力图根据纯音听阈损失情况分为平坦型、下降型(包括缓降型、显降型、陡降型)、上升型、切迹型;④按年龄分组:根据发病年龄分为语前聋(0~3岁)、语后聋(>3岁),语后聋又可以分为学龄前组(3~6岁)、学龄组(6~18岁)及成年组 (>18岁);⑤按进展情况分组:按耳聋进展情况分为突发组及非突发组,后者又分为渐进性、进行性或稳定性;⑥按有无家族史分组:按家系中是否有2名及以上成员患NSHI分为耳聋家系组和非耳聋家系组[4]。
1.2.2 基因突变分析:抽取患者外周静脉血,利用Universial DNA分离试剂盒(大连宝生物工程有限公司)分离全血中的基因组DNA,PCR扩增含有整个编码区域的GJB2基因和线粒体12S rRNA基因片段,所用引物由大连宝生物工程有限公司合成。测序结果与经过校正的剑桥标准序列(GenBank)进行比对,确定是否含有与耳聋相关的突变位点[5]。
1.3 统计学处理方法 采用SPSS22.0软件进行统计学分析。计数资料用百分率表示,组间比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基因突变阳性检出率 在269例NSHL患者中,共检出45例(16.73%)携带GJB2基因突变和1例(0.37%)GJB6基因突变。GJB2基因突变的类型有235delC、299delAT、512ins AACG和176dell6bp,235delC中纯合突变有23例、杂合突变17例,共计40例,检出率为14.87%(40/269),占GJB2基因突变患者的88.89%(40/45),占所有病理性突变的36.36%(40/110)。杂合突变中有4例分别与3例299delAT、1例与512ins AACG组成复合杂合突变;299delAT、512ins AACG和176dell6bp均为杂合突变,检出率依次为1.86%、1.12%和0.37%,占GJB2基因突变的比例依次为11.11%、6.67%和2.22%。共检出65例携带mtDNA基因突变,检出率为24.16%(65/269),A1555G、C1494T突变的检出率分别为23.79%(64/269)、0.37%(1/269)。
2.2 不同听力学表型的耳聋基因突变阳性检出率 269例NSHL中轻度、中度、重度以及极重度耳聋分别占9.67%、27.88%、23.42%和39.03%。GJB2、GJB6突变在4组间检出率差异有统计学意义(χ2=10.163,P=0.017);mtDNAA1555G、C1494T突变在4组间检出率差异有统计学意义(χ2=20.932,P<0.001)。160例患者拥有完整可靠的PTA图,听力损失类型主要为高频和全频听力损失组,分别占总人数的56.25%和38.75%,mtDNA基因突变的检出率2组间差异有统计学意义(χ2=4.319,P=0.038)。根据听力图可分为平坦型、下降型、上升型、切迹型,平坦型、下降型为主,分别占总人数的15%和77.5%,2组mtDNA基因突变的检出率组间差异有统计学意义(χ2=11.777,P<0.001)。见表1。

表1 不同听力学表型常见基因突变阳性率的比较[例(%)]
2.3 不同发病年龄、病情进展及家族史的耳聋基因突变阳性检出率 语前聋组、学龄前组、学龄组和成年组间GJB2、GJB6突变的阳性检出率和mtDNAA1555G、C1494T突变的阳性检出率差异均有统计学意义(χ2=21.199、18.357,P<0.001)。从听力损失的进展情况来看,绝大多数(97.78%)的患者为非突发性,仅6例患者为突发性,而其中3例(50.00%)为mtDNAA1555G突变,病史中均有氨基糖苷类药物史。根据有无家族史分组,与非耳聋家系组比,耳聋家系组mtDNAA1555G、C1494T突变的阳性检出率较高,差异有统计学意义(χ2=31.899,P<0.001),见表2。
2.4 不同基因突变患者的听力学表型 269例NSHL主要表现为全频或高频听力下降,听力图为平坦型或下降型,GJB2突变率在不同听力表型组中差异无统计学意义(P>0.05),而mtDNAA1555G、C1494T突变检出率在高频听力损失型的中明显高于其他组。携带该突变的患者为典型的高频,见图1。

表2 不同发病年龄、进展及家族史间常见基因突变阳性率的比较[例(%)]
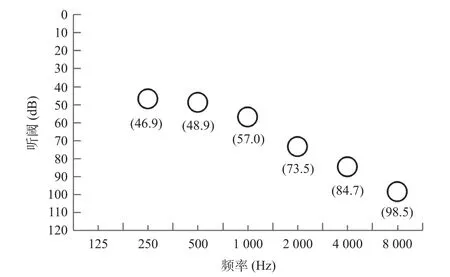
图1 携带mtDNA A1555G、C1494T突变患者的平均听阈
3 讨论
耳聋是最主要的感觉缺陷之一,我国每年新增6~8万听障儿童[7-8]。随着对耳聋研究的不断深入和基因检测技术的迅速发展,耳聋基因检测成为听力受损患者重要的诊断依据。GJB2基因突变可引起编码的缝隙连接蛋白26(connexin26,Cx26)异常,导致K+进入内淋巴液的循环受阻,进而引起Corti氏器钾中毒,最终引起感音神经性聋,是最常见的致聋因素[8-9]。GJB6基因编码Cx30,可与Cx26形成异型缝隙连接[10]。A1555G和C1494T突变是mtDNA中的热点突变,以A1555G突变为主,可引起对氨基糖甙类抗生素(aminoglycoside antibiotics,AmAn)超敏感[5,9-12]。本研究的GJB2、GJB6致病突变率为17.10%,与全国的总体突变率相似[8],但其他各地的检出率差别较大,这可能与地域、民族之间的差异以及样本的纳入标准不同有关[13-16];mtDNAA1555G、C1494T阳性检出率为24.16%,远高于全国水平[8],也高于本课题组之前的研究结果[3],这可能与近几年加大宣传AmAn的耳毒性有关。另外,通过家系调查发现,此次研究对象中纳入了部分课题组前期研究中携带mtDNAA1555G突变家系的母系成员,排除这些干扰因素,先证者mtDNAA1555G、C1494T阳性检出率降至15.43%(27/175)。
GJB2为常染色体隐性遗传,本研究中,GJB2基因突变的类型有235delC、299delAT、512ins AACG和176 dell6bp。其中235delC最常见,含纯合突变23例、杂合突变17例,检出率为14.87%,占GJB2基因突变患者的88.89%,4例杂合突变与3例299delAT、 1例与512ins AACG组成复合杂合突变。有研究证实GJB2纯合突变患者的听力损失程度重于复合杂合突变患者[17],本研究中复合杂合突变仅4例,未能得出有效的统计学结果。
国内耳聋基因检测多集中在特殊教育学校、新生儿及人工耳蜗的患者[18-19],在听力损失程度上主要为重度、极重度,极少包含轻、中度听力受损者。本研究收集了269例NSHL患者,轻度、中度、重度以及极重度分别占9.67%、27.88%、23.42%和39.03%,虽轻、中度听力受损者不足一半,但已满足统计学的分组要求。GJB2突变在重度听力受损者中的检出率最高(25.40%),其次是极重度(20.95%),这与王国建等[20]的报道略有不同;而mtDNA基因突变在轻度听力受损者中的检出率最高(38.46%),其次是中、重度(分别是34.67%,30.16%),而在极重度听力受损者中检出率最低(9.52%),这与王国建等[20]的报道有明显的差异。这提示我们在临床工作中,即使患者听力损失较轻,也需建议进行mtDNA基因筛查。
mtDNAA1555G、C1494T突变患者主要表现为高频听力损失型,研究表明,当没有接触AmAn时,携带A1555G、C1494T突变者,在发病年龄、听力损失程度、听力曲线及家系耳聋外显率等存在不同程度的差异[21-22],有些患者平素无自觉听力下降,仅在测听时检出高频段下降, 而低、中频段正常或仅为轻度下降。故临床上遇高频听力下降为主或听力图呈下降型的患者,即使语频段听力正常,也不能忽视mtDNAA1555G、C1494T的检测。
从发病年龄上看,在语前聋中GJB2、GJB6的检出率高于mtDNAA1555G、C1494T,在语后聋中则刚好相反。随年龄的增长,GJB2、GJB6的突变率呈下降趋势,mtDNAA1555G、C1494T突变在各个年龄段均可发病,主要集中在学龄期,这与王芳等[17]的报道一致。有研究[23-24]建议新生儿听力筛查联合耳聋基因检测,有利于耳聋的早期发现和早期干预。因此,对于语前聋尤其是新生儿,要重视GJB2筛查,对于语后聋,则建议行mtDNAA1555G、C1494T检测。
从听力损失的进展情况来看,绝大多数(97.78%)的患者为进行性或稳定性,仅6例患者为突发性,病史中可以排除高热、外伤等高危因素。其中3例(50.00%)为mtDNAA1555G突变,患者主诉在发病之初有AmAn接触史。对于突发的双耳感音神经性听力下降,特别是有可疑药物史时,在排除大前庭水管综合征(large vestibular aqueduct syndrome,LVAS)相关的致病基因SLC26A4外,也要考虑mtDNA基因突变。LVAS的临床表现为儿童时期的听力下降,有家族史,听力上以进行性下降的感音神经性聋为主,外伤、剧烈运动可诱发眩晕及突聋[25],但本研究并未进行SLC26A4检测,这也是本研究不足之处。
按有无耳聋家族史进行分组,GJB2突变在两组间差异无统计学意义,这提醒我们临床医师对语前聋患者,即使无家族史,也要进行GJB2检测。mtDNAA1555G、C1494T突变在有家族史的患者中检出率高达35.50%,建议把耳聋家族史列为高危因素,对此类新生儿,不管初筛是否通过,都要进行mtDNA易感基因筛查。
目前,研究不同的听力学表型与常见耳聋基因突变相关性的文献较少,有研究[3,17]通过对GJB2和mtDNAA1555G突变的患者进行听力学分析,从反面探讨基因突变与临床听力学、发病年龄的相关性,而本研究是通过对不同听力学表型的患者进行GJB2和mtDNAA1555G、C1494T检测,更直观地反映不同的听力学表型和耳聋常见基因检出率的关系,将有助于临床医师预判最有可能携带耳聋常见基因的听障人群。

