抗弓形虫伴侣蛋白60多克隆抗体制备与鉴定
曹佳欣,程琳妍,刘淑贤,谭峰
(温州医科大学,浙江 温州 325035,1.眼视光学院 生物医学工程学院;2.第一临床医学院;3.基础医学院)
刚地弓形虫(Toxoplasma gondii)是一种机会性致病原虫,可寄生于人和哺乳动物、鸟类、爬行类等动物的有核细胞内。据评估,全球约1/3人口血清弓形虫抗体呈阳性[1],所致的弓形虫病是一种重要的人畜共患疾病。当宿主免疫力下降时,弓形虫常可引起弓形虫脑炎、弓形虫眼病等,严重时可致死亡[2]。寻找合适的弓形虫防治药物靶点对于弓形虫病的防治具有重要意义。
顶质体是大多数顶复门寄生虫(包括弓形虫)中一个独特的、叶绿体样细胞器,对于虫体发育具有极其重要的作用,能够为虫体脂肪酸、类异戊二烯和血红素等生物合成提供重要场所[3]。由于顶质体不存在于其他哺乳动物细胞中,因而被认为是特异性抑制或杀灭弓形虫的理想靶点[4]。与其他质体相似,绝大多数顶质体蛋白为核编码蛋白[5-6],分别为包含有经典的靶向肽序列蛋白和缺失经典的靶向肽序列蛋白[7]。弓形虫顶质体基质蛋白Cpn60蛋白(TgCpn60)属于前者。
Cpn60为第I类伴侣蛋白,因其大小为60 kDa,一般称为Chaperonin60。目前已经发现的有两类伴侣蛋白,第I类伴侣蛋白最常见,广泛存在于原核和真核生物中的寡聚蛋白复合体,如存在于细菌(GroEL)、 质体(Cpn60)和线粒体(Hsp60)。细菌伴侣蛋白[8-9]和线粒体伴侣蛋白[10-11]已有较深入的研究,在高等植物中,Cpn60被证实具有帮助蛋白完成折叠装配的功能[12]。而在顶复门寄生虫中,Cpn60的生物学功能及作用机制尚未明确。据此,我们在弓形虫数据库ToxoDB中找到弓形虫伴侣蛋白TgCpn60的编码基因,通过原核表达TgCpn60蛋白,制备其特异性多克隆抗体,为研究该蛋白生物学功能、观察顶质体内稳态提供实验材料。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒、虫株及实验动物:原核表达载体pGEX-4T-1、大肠埃希菌(E.coli)TOP10和BL21感受态细胞、人包皮成纤维细胞(human foreskin fibroblasts,HFF)、弓形虫RH株速殖子均为本实验室保存。pFNR-RFP质粒为法国国家科学研究中心Sébastien Besteiro教授馈赠。BALB/c小鼠购自温州医科大学实验动物中心,实验动物许可证号:SYXK(浙)2015-0009。
1.1.2 PCR引物设计与合成:①巢式PCR引物:根据ToxoDB中TgCpn60基因编码序列(TGGT1_ 240600), 并针对编码该蛋白C末端168个氨基酸残基的507 bp 基因序列设计两对引物:TgCpn60-P1:5’-TGATCGG TGCGTCGACAGAAAC-3’;TgCpn60-P2:5’-ACGGTAAGCGG CAAGTTAGGTAGAG-3’;TgCpn60-P3:5’-CGGGATCCCTCGA AACTGGCTACGTTCCCG-3’;TgCpn60-P4:5’-CCGCTCGAGT CATGCCATTGGCATGTCTGGTAC-3’(下划线部分分别为限制性内切酶BamHI和XhoI的酶切位点)。②重组质粒鉴定PCR引物:根据载体pGEX-4T-1序列设计以下通用测序引物:TgCpn60-F:5’-GACCCAATGTGCCTGG AT-3’;TgCpn60-R:5’-CCGGCATCCGCTTACAGA-3’,引物均由北京六合华大基因科技有限公司合成。
1.1.3 主要试剂:反转录试剂盒HiScript®II 1st Srand cDNA Synthesis Kit购自南京诺唯赞生物科技有限公司;KAPA HiFi HotStart ReadyMix PCR Kit购自美国KAPA Biosystems公司;4×蛋白上样缓冲液购自美国Invitrogen公司;DNA凝胶回收试剂盒购自美国Axygen公司;质粒提取试剂盒购自美国OMEGA Bio-tek公司;限制性内切酶BamHI、XhoI、T4DNA连接酶购自美国Thermo Fisher Scientific 公司;GoTaqTMGreen Master Mix购自美国Promega公司;IPTG购自美国Sigma公司;蛋白酶抑制剂购自瑞士Roche生物公司;蛋白纯化Glutathione-SepharoseTM4B购自德国QIAGEN公司;Protein A亲和介质购自美国Thermo Fisher Scientific公司;辣根过氧化物酶标记的山羊抗小鼠IgG抗体购自合肥Biosharp生物科技公司;Dlight 488山羊抗鼠IgG抗体购自美国EarthOx Life Science公司;0.22 μm PVDF转移膜购自美国Millipore公司。
1.2 方法
1.2.1 巢式PCR扩增目的片段:弓形虫RH株速殖子常规培养,待虫株完全出胞,将虫体悬液经3 μm滤膜过滤后离心收集虫体。以TRIzol法提取虫体总RNA并反转录合成cDNA,以cDNA为模板,PCR扩增编码该TgCpn60蛋白C末端的507 bp编码基因,第一轮PCR反应体系为:cDNA模板0.5 μL,TgCpn60-P1、TgCpn60-P2引物(10 μmol/L)各0.5 μL,10×Buffer for KOD Plus 2.5 μL,dNTPs(2 mmol/L each) 2 μL,MgSO4(25 mmol/L)1 μL,KOD Plus 0.5 μL, 加ddH2O至25 μL。反应条件为:94 ℃预变性5 min, 94 ℃变性30 s、58 ℃退火30 s、68 ℃延伸75 s,共15个循环,68 ℃再延伸10 min;第二轮PCR反应体系为:第一轮PCR产物1.5 μL,TgCpn60-P3、TgCpn60-P4引物(10 μmol/L)各1 μL,10×Buffer for KOD Plus 5 μL,dNTPs(2 mmol/L each) 4 μL,MgSO4(25 mmol/L)2 μL,KOD Plus 1 μL,加ddH2O至50 μL。反应条件为:94 ℃预变性5 min, 94 ℃变性30 s、59 ℃退火30 s、68 ℃延伸1 min, 共3个循环,94 ℃变性30 s、66 ℃退火30 s、68 ℃ 延伸1 min,共30个循环,68 ℃再延伸10 min。
1.2.2 原核表达质粒pGEX-4T-1-TgCpn60C168AA的构建和鉴定:限制性内切酶BamHI、XhoI分别双酶切TgCpn60C168AA的PCR产物和pGEX-4T-1质粒,37 ℃酶切3 h。2%琼脂糖凝胶电泳分离酶切产物,用胶回收试剂盒进行回收,T4DNA连接酶将目的基因和载体酶切回收产物于16 ℃连接过夜。连接产物利用热激法转化入感受态TOP10,涂板氨苄抗性平板,37 ℃ 倒置培养过夜,挑取单菌落利用引物TgCpn60-F和TgCpn60-R进行菌液PCR鉴定,反应体系为:GoTaqTMGreen Master Mix酶10 μL,TgCpn60-F、TgCpn60-R 引物(10 μmol/L)各1 μL,菌液2 μL,加ddH2O至20 μL。反应条件为:95 ℃预变性5 min,95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸2 min,共25个循环,72 ℃再延伸5 min。阳性菌落扩大培养后送北京华大基因科技有限公司测序验证。
1.2.3 重组蛋白GST-TgCpn60C168AA的诱导表达、纯化和鉴定:将测序正确的重组质粒pGEX-4T-1-TgCpn60C168AA热激法转化入BL21感受态细胞,挑取单克隆菌落,加入IPTG至终浓度1.0 mmol/L,于37 ℃常规诱导培养6 h。将诱导后产物离心收集菌体,沉淀超声裂解后4 ℃、12 000 r/min离心,Glutathione-SepharoseTM4B介质纯化上清液中的GST-TgCpn60C168AA重组蛋白,常规SDS-PAGE电泳分析TgCpn60蛋白表达情况。
1.2.4 抗体制备:取纯化后的GST-TgCpn60C168AA融合蛋白适量加入等体积的弗氏完全佐剂充分混匀后背部皮下多点注射免疫5只BALB/c小鼠,1 mg/只。之后每隔15 d,0.5 mg/只抗原加等体积的弗氏不完全佐剂加强免疫1次,共3次。
1.2.5 抗体效价及特异性鉴定:免疫结束后,采集鼠血清,将免疫鼠血清以起始浓度为1:1 000进行3倍梯度稀释,浓度分别为1:1 000、1:3 000、1:9 000、1:27 000、1:81 000、1:243 000,稀释后的鼠血清作为一抗,以免疫前鼠血清(1:1 000)作为对照,以GST-TgCpn60C168AA蛋白包被酶标板进行间接ELISA评价免疫后小鼠血清抗体效价。将ELISA检测效价最高的小鼠血清混合,用平衡缓冲液稀释到2 mL,然后用0.5 mL的Protein A填料进行亲和纯化。洗脱的目的蛋白用PBS(pH7.4)透析两次后,使用截流量为10 kDa的超滤管浓缩后分装保存于-80 ℃。分别取纯化前蛋白、穿透液、洗杂液和洗脱液进行SDS-PAGE电泳以评价纯化效果。
1.2.6 多抗识别弓形虫内源性TgCpn60:提取虫体总蛋白行SDS-PAGE电泳后,分别以免疫前鼠血清和制备的鼠抗TgCpn60C168AA多克隆抗体(1:1 000)作为一抗,羊抗鼠HRP-IgG(1:5 000)作为二抗,Western blot检测抗体特异性。以重组GST-TgCpn60C168AA蛋白为阳性对照,HFF细胞总蛋白为阴性对照。
1.2.7 间接免疫荧光法(indirect immunofluorescence,IFA)检测TgCpn60蛋白与 TgFNR蛋白共定位情况:将纯化好的50 μg pFNRRFP质粒电转入弓形虫RH株,电转条件为:电压1 700 V、脉冲时程176 μs、脉冲次数2次、脉冲间隔100 ms。电转72 h后进行IFA试验,常规固定、透化、封闭虫体,分别以免疫前鼠血清和制备的鼠抗TgCpn60C168AA多克隆抗体作为一抗、Dlight 488山羊抗鼠IgG抗体作为二抗。染色结束后进行DAPI核染、封片。玻片置于荧光显微镜下观察、拍照。
2 结果
2.1 目的基因的PCR扩增结果 TgCpn60C168AA编码基因的目的片段理论大小为507 bp,巢式PCR产物经琼脂糖凝胶电泳后,在约507 bp处可见一条清晰的特异性扩增条带,与理论大小一致(见图1)。
2.2 重组质粒pGEX-4T-1-TgCpn60C168AA的鉴定 采用载体上的通用引物(包含靶基因在内的全片段长度为806 bp)对重组质粒pGEX-4T-1-TgCpn60C168AA进行PCR鉴定。电泳结果表明,所挑取的5个单克隆菌落的目的基因片段均约为806 bp(见图2)。测序验证,结果表明:该质粒含有一个507 bp、与TgCpn60C168AA编码序列完全一致的片段序列,证实pGEX-4T-1-TgCpn60C168AA重组质粒构建成功。
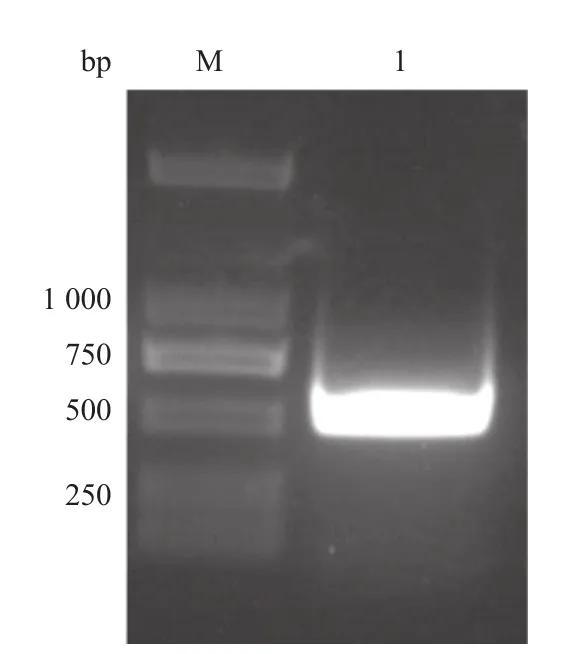
图1 弓形虫TgCpn60C168AA编码基因PCR产物

图2 重组质粒pGEX-4T-1-TgCpn60C168AA鉴定结果
2.3 GST-TgCpn60C168AA融合蛋白的表达、纯化和鉴定 TgCpn60C168AA蛋白预期大小约17 kDa,而GST标签蛋白约24 kDa,因此GST-TgCpn60C168AA融合蛋白的全长约为41 kDa。将鉴定正确的重组质粒pGEX-4T-1-TgCpn60C168AA转化至BL21表达菌中,以IPTG诱导表达后,经Glutathione-SepharoseTM4B介质纯化,SDS-PAGE检测可见大量目的蛋白,其蛋白大小符合预期(见图3),纯化后蛋白浓度为16.8 mg/mL。
2.4 鼠抗GST-TgCpn60C168AA多克隆抗体纯化 经免疫后,以免疫前鼠血清为对照,ELISA法测定5只免疫鼠抗GST-TgCpn60C168AA血清效价,其中4只鼠血清抗体效价达到1:81 000。将这4只鼠血清收集后经亲和层析纯化,SDS-PAGE检测显示,纯化后的多克隆抗体纯度在90%以上(见图4)。
2.5 评价鼠抗GST-TgCpn60C168AA多抗识别弓形虫内源性TgCpn60的能力 提取弓形虫全虫蛋白行Western blot检测,以免疫前鼠血清作为一抗发现血清不能识别弓形虫内源性TgCpn60,而鼠抗GST-TgCpn60C168AA多克隆抗体与弓形虫全虫蛋白在 40、60 kDa附近分别出现反应带,宿主细胞组作为阴性对照,与鼠抗TgCpn60无特异性结合(见图5)。
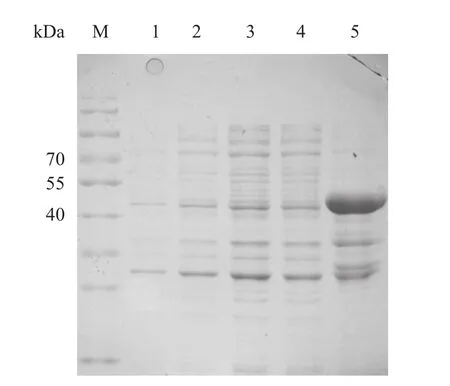
图3 GST-TgCpn60C168AA融合蛋白SDS-PAGE鉴定结果
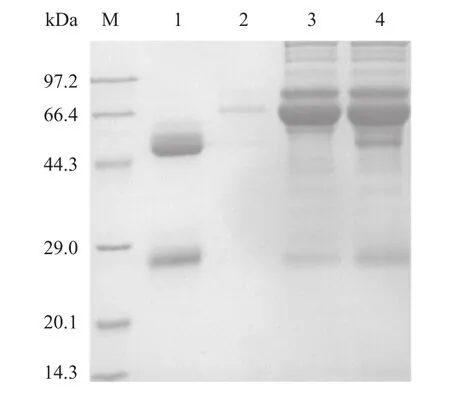
图4 SDS-PAGE鉴定纯化后鼠抗GST-TgCpn60C168AA多克隆抗体

图5 Western blot分别检测免疫前鼠血清(左)和抗GST-TgCpn60C168AA多抗(右)与内源性TgCpn60反应
2.6 IFA检测TgCpn60蛋白与TgFNR蛋白共定位情况 将pFNR-RFP质粒瞬时转染弓形虫后,分别以免疫前鼠血清和鼠抗GST-TgCpn60C168AA多克隆抗体为一抗进行IFA检测,结果显示,免疫前鼠血清不能识别虫体内源性TgCpn60蛋白,而制备的多克隆抗体可以识别虫体内两种形式的TgCpn60蛋白,并且TgCpn60成熟蛋白与TgFNR(顶质体外腔膜标志物)存在共定位情况(见图6)。

图6 TgCpn60与TgFNR共定位IFA实验结果(箭头所指为共定位位置)
3 讨论
弓形虫虫体在分裂过程中,亲代虫体的顶质体会附着在中心体上,随着细胞核分裂而分离,使得每个子代虫体都含有一个顶质体[13],若干扰此过程,虫体会出现迟发型死亡表型[14]。虽然顶质体具有独立、可自主复制的基因组[15],但绝大多数顶质体蛋白仍由核基因编码,核编码蛋白如何定位于顶质体以及如何输入至顶质体四层膜结构尚未明确。TgCpn60蛋白已经被证实是定位于顶质体基质腔的核编码蛋白[16],是研究核编码蛋白如何输入至顶质体的理想靶标。
TgCpn60蛋白属于含有经典的靶向肽序列蛋白,该类蛋白的N端含有一个由信号肽和转运肽组成的靶向肽。在胞浆合成前体蛋白后,信号肽驱动前体蛋白进入内质网加工,导致信号肽被切除,从而暴露转运肽,后者即可将前体蛋白转运至顶质 体[17-18],转运肽被切除,前体蛋白成为成熟蛋白发挥功能[19]。由于TgCpn60蛋白N端具有靶向肽,其N端表达的蛋白不适于作为免疫原,因此本研究诱导表达了TgCpn60蛋白C末端的168个氨基酸残基,以此作为免疫原免疫BALB/c小鼠,获得了相应的鼠多克隆抗体,说明该片段具有强抗原性。再利用纯化后的多克隆抗体进行Western blot检测,发现其可识别内源性TgCpn60蛋白且具有两条明显的反应条带,表明我们制备的多克隆抗体能够特异性识别TgCpn60蛋白的前体蛋白和成熟蛋白两种形式。
NADP+铁氧化还原蛋白还原酶(ferredoxin-NADP+reductase,FNR)广泛存在于三大类生命形式:真核生物、细菌和古生菌。Fd/FNR电子传递系统参与了多种关键的代谢过程,从光合作用和能量代谢到各种生物合成反应[20]。含有顶质体的顶复门原虫同样拥有Fd和FNR两种蛋白,两者均定位于顶质体中[21-23]。与TgCpn60相同,核编码的TgFNR蛋白因其N端具有一个顶质体转导肽,这段转导肽可介导TgFNR转运入顶质体外腔膜,因而被认为是顶质体的标志蛋白[24-25]。该蛋白虽然可以指示顶质体的位置,由于定位于顶质体外腔膜,无法反映顶质体基质的形态及大小变化,因此,为更精确地观察顶质体基质动态变化,本研究制备了TgCpn60抗体。为了进一步明确本研究制备的多克隆抗体可以识别虫体内的天然TgCpn60,我们以TgFNR蛋白为参照,通过瞬时电转pFNR-RFP质粒至虫体内,并利用IFA技术检测TgCpn60蛋白与TgFNR蛋白共定位情况,发现两种蛋白存在共定位现象,且与TgFNR蛋白发生共定位的为转运至顶质体的TgCpn60蛋白,即TgCpn60成熟蛋白,而TgCpn60前体蛋白未进入顶质体,因此与TgFNR蛋白无共定位现象,两种形式的TgCpn60蛋白都能够被TgCpn60抗体所识别,该实验结果同样证实本研究成功制备了鼠抗TgCpn60多克隆抗体。
质体Cpn60同源物在多物种中的作用举足轻重,具有多种生物学功能[8-11]。TgCpn60蛋白定位于顶质体基质腔,推测其在顶质体稳态中可能具有重要功能,该蛋白的其他生物学功能有待进一步研究。本实验获得的可识别弓形虫内源性TgCpn60蛋白的多克隆抗体,可作为顶质体基质的指示剂,用于评价、观察顶质体在世代遗传过程中的形态变化,同时该抗体的获得可为进一步研究TgCpn60生物学功能提供必要的实验材料,也将有助于完善核编码蛋白输入顶质体途径。
——一道江苏高考题的奥秘解读和拓展

