锌对镉胁迫下黄菖蒲抗氧化酶系统及富集镉的影响
马欢欢 ,高 峰 ,樊向阳 ,胡 超 , 崔二苹 ,刘春成 ,莫 宇 ,张 茜
(1.中国农业科学院 农田灌溉研究所,河南 新乡 453002;2.中国农业科学院 研究生院, 北京100081;3.中国农业科学院 农业水资源高效安全利用重点开放实验室,河南 新乡 453002)
0 引 言
【研究意义】镉(Cd)污染在世界大多数国家普遍存在,是非常棘手的环境问题之一。不合理的工业采矿以及化学品的滥用导致了土壤和水生态系统被重金属不同程度地污染[1]。一些耕地资源充足的发达国家,针对不同程度的Cd 污染耕地,可以采取优胜劣汰政策,将质量好的耕地用于农业生产活动,将Cd 污染农田用于种植林木或其他非农业生产活动[2]。根据2014 年《全国土壤污染状况调查公报》,我国的土壤环境状况不容乐观,耕地土壤存在较大的污染问题。重金属Cd 的点位超标率达到7%[3],且我国人均耕地面积只占世界平均水平的1/3,为了粮食安全,必须采取一定措施来治理土壤Cd 污染问题。【研究进展】Pedro 等[4]研究表明,当Cd 在植物体内积累到一定水平时,会对植物产生一定的毒性,植物会表现出枯叶、侧根数减少的症状,在一定条件下甚至会导致死亡。Cd 对大多数植物和生物都是有毒的,植物根系从土壤和水中吸收Cd,进而进入食物链[5],对人类健康构成威胁[6]。Zhao 等[7]研究了不同途径对稻田系统Cd 的输入,发现灌溉水Cd 输入量达到每年1~400 g/hm2。Hou 等[8]调查发现,灌溉水是长江三角洲农田Cd 主要来源。灌溉水Cd 由于其赋存形态生物活性高,迁移转化迅速,而且水稻的灌溉定额很高,输入稻田Cd 通量较大,灌溉水带来的Cd 需引起重视[9]。对于水源中Cd 的净化技术国内外已开展了大量研究。人们开发了各种方法来修复Cd 污染的土壤和水[10]。1980 年以来,人工湿地由于其环保功能,同时具有较高的生态价值,成为一种备受关注的污水处理工艺。植物是人工湿地的重要组成部分。湿地植物已被证明是一种从生物学上去除水中Cd 的经济技术,并受到越来越多的关注[11]。有研究表明,西伯利亚鸢尾具有较强的吸收和富集重金属的能力,且主要在根部[12]。张玲等[13]研究人工湿地基质以及湿地植物对重金属Cd、Pb 的富集特性,结果显示,灯芯草对复合重金属Cd、Pb 有较好的富集特性,并且灯芯草的根、茎、叶对重金属Cd、Pb 的富集能力也各有不同,其中灯芯草根部对重金属Cd、Pb 的富集效果明显大于茎、叶。湿地植物必须选择高度积累并能承受各种有毒胁迫的植物才能取得好的效果[14]。研究发现,当菖蒲中Cd 质量浓度达到1 000 mg/L 时,菖蒲能够健康地生长[15]。Ma 等[16]研究发现当Cd 的质量浓度为0.5 mg/L 时,会促进黄菖蒲的生长。因此,本研究采用黄菖蒲作为受试植物。Cd 胁迫对植物造成的氧化胁迫是镉毒害机理之一,许多研究显示Cd 导致植物体内活性氧自由基积累,造成蛋白质结构破坏和生物膜系统损伤,对植物造成严重伤害[17]。Zn 和Cd属于同一族元素,具有相同的核外核结构和相似的化学性质,在水稻细胞中具有相同的转运通道[18]。目前关于Zn 对作物吸收Cd 影响的结论并不一致。有研究表明Zn 主要起协同作用[19-21],也有研究表明起拮抗作用[22-24]。She 等[25]发现添加Zn 可以抑制苎麻中Cd 的积累,而Wang 等[26]发现在水稻土中添加Zn 可以提高水稻籽粒中含Cd 量。土壤中Zn 可以增加大白菜可食用部分的含Cd 量[23]。水稻中Cd 的质量分数与土壤中Zn 的质量分数显著正相关,表明Zn 的存在会促进作物对Cd 的吸收抗性[26]。这些相互矛盾的结果表明,Zn 对Cd 植物吸附的影响是复杂的,还需要进一步深入研究[27]。【拟解决的关键问题】本研究通过水培试验研究Cd 胁迫对黄菖蒲抗氧化系统的影响,以及Cd 在黄菖蒲植株中的积累特性,探讨黄菖蒲对重金属污染水体的修复机理。
1 材料与方法
1.1 试验材料
试验于2019 年在中国农业科学院农田灌溉研究所洪门野外科学观测站的人工气候室进行。将饱满的黄菖蒲种子在2% NaClO 溶液中消毒30 min,然后在去离子水中浸泡24 h,最后在育苗基质中培育。育苗基质由1∶1∶1 的泥炭、珍珠岩、园艺蛭石组成。14 d后,选取大小均匀、生长一致的幼苗移入8 L 的水培箱中(长41 cm×宽24 cm×高14 cm)中,在霍格兰氏营养液中生长使其逐渐适应营养液环境。待黄菖蒲幼苗适应营养液的生长环境后,选取大小均匀、生长一致的幼苗将其分别移栽到2 L 充满全营养液的聚乙烯小桶中,备用于试验。
1.2 试验设计
试验设置了12 个处理。Cd 采用CdCl2·2.5H2O(优级纯)。Cd2+的质量浓度分别设置为0、0.5、5 mg/L,分别记为Cd0、Cd0.5、Cd5。Zn 采用ZnSO4·7H2O(优级纯)。Zn2+的质量浓度分别设置为0、50、100、150 mg/L,分别记为Zn0、Zn50、Zn100、Zn150。Hoagland营养液配方:4.002 mmol/L Ca(NO3)2·4H2O,5.005 mmol/L KNO3,2 mmol/L MgSO4,1 mmol/L KH2PO4,22.4 mmol/L FeEDTA,1 mmol/L NH4NO3,0.2 μmol/L CuSO4,1.2 μmol/L Na2MoO4,5 μmol/L KI,100 μmol/L H3BO3,66 μmol/L MnSO4,2 μmol/L ZnSO4,2 μmol/L CoCl2组成。溶液pH 值用HCl 或NaOH 调整为5.5。每个聚乙烯小桶中种植3 株植物,所有处理均设置3 次重复。聚乙烯小桶完全随机放置在人工气候室中,设置为12 h、30 ℃日光周期,12 h、20 ℃黑暗周期,光照强度设置为1 000 μmol2/s 来模拟植物生长的真实环境。培养液每3 天更换1 次。
1.3 测试指标与方法
经过45 d 的处理,收获植物,立即用去离子水冲洗干净,并将植物根和叶分离。将植物样本一部分在105 ℃的烘箱中杀青20 min,然后在60 ℃的温度下干燥2 d 直至达到恒质量,用于重金属Cd 的测定。第2 部分用液氮迅速冷冻,并储存于-80 ℃的冰箱中,用于植物超氧化歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)以及丙二醛(MDA)的测定。
1.3.1 SOD、POD、CAT 以及MDA 的测定
SOD、POD、CAT 以及MDA 分别采用苏州科铭生物技术有限公司生产的超氧化物歧化酶测试盒、过氧化物酶测试盒、过氧化氢酶测试盒和丙二醛测试盒测定。
1.3.2 黄菖蒲植物组织中Cd 的测定
烘干后的根、叶用研磨机磨碎后过100 目筛,然后在聚氟四乙烯(PTFE)消煮管中称取约0.20 g 植物样,加入10 mL HNO3(优级纯),用微波消解仪(MarsCEM 240/50)进行消解,在120 ℃下消解3 min,160 ℃消解3 min,180 ℃消解25 min,同时做4 个空白。消解结束后,用5 mL 1%的HNO3清洗消煮管3 次,并转移至50 mL 量瓶中,用去离子水定容至50 mL,待测。采用原子吸收分光光度法(AA-6300FG,岛津)测定溶液中的Cd。
1.4 数据处理
富集系数(BCF)表征黄菖蒲积累重金属Cd 的能力;转运系数(TF)表征重金属通过根部进入地上部的能力,计算式为:

式中:BCF 为黄菖蒲对重金属Cd 的富集系数;S 为黄菖蒲地上部或地下部重金属量(mg/kg);T 为溶液中相应重金属量(mg/L)。富集系数越大,表示黄菖蒲积累重金属能力越强[28]。

式中:TF 为重金属Cd 转运系数;S 为黄菖蒲地上部位重金属含Cd 量;R 为根部含Cd 量。TF 越大,表明重金属从根系向地上部器官转运能力越强[29]。
所有数据均采用DPS 和Excel 2010 进行统计分析和作图。
2 结果与分析
2.1 Zn对Cd胁迫下黄菖蒲超氧化物歧化酶活性的影响
加Zn 处理下,Cd 对黄菖蒲根和叶中SOD 活性影响如图1 所示(图中不同小写字母代表在p<0.05水平有显著性差异)。添加Zn 后,黄菖蒲根中SOD活性显著提高,其中Zn100 处理组中SOD 活性达到最大值,Zn50 处理下,在Cd0.5 和Cd5 处理中SOD活性略微下降,但不显著。不添加Cd 的空白对照组中,不同质量浓度Zn 处理下的黄菖蒲根SOD 活性均高于对照组。然而,由图1(b)可见,黄菖蒲叶中SOD 活性与根中SOD 活性的变化趋势有较大差别。在Cd0.5 和Cd5 处理组中,Zn 的添加显著降低了叶中SOD 活性。不添加Cd 的空白对照组中,除Zn50处理组略低于Zn0 处理外,其他质量浓度Zn 处理下的黄菖蒲根SOD 活性均显著高于对照组,与根中对照组SOD 酶的变化趋势相同。可见,在不同质量浓度Cd 和Zn 处理下,黄菖蒲根和叶中SOD 缓解重金属胁迫的作用机制不同,受其所处的根和叶的内部环境影响。
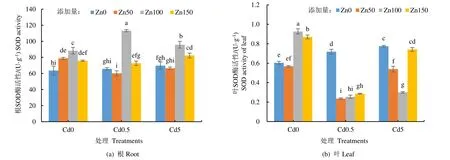
图1 Cd 胁迫下添加Zn 黄菖蒲SOD 活性 Fig.1 Zn on SOD activity of Iris pseudacorus under stress of Cd
2.2 Zn 对Cd 胁迫下黄菖蒲过氧化物酶活性的影响
加Zn 处理下,Cd 对黄菖蒲根和叶中POD 活性影响如图2 所示。由图2(a)可见,在不添加Cd 处理组中,除Cd0 Zn150 处理组外,添加Zn 处理后,黄菖蒲根中POD 活性显著提高。不同质量浓度Cd处理下,均在Zn100 达到最大值。不添加Cd 的对照组中,Zn150 处理下,POD 活性明显降低,可见单独添加高质量浓度的Zn 对黄菖蒲根POD 活性造成损伤。
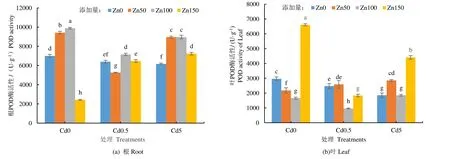
图2 Cd 胁迫下添加Zn 黄菖蒲POD 活性 Fig.2 Zn on POD enzyme activity of Iris pseudacorus under the stress of Cd
由图2(b)可见,对照组中,单独添加高质量浓度Zn(Zn150),叶POD 活性反而达到最大值,单独添加Zn 后,黄菖蒲根和叶中POD 活性变化趋势相反。Cd0.5 和Cd5 处理下,叶POD 变化趋势相同,均是先升高,后降低,再升高,在Zn100 处理达到最小值。对于叶中POD 活性,没有加Zn 处理组中POD活性随着Cd 质量浓度的增加显著下降,说明随着Cd质量浓度的提高,POD 活性受到破坏。Zn50 处理组中,POD 活性随着Cd 质量浓度的增加逐渐增加,对于Zn100 和Zn150 处理组,POD 活性随Cd 质量浓度的增加先降低后升高。
2.3 Zn 对Cd 胁迫下黄菖蒲过氧化氢酶活性的影响
加Zn 处理下,Cd 对黄菖蒲根和叶中CAT 活性影响如图3 所示。由图3(a)可见,对于黄菖蒲根中CAT 活性,在Zn0 处理组中,CAT 活性随Cd 质量浓度的增大而增大,Zn50 和Zn150 处理组中,CAT 活性随Cd 质量浓度的增加先降低后升高,在Cd0.5 处理组达到最低水平。Zn100 处理组中CAT 活性随Cd浓度的增加而减小。不添加Cd 的对照组中,CAT 活性均高于Zn0,且随着Zn 质量浓度的升高而降低。
由图3(b)可见,对于叶中CAT 活性,只有Cd0.5 Zn50 处理组的CAT 活性显著高于对照组,Cd0 Zn100和Cd0 Zn150 处理组中CAT 活性与对照组相当,其他均显著低于对照组。黄菖蒲根和叶中CAT 活性均在Cd0.5 Zn150 处理达到最小值。

图3 Cd 胁迫下添加Zn 黄菖蒲中CAT 活性 Fig.3 Zn on CAT enzyme activity in Iris pseudacorus under the stress of Cd
2.4 Zn 对Cd 胁迫下黄菖蒲丙二醛量的影响
加Zn 处理下,Cd 对黄菖蒲根和叶中MDA 量的影响如图4 所示。由图4(a)可见,加Zn 处理后,除叶Cd0 Zn150、Cd0.5 Zn50 处理组外,黄菖蒲根和叶中MDA 量均显著低于不加Zn 的对照组。对于黄菖蒲根中MDA 量,添加不同质量浓度的Zn 显著降低了MDA 量,但添加不同质量浓度Zn 处理之间没有显著差异。
由图4(b)可见,对于黄菖蒲叶中MDA 量,除Cd0 Zn150、Cd0.5 Zn50 处理组外,不同质量浓度Cd胁迫下,Zn 的添加显著降低了MDA 量,且不同浓度Zn 处理之间达到显著水平。不添加Cd 的空白对照组中,MDA 量随Zn 质量浓度的增加而增加,Cd0.5 处理组中,MDA 量随Zn 质量浓度的增加而降低。
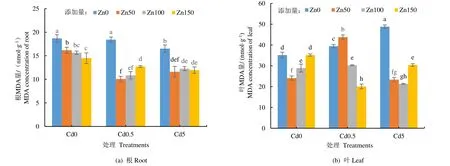
图4 Cd 胁迫下添加Zn 黄菖蒲根和叶中MDA 量Fig.4 Zn on MDA content in Iris pseudacorus under the stress of Cd
2.5 Zn 对黄菖蒲富集Cd 的影响
加Zn 处理下,黄菖蒲对Cd 的转运和富集系数如表1 所示。不同质量浓度Zn 处理下,除个别处理外,显著提高了黄菖蒲对Cd 的富集系数。相同条件下,黄菖蒲地上部分对Cd 的富集系数均大于地下部分对Cd 的富集系数。黄菖蒲对Cd 的转运系数均大于1。在Cd0.5 处理组中,Zn100 处理下,黄菖蒲的转运系数达到最大值,在Cd5 处理组中,Zn150 处理下,黄菖蒲的转运系数达到最大值,Cd0.5 和Cd5 处理组中,不同质量浓度Zn 的添加提高了黄菖蒲地上和地下部分的富集系数,且地上部分和地下部分富集系数在Zn50 处理组达到最大。

表1 黄菖蒲对重金属Cd 的转运和富集系数 Table 1 Translocation factors and enrichment coefficients
3 讨 论
重金属胁迫对植物的生长发育表现出一定的抑制作用,重金属超过一定质量浓度,植物体会表现出生长矮小,生长停滞等现象[30]。植物体在Cd 胁迫的环境下,其体内活性氧自由基,如H2O2、O2-量显著增加,同时造成MDA 量的升高,说明植物体内发生膜脂质过氧化,这是造成植物氧化损伤的主要原因之一[31]。MDA 是植物体内发生细胞膜脂质过氧化的重要产物,是细胞损伤程度的标志性物质,其量高低表明了植株遭受逆境胁迫的强弱[32-33]。在Cd 胁迫下,不同植物体内MDA 的变化不同。抗氧化酶是植物抗氧化系统中重要的组成部分。本研究中,添加Zn 处理后,黄菖蒲根和叶中MDA 量显著降低,说明Zn的添加缓解了Cd 对黄菖蒲的胁迫。
为适应逆境胁迫,降低对植株的毒害,植株体内会激活SOD、POD、CAT 等抗氧化酶系统,来清除活性氧自由基对植株的毒害,进行自我保护,防止其对细胞造成损伤[34]。SOD、POD、CAT 等抗氧化酶是植物体内有效的活性有氧自由基清除系统,SOD通过把植物体内多余的超氧自由基转化为过氧化氢来缓解逆境的胁迫[35]。本研究中,添加Zn 处理后,黄菖蒲根中SOD 活性显著提高,而叶中SOD 活性显著降低,可能是因为根是植物直接接触胁迫环境的部分,根部SOD 活性首先被激活来分解植物根部由于胁迫而产生的活性自由基。而叶SOD 活性则可能是等到Cd 由根部输送到叶片,并累积到一定阈值之后才逐渐被激活。而POD 和CAT 则可以将过氧化氢分解为无毒无害的水[36]。Zn 和Cd 属于同族化学元素,具有相似的化学性质、相同的价态和相似的离子半径[37],可以通过相同的转运子ZIP 和HMA4 进入植物体内[38]。当Zn 质量浓度从0~50 mg/L 时,推测Zn 与Cd 对根系吸附位点的竞争促进植物对Cd 的吸收和Cd 在根系中的积累,并在植株体内形成逆境胁迫。大量研究表明,逆境胁迫初期,植株体内产生的大量活性氧导致抗氧化酶活性的增加,随着逆境胁迫持续进行,超过植物自身耐受程度,从而导致抗氧化酶活性下降[39]。本研究中,添加Zn 处理后,黄菖蒲根POD 活性显著提高,而黄菖蒲叶中POD 活性在高质量浓度Zn(Zn150)处理后显著提高,在高质量浓度Zn 处理下,使植物叶片所受胁迫增加,导致POD活性增强。对于CAT 活性,对照组不添加Zn 处理,CAT 活性随Cd 质量浓度的增加而增加,说明此时CAT 活性还没有受到Cd 的破坏,添加Zn 处理后,在不添加Cd 的处理组,根CAT 活性显著提高,在不同质量浓度Cd 处理下(Cd0.5,Cd5),根CAT 活性显著降低,说明Cd 和Zn 的共同作用导致CAT 活性降低。当Zn 质量浓度增加到100 mg/L 时,POD 活性保持较高水平,SOD 活性升高,而CAT 活性降低,可能是由于Zn 和Cd 的拮抗作用导致植物对Cd 的吸收减少,使植物体内重金属胁迫降低。Zn 质量浓度进一步增加至150 mg/L 时,推测是因为植株根系细胞膜通透性增加[40],并导致植物根系对Cd 和Zn 的吸收。相关的CAT 活性的增加并不能弥补POD 和SOD 活性的损失,从而阻止植物的生长。叶片中CAT活性均显著低于对照组,可能是因为Cd 和Zn 的拮抗作用,导致叶片中的Cd 的累积不足以激活叶片中的CAT 活性。不同质量浓度Cd 胁迫下,添加Zn 后,黄菖蒲的地上和地下部分对Cd 的富集系数均显著提高,Cd0.5 处理组中,Zn50 和Zn150 处理组下,黄菖蒲地上和地下部分的富集系数明显高于其他处理;Cd5 处理组中,Zn50 处理下,黄菖蒲的地上和地下部分对Cd 的富集系数达到最大,可见Zn 对黄菖蒲富集重金属Cd 起到一定作用。推测是因为Zn 和Cd在理化性质方面有不同程度的相似性别,Zn 在营养液中的绝对量及与Cd 离子的比例必然对Cd 在土壤中的活性及植物对Cd 的吸收、运转等产生一定影响,而且过量的Zn 可能会下调与Zn 转运子相关的基因,而Zn 转运子也负责植物对Cd 的吸收[41]。0.5 mg/L 质量浓度Cd 处理下,添加50、150 mg/L 质量浓度Zn,黄菖蒲地上和地下部分对Cd 的富集系数分别增加了46.48%、58.71%、43.85%、42.05%,5 mg/L 质量浓度Cd 处理下,添加50、150 mg/L 质量浓度Zn,黄菖蒲地上和地下部分对Cd 的富集系数分别增加了16.13%、9.77%、23.93%、1.89%。对于Cd0.5 胁迫下,Zn100 处理组的黄菖蒲转运系数达到最大,且显著高于对照组,Cd5 胁迫下,Zn150 处理组的黄菖蒲转运系数达到最大值。综合考虑,Zn50 处理更有利于黄菖蒲对Cd 的转运和富集。
4 结 论
1)Zn 的添加缓解了Cd 对黄菖蒲植株的胁迫。对于黄菖蒲来说,Cd 胁迫下,植物根部SOD 较叶片先被激活。
2)Zn 的添加使黄菖蒲根中POD 活性提高,但是低质量浓度Zn(50 mg/L 和100 mg/L)使黄菖蒲叶片中POD 活性降低。不添加Cd 的情况下,Zn 的添加使黄菖蒲根CAT 活性显著提高。
3)黄菖蒲对Cd 的转运系数均大于1。不同质量浓度Zn 的添加提高了黄菖蒲地上和地下部分对Cd的富集系数。综合考虑,在0.5 和5 mg/L Cd 污染下,添加50 mg/L 质量浓度Zn 更有利于黄菖蒲对Cd 的转运和富集。

