黄芪甲苷对人类风湿关节炎成纤维样滑膜细胞增殖及白细胞介素6分泌的影响*
冯美杰,李 蕾,王颖航,徐兢鸿,潘 志△
(1. 长春中医药大学,长春 130117;2. 长春中医药大学附属医院,长春 130021)
类风湿关节炎(rheumatoid arthritis, RA)属于系统免疫性疾病,发病机制目前尚未完全明确。RA的病理变化常表现为关节滑膜受到破坏,治疗不及时或治疗不当可引起关节严重畸形和关节功能障碍[1-2]。
研究发现,激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传导通路是肿瘤坏死因子(tumor necrosis factor-α,TNF-α)诱导RA发病的主要原因,MAPK通路有C-Jun氨基末端激酶、P38和细胞外信号调节激酶三类不同的激酶。研究表明,TNF-α能够明显提高人类风湿关节炎成纤维样滑膜细胞(human fibroblast-like synoviocytes,HFLS-RA)蛋白质酪氨酸磷酸化水平,快速激活MAPK通路,在TNF-α浓度为10 ng/mL时这种诱导能力最为明显[3-4]。黄芪甲苷(astragaloside Ⅳ,AS-Ⅳ)作为黄芪活性成分之一,具有非常广泛的生物学效应[5]。此外,黄芪在RA的临床治疗中显现出明显的优势,但其作用机理尚不清楚。因此,本实验采用TNF-α及黄芪甲苷干预细胞以探讨其分子作用机制。
1 材料
1.1 仪器与试剂
SW-CJ-1D超净台(上海乔跃电子有限公司);XDS-100C型倒置显微镜(上海蔡康光学仪器有限公司);MCO-15AC二氧化碳恒温培养箱(日本SANYO公司);RT-6100酶标仪(深圳雷杜生命科学股份有限公司);3H16RI智能高速冷冻离心机(湖南赫西仪器装备有限公司);165-8000电泳仪(美国伯乐公司);H-DMEM培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);黄芪甲苷标准品(上海源叶生物科技有限公司);TNF-α(美国PEPROTECH公司);MTT(美国Sigma公司);二甲基亚砜(美国Sigma公司);Rat 白细胞介素6 (Interleukin-6,IL-6)、ELISA KIT试剂盒(上海朗顿生物科技有限公司);BCA蛋白浓度测定试剂盒增强型(中国碧云天生物有限公司);c-Jun氨基末端激酶1 (JNK1)抗体(北京博奥森生物技术有限公司);c-Jun氨基末端激酶1/2 (JNK1/2)抗体(北京博奥森生物技术有限公司);Goat anti-Rabbit IgG(H&L)-HRP(北京博奥森生物技术有限公司)。
1.2 细胞
HFLS-RA购自北京北纳创联生物技术研究院,取3~7代用于实验。
2 方法
2.1 细胞培养
将HFLS-RA迅速放入37 ℃温水中,小心快速摇晃至细胞悬液全部溶解,在无菌条件下将细胞悬液移入无菌离心管中,加入培养液后离心弃去上清液,在离心管中加入1 mL培养液,将细胞沉淀混悬,小心吸取移到含有3 mL 10%胎牛血清(FBS)H-DMEM培养基的细胞培养瓶中,置于37 ℃、5%CO2培养箱中进行培养。本实验研究所用细胞为3代到7代[6]。
2.2 细胞分组及干预方法
细胞按随机数字表法分为5组,空白组:10%FBS培养基培养细胞;TNF-α组:10 ng/mL TNF-α;AS-ⅣH组:10 ng/mLTNF-α+100 μg/mLAS-Ⅳ;AS-ⅣM组:10 ng/mLTNF-α+50 μg/mLAS-Ⅳ;AS-Ⅳ L组:10 ng/mLTNF-α+25 μg/mL AS-Ⅳ(依据文献以及前期预实验确定本实验黄芪甲苷的浓度[7])。
2.3 MTT法检测HFLS-RA的增殖活力
当细胞生长到满足传代条件时(80%),用0.25%胰蛋白酶消化细胞,并将细胞密度调整为1×104。按照每孔200 μL将细胞悬液接种于96孔板,将其置于5%CO2、37 ℃培养箱中培养24 h,按照实验分组加药,24 h后加入MTT、DMSO,在490 nm处测定OD值[8-9]。
2.4 ELISA法检测HFLS-RA上清液中IL-6的表达水平
实验分组、加药刺激方法同上,加药后置于培养箱中培养24 h后收集各组细胞上清液,离心后放于-20 ℃保存,按照说明书步骤测定IL-6含量[10-11]。
2.5 Western Blot法检测细胞中JNK1和JNK1/2蛋白表达水平
提取单层贴壁细胞总蛋白,按照增强型BCA蛋白浓度测定试剂盒检测蛋白浓度,计算电泳上样体积。将蛋白样品置于100 ℃沸水中煮10 min,使蛋白完全变性。制胶(12%分离胶、5%浓缩胶),上样后以SDS-PAGE电泳法分离蛋白质(80 V 30 min跑浓缩胶,110 V 90 min跑分离胶),电泳结束后将分离开的蛋白转膜(100 V 85 min),5%脱脂奶粉封闭2 h后,TBST洗膜3~5次, 每次10 min。孵育一抗4 ℃过夜;室温摇床上孵育二抗1 h,ECL化学发光,于成像系统曝光并测定灰度值[12]。
2.6 统计学方法

3 结果
3.1 AS-Ⅳ对TNF-α诱导的HFLS-RA增殖抑制作用
表1示,与空白组比较,TNF-α组HFLS-RA增殖活力明显上升,差异有统计学意义(P<0.05)。与TNF-α组比较,AS-Ⅳ各组HFLS-RA的增殖活力受到明显抑制,其中AS-ⅣH的抑制作用最为明显,差异有统计学意义(P<0.05)。
表1 AS-Ⅳ对TNF-α诱导的HFLS-RA增殖抑制作用
3.2 AS-Ⅳ对TNF-α诱导的HFLS-RA 中IL-6表达的影响
表2示,与空白组比较,TNF-α组HFLS-RA上清液中IL-6表达水平明显升高(P<0.01);与模型组比较,不同浓度AS-Ⅳ组HFLS-RA上清液中所检测的IL-6含量明显降低,其中AS-ⅣH组的IL-6表达水平最低,差异有统计学意义(P<0.01)。
3.3 AS-Ⅳ对TNF-α诱导的HFLS-RA 中JNK1、JNK1/2表达的影响
图1示,与空白组比较,TNF-α组的HFLS-RA内JNK1、JNK1/2蛋白含量明显增加,差异有统计学意义(P<0.05);与TNF-α组比较,AS-Ⅳ各组蛋白含量明显减少,差异有统计学意义(P<0.05),其中AS-ⅣH的抵制作用最为明显。
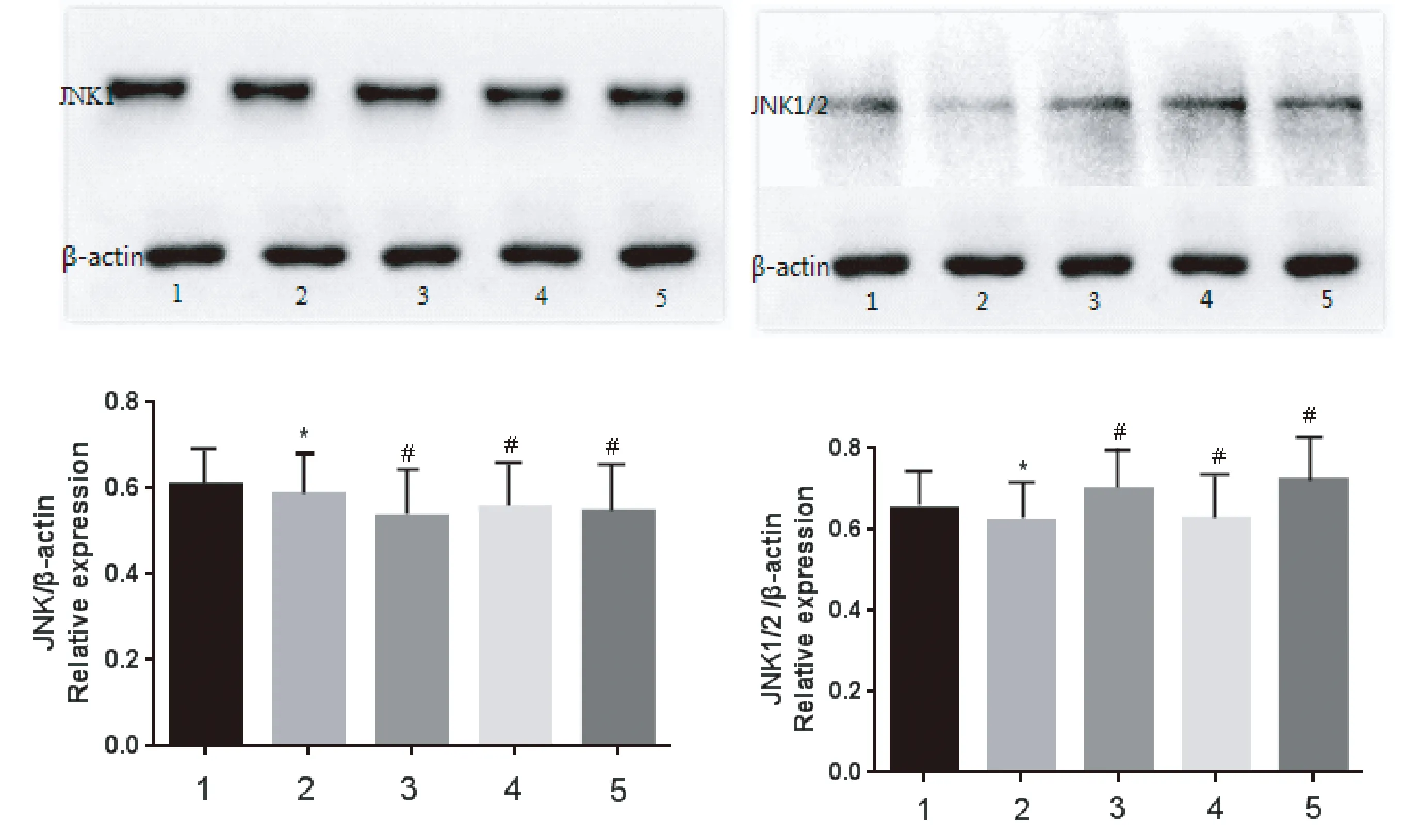
注:1.空白组;2.TNF-α组;3.AS-ⅣH组;4.AS-ⅣM组;5.AS-ⅣL组;与空白组比较:*P<0.05;与TNF-α组比较:#P<0.05图1 各组HFLS-RA JNK1和JNK1/2的表达

表2 各组HFLS-RA上清液中IL-6表达水平
4 讨论
中医根据RA的临床表现和发生发展过程将其归于“痹证”范畴,外邪、营卫不和、素体亏虚是导致痹证的主要原因。目前多数医家对痹证的治疗有一定的共识。如赵靖强调痹证治疗应以扶正祛邪为治则,以温阳行痹为治法[13]。黄芪甲苷是中药黄芪的主要活性成分之一。黄芪作为传统中药材具有扶正补气、固腠理之功效,还可利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌[14],因而临床常用黄芪扶正祛邪以治疗因虚致痹的病证。现代药理学研究发现,黄芪甲苷具有免疫调节、抗病毒、降低血小板黏附力等作用[15-17]。RA的主要特点是滑膜组织增生和关节结构破坏,造成滑膜组织增生和关节结构破坏的主要原因是,RA患者成纤维样滑膜细胞(Fibroblast-like synoviocyte,FLS)的增殖和凋亡平衡失调,使FLS不断地 “肿瘤样”增生[18]。有研究表明,TNF-α能刺激滑膜细胞、成纤维细胞、破骨细胞和软骨细胞产生破坏性物质基质金属蛋白酶,导致RA患者滑膜的炎症持续加重,渐进性破坏软骨与骨组织[19]。IL-6是RA的致病源头因素之一,它参与RA致病过程中早期B细胞和T细胞的活化,并参与全程致病过程。TNF-α能促进滑膜细胞中IL-6的产生,IL-6也能增强TNF-α等细胞因子的促炎效应,因此本实验选择IL-6作为评价指标[20]。JNK信号通路参与细胞增殖、分化和凋亡等多种生物学反应,其可被细胞因子、表皮生长因子等多种因素激活,JNK信号通路功能异常可造成慢性炎症和神经退行性病变等多种疾病[21-22]。JNK磷酸化和胶原酶的基因表达恰恰需要TNF-α的诱导,JNK已被鉴定的亚型为1、2和3,JNK1和JNK2基因在全身广泛表达, 而JNK3呈限制性表达,JNK2不足只在关节炎的临床前模型有所显现,但JNK1不足可以减轻滑膜炎症和关节破坏,JNK1也有利于破骨细胞分化。这些都表明,JNK参与RA的滑膜炎症和关节破坏并可能在RA疾病进程中定位,JNK有望成为临上的一个潜在的治疗靶点,调节相关疾病的发生发展。
本研究显示,体外培养的RA-HFLS经TNF-α刺激24 h后,HFLS-RA增殖活力明显升高,随着AS-Ⅳ浓度的增加,HFLS-RA增殖活力逐渐降低,AS-Ⅳ作用浓度与细胞增殖活力之间存在依赖关系。TNF-α能促进滑膜细胞分泌IL-6,从而使炎症加重、软骨破坏。经过黄芪甲苷的干预后,IL-6的水平显著下降,说明黄芪甲苷可通过抑制炎症细胞因子来控制疾病的炎症反应。Western blot检测滑膜细胞蛋白的表达情况显示,JNK1和JNK1/2蛋白在HFLS-RA模型组中表达明显增加。随着AS-Ⅳ浓度升高,JNK1和JNK1/2蛋白表达水平表现为逐渐降低趋势,表明AS-Ⅳ抑制TNFα诱导HFLS-RA细胞增殖呈剂量依赖性。本研究表明,AS-Ⅳ可抑制TNF-α诱导HFLS-RA增殖,减轻滑膜炎症,其分子机制可能与调控JNK信号传导通路的异常活化有关。但AS-Ⅳ对HFLS-RA的作用不仅仅通过抑制JNK信号通路蛋白磷酸化实现,可能还有其他信号通路参与其中,今后尚需进一步研究。

