推拿对失神经肌萎缩大鼠肌特异性microRNA和肌卫星细胞增殖分化相关因子的影响
重庆医科大学中医药学院,重庆市 400016
周围神经损伤后,骨骼肌失去神经支配,出现肌萎缩[1-2],目前主要治疗手段是神经修复术。由于神经生长速度缓慢,在轴突达到靶器官前,肌肉会处于持续萎缩状态[3]。在神经重建前延缓肌萎缩程度,对肌肉功能恢复有重要价值。
肌卫星细胞的增殖和分化是萎缩肌肉修复再生的基石[4]。肌肉受损后,肌卫星细胞激活,增殖分化为新生肌纤维参与骨骼肌再生与修复[5]。其中配对盒转录因子(paired box transcription factor 7,Pax7)是维持肌卫星细胞增殖水平的重要标志分子。肌肉受损后,Pax7表达上调,激活肌卫星细胞增殖、分化。成肌分化抗原(myogenic differentiation antigen,MyoD)和肌细胞生成素(myogenin,MyoG)是肌卫星细胞分化的关键调节因子,也是Pax7 的下游分子;MyoD 为初级分化因子,主要调控成肌分化;MyoG 为次级分化因子,主要调控肌管终末分化形成成熟肌纤维[6]。microRNA是涉及转录后基因沉默的一类非编码RNA,其中microRNA-133a、microRNA-206 和microRNA-1 为肌特异性microRNA,对Pax7、MyoD、MyoG 的表达具有调控作用[7]。
推拿是中医的重要组成部分,对骨和软组织损伤有很好疗效[8-9]。本研究观察推拿对失腓总神经大鼠腓肠肌中microRNA-133a、microRNA-206、microRNA-1、Pax7、MyoD、MyoG 表达的影响,从肌卫星细胞增殖分化的角度探讨推拿干预失神经肌萎缩的可能机制。
1 材料与方法
1.1 实验动物与分组
SPF 级健康雄性Sprague-Dawley 大鼠42 只,体质量(270±10) g,由成都达硕实验动物有限公司提供,动物合格证号SCXK(川)2015-030。分笼饲养,室温(22±2) ℃,相对湿度(60±5)%,明暗12 h 交替,饮食水自由摄取。
适应性喂养1 周后,大鼠编号,计算机自动生成42个两位数的随机数字表,每个编号对应一个随机数字,再按随机数字的大小重新排列,序号1~6 为假手术组(n=6),7~25 为模型组(n=18),26~42 为推拿组(n=18)。
实验中对动物的处置均遵照重庆医科大学伦理委员会标准。
1.2 试剂及仪器
SYBR Premix Ex TaqTMⅡ,RR047A 反转录试剂盒,Trizol 总RNA 提取液,Pax7、MyoD1、MyoG、microRNA-1、microRNA-133a、microRNA-206 引 物合成:日本TAKARA 公司。柔软型大鼠固定器:温州原上草医疗科技有限公司。AL204 型电子天平:瑞士METTLER TOLEDO 公司。低温高速离心机:美国SIGMA 公司。ThermoND 2000 超微量核酸蛋白测定仪:上海GENE 公司。T100TM聚合酶链反应(polymerase chain reaction,PCR)仪、CFXPCR 检测系统:美国BIO RAD 公司。冰冻切片机:德国LEICA 公司。CellSens Standard 图像采集软件、BX53 正置显微镜:日本OLYMPUS公司。AFY-10型小动物按摩器:天津爱福依科技有限公司。RPM薄膜压力测试仪:上海邑成测试设备有限公司。
1.3 造模
大鼠10%水合氯醛3 ml/kg 腹腔注射麻醉,无菌条件下右股外侧切口,钝性分离肌肉,暴露胫神经并游离。模型组和推拿组切除腓总神经约1 cm;假手术组只暴露神经,不离断[10]。逐层缝合后自由进食、饮水。
1.4 干预方法
术后第2天起,推拿组以柔软型大鼠固定器固定,待情绪稳定后,将动物按摩器按摩头固定于术侧下肢,RPM 薄膜压力测试仪测试,纵向压力5 N,转速2600 r/min,时长15 min,每天1 次[10]。假手术组和模型组仅固定,不进行任何干预。
1.5 检测方法
模型组和推拿组分别于术后14 d、21 d、28 d,随机数字表法取6 只大鼠,颈椎脱臼法处死。假手术组于术后28 d同法一次性处死。
1.5.1 腓肠肌湿重比测定
从股骨内外髁起点到跟骨结节处完整取下双侧腓肠肌,吸干表面残留液体,立即电子天平称量湿重,计算腓肠肌湿重比(术侧/非术侧)。
术侧腓肠肌组织分为两份,一份快速液氮冷冻后-80 ℃冰箱保存备用,另一份4%多聚甲醛固定,包埋,行形态学检测。
1.5.2 组织学观察
腓肠肌4%多聚甲醛固定后,梯度乙醇脱水,浸蜡包埋后,石蜡切片,厚3 μm,行HE 染色。随机取3张切片,400倍光学显微镜观察,每张切片随机选取4 个视野拍照,每个视野选20 个细胞,Image Pro Plus 6.0图像分析软件计算腓肠肌细胞直径和面积。
1.5.3 逆转录实时定量PCR
冰冻保存的腓肠肌60 mg,置于2.0 ml 无酶EP 管中,Trizol 法提取总RNA,超微量核酸蛋白测定仪检测总RNA 浓度和纯度后定量,根据反转录试剂盒操作步骤配制反应体系,置于T100TMPCR 仪中反转录成cDNA,SYBR Green 法配制反应体系,行定量PCR,并读取Ct值。以β-actin为Pax7、MyoD、MyoG内参,以u6 为microRNA-1、microRNA-133a、microRNA-206的内参,计算目的基因2-ΔΔCt。引物序列如下。
Pax7:上游5'-GCA GTC GGA CCA CAT TCA CG-3';下游5'-GCA CGA CGG TTA CTG AAC CAG A-3'。
MyoG:上游5'-CCA GAC TAC CCA CCG TCC ATT-3';下游5'-CTG AGT TTG CCC CGT TGA GG-3'。
MyoD:上游5'-CGC CTG AGC AAA GTG AAC GA-3';下游5'-CAG ACC TTC AAT GTA GCG GAT G-3'。
microRNA-206:上游5'-CTG GAA TGT AAG GAA GTG TGT GG-3';下游5'-ACA CTT CCT TAC ATT CCA GCC-3'。
microRNA-133a:上游5'-TGG TCC CCT TCA ACC AGC TG-3';下游5'-TGG TTG AAG GGG ACC AAA GCC-3'。
microRNA-1:上游5'-GGC TGG AAT GTA AAG AAG TGT GTA T-3';下游5'-ATA CAC ACT TCT TTA CAT TCC AGC C-3'。
β-Actin:上游5'-ACG GTC AGG TCA TCA CTA TCG-3';下游5'-GGC ATA GAG GTC TTT ACG GAT G-3'。
u6:上游5'-CTC GCT TCG GCA GCA CA-3';下游5'-AAC GCT TCA CGA ATT TGC GT-3'。
1.6 统计学分析
2 结果
2.1 腓肠肌湿重比
各时间点模型组和推拿组腓肠肌湿重比均小于假手术组(P<0.05),并呈下降趋势;推拿组各时间点腓肠肌湿重比均高于模型组(P<0.05)。见表1。
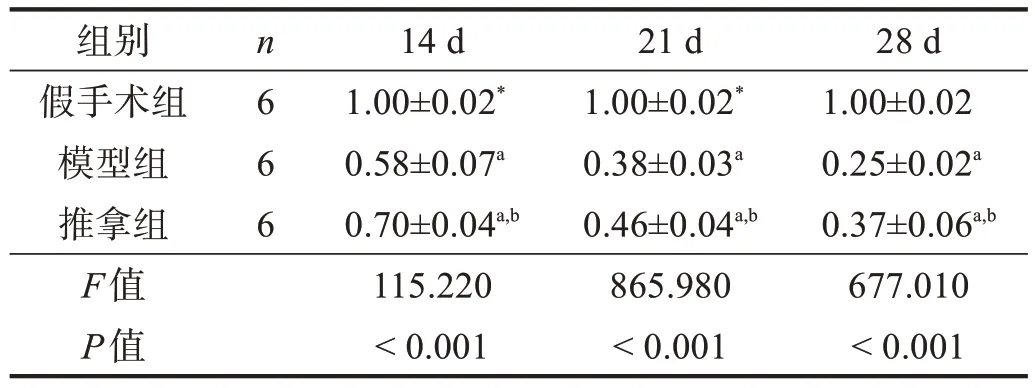
表1 各组腓肠肌湿重比较
2.2 HE染色
假手术组肌细胞大小正常,肌纤维排列正常;模型组和推拿组时间延长,肌纤维排列逐渐混乱,肌细胞截面积逐渐减小;模型组较推拿组变化明显。见图1。
除14 d 时推拿组肌细胞面积与假手术组无显著性差异(P>0.05)外,各个时间点模型组和推拿组肌细胞面积和直径均小于假手术组(P<0.05),并呈下降趋势;推拿组各个时间点肌细胞面积和直径均高于模型组(P<0.05)。见表2、表3。
2.3 PCR
模型组和推拿组Pax7表达均呈下降趋势。模型组14 d时Pax7表达高于假手术组(P<0.05),21 d时与假手术组无显著性差异(P>0.05),28 d 时低于假手术组(P<0.05);推拿组14 d 和21 d 时Pax7 表达高于假手术组(P<0.05),28 d 时与假手术组无显著性差异(P>0.05);各时间点Pax7 表达均高于模型组(P<0.05)。见表4。
模型组和推拿组MyoD 和MyoG 表达均呈先上升后下降趋势。各时间点模型组和推拿组MyoD 和MyoG 表达均高于假手术组(P<0.05);除14 d 时MyoG 表达外,推拿组各时间点MyoD 和MyoG 表达量高于模型组(P<0.05)。见表5、表6。
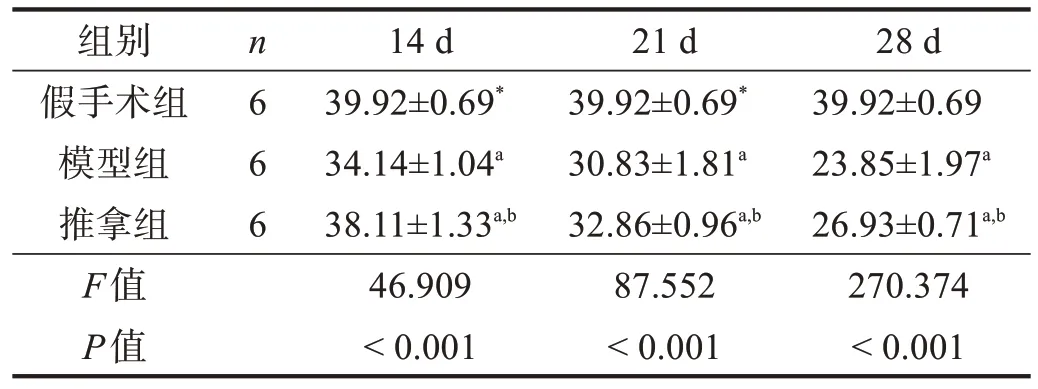
表2 各组腓肠肌肌细胞直径比较(μm)
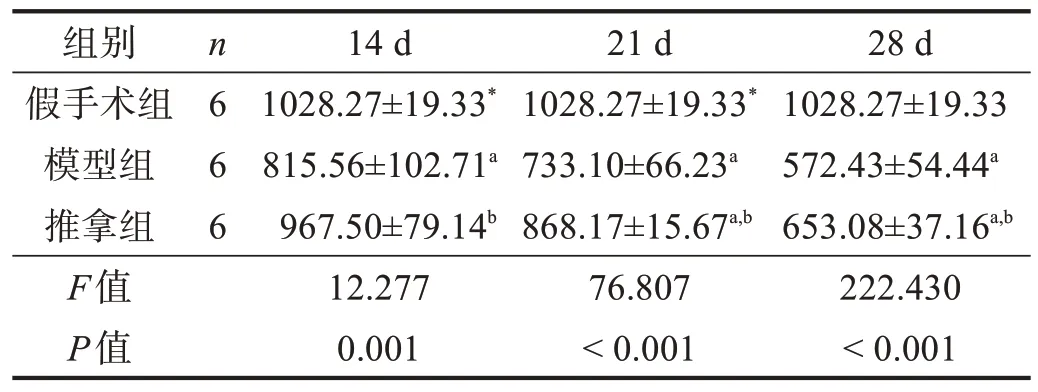
表3 各组腓肠肌肌细胞面积比较(μm2)
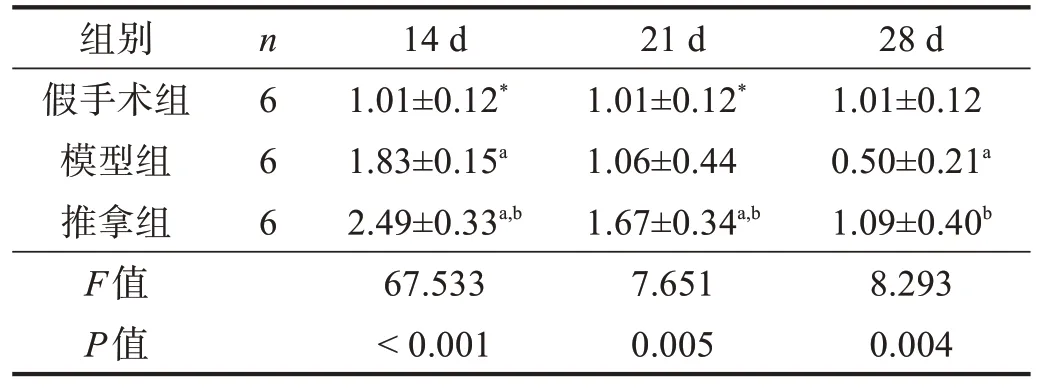
表4 各组腓肠肌Pax7表达比较(2-ΔΔCt)
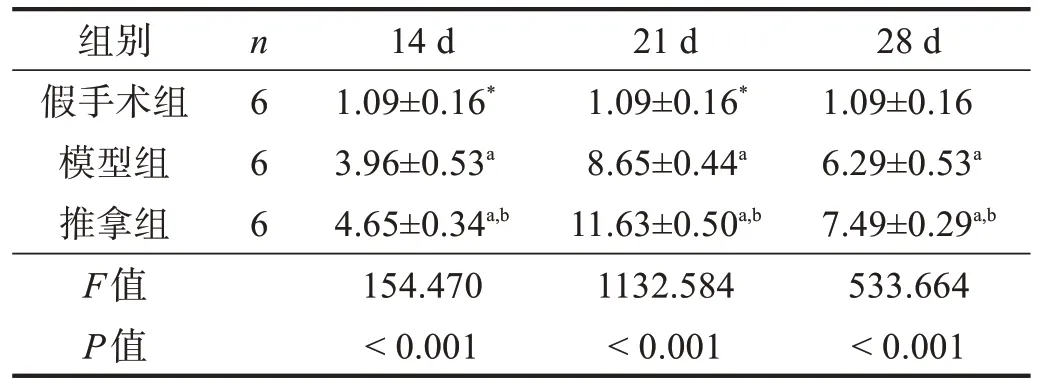
表5 各组腓肠肌MyoD表达比较(2-ΔΔCt)
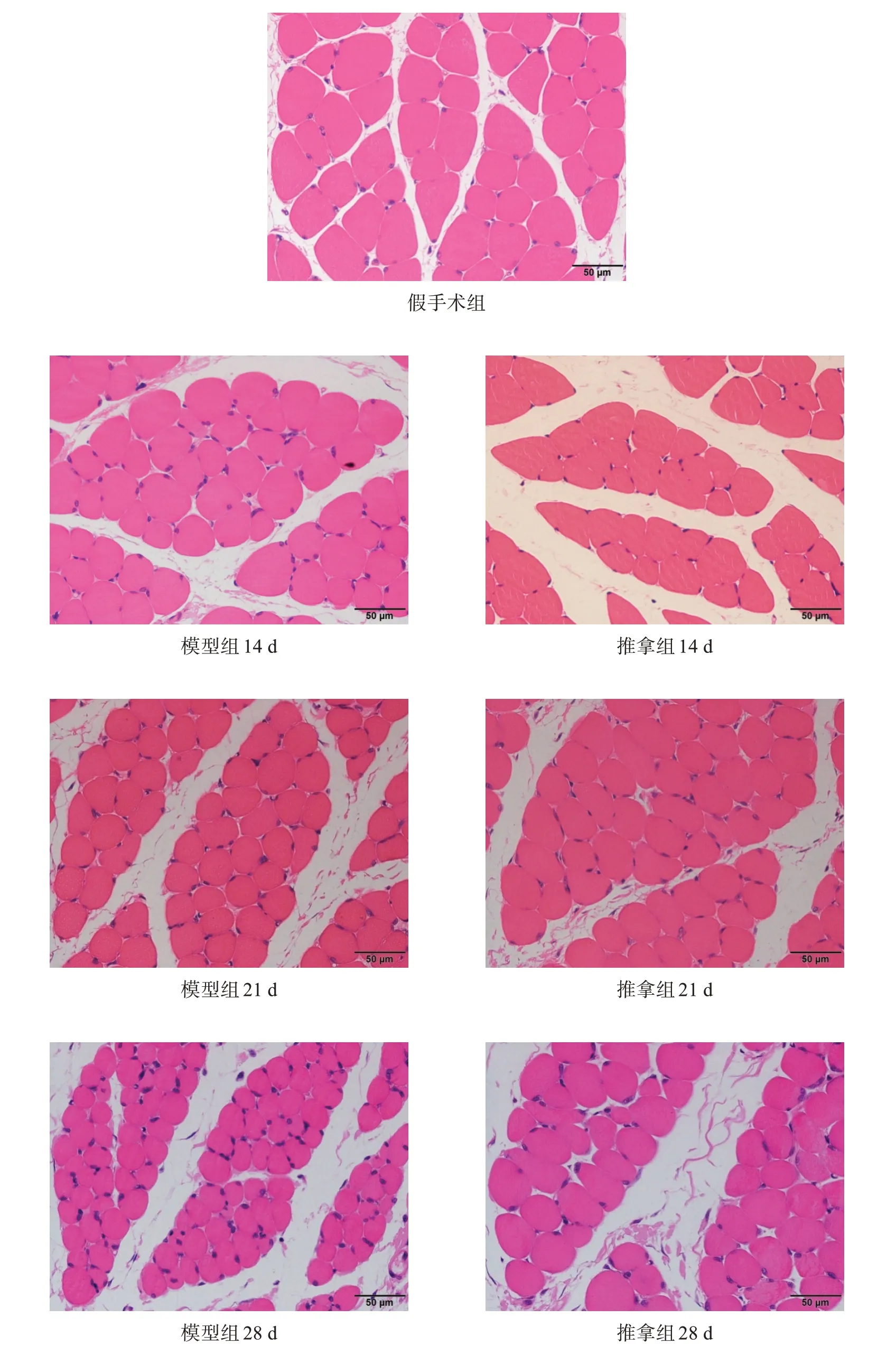
图1 各组腓肠肌细胞形态(HE染色,×400)
模型组和推拿组microRNA 表达仅取21 d 时的数据。21 d 时,模型组和推拿组microRNA-1 和microRNA-133a 表达均低于假手术组(P<0.05),microRNA-206 表达高于假手术组(P<0.05);推拿组microRNA-1、microRNA-133a 和microRNA-206 表达均高于模型组(P<0.05)。见表7。
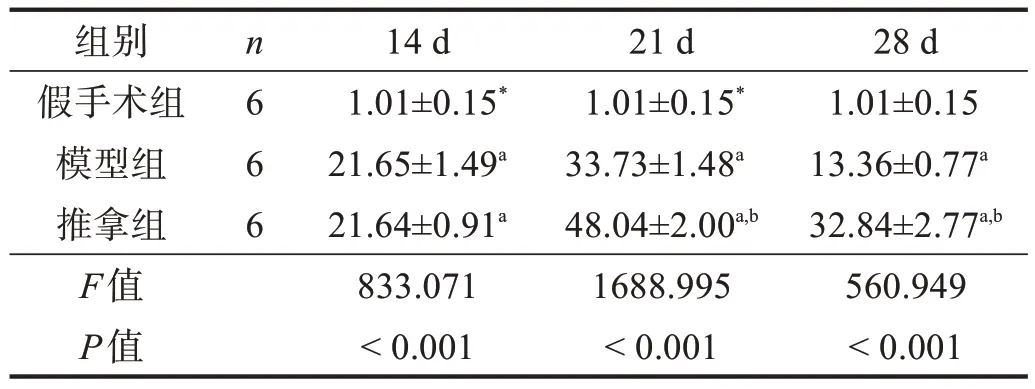
表6 各组腓肠肌MyoG表达比较(2-ΔΔCt)
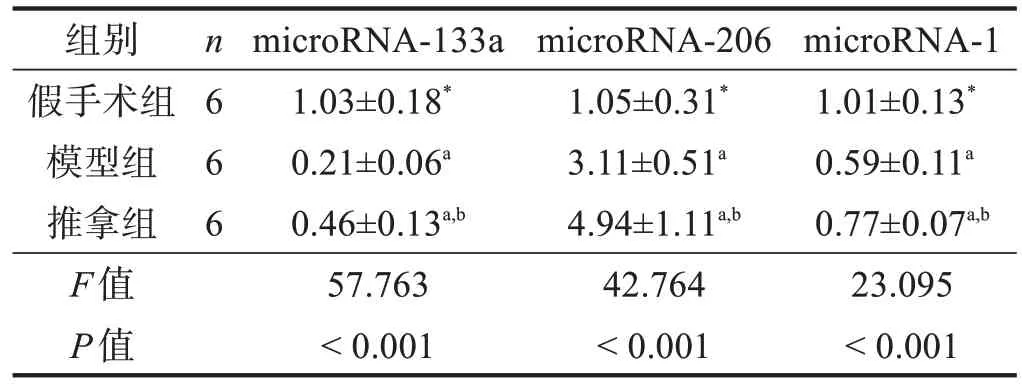
表7 21 d时各组腓肠肌各microRNA表达比较(2-ΔΔCt)
3 讨论
推拿治疗肌肉萎缩有着悠久历史。随着医学的发展,推拿促进骨骼肌损伤修复的分子生物学机制也逐步被认识[8]。我们前期已分别从细胞自噬[10]和蛋白质降解[11]两个方面证明推拿具有延缓失神经肌萎缩的作用。本实验将从肌卫星细胞增殖分化的角度,探讨推拿延缓失神经肌萎缩的效应。
肌卫星细胞是肌肉组织的干细胞,是肌肉自我修复再生的基石[12]。骨骼肌受损后,肌卫星细胞被立即激活,并在24 h 内进入细胞周期进行有丝分裂,这时,Pax7是靶向上调肌卫星细胞增殖的关键因子[13-14]。Pax7的下游是负责肌卫星细胞向肌源性分化的肌源性调节因子(myogenic regulatory factors,MRFs)[15],MyoD 和MyoG 都是MRFs 家族成员[16-17]。Pax7 可通过直接结合MyoD 远端增强元件和近端启动子,诱导MyoD 表达,使肌卫星细胞分化为扁圆形成肌细胞;MyoD 诱导下游次级分化因子MyoG 表达,使扁圆形成肌细胞转变为梭形,相互融合为肌管,最后成为成熟肌纤维[18-20]。Pax7/MyoD/MyoG 形成的信号通路在失神经骨骼肌增殖和分化过程中扮演着重要角色。
研究显示[21-22],切断坐骨神经初期,腓肠肌Pax7表达量是正常大鼠的3~5 倍;随时间延长,Pax7 表达进行性下降,肌卫星细胞增殖速度也逐渐减慢,最终导致肌卫星细胞池耗竭。本研究显示,在失神经初中期,Pax7 的表达量是正常大鼠的2 倍,之后随时间推移呈下降趋势;推拿能有效刺激失神经后期Pax7的表达,提示能促进肌卫星细胞增殖,延缓肌肉萎缩。
另一方面,腓肠肌中分化相关因子MyoD 和MyoG 在失神经中期表达最明显[23],提示细胞分化活跃。如肌卫星细胞无法增殖,MyoD 和MyoG 的表达也会下降[22]。范蕊等[24]电针干预创伤性脊髓损伤大鼠,也发现上调MyoD和MyoG的表达可减轻腓肠肌萎缩。赵丹丹等[25]发现,电针干预失坐骨神经大鼠可刺激大鼠腓肠肌产生适应性肥大,并刺激MyoD 和MyoG 表达。本研究显示,失神经21 d 后,MyoD 和MyoG 表达呈下降趋势,提示肌卫星细胞分化水平下降;推拿可提高MyoD 和MyoG 表达,可能刺激肌卫星细胞分化,延缓肌肉萎缩。
microRNA 是一类长度约为22 个核苷酸的非编码RNA,与靶基因mRNA 3'UTR 端互补序列结合后,发挥调控靶基因表达的作用。已发现多种microRNA 被证明在肌肉发生发育、损伤修复中起关键作用[26]。其中microRNA-133a、microRNA-206 和microRNA-1 是肌肉组织特异性表达的microRNA。敲除microRNA-133a、microRNA-206 和microRNA-1 会加剧肌肉萎缩[27]。这三种肌特异性microRNA 主要通过对Pax7/MyoD/MyoG 信号通路的调控,参与骨骼肌修复[28]。肌生成抑制素8 (growth differentiation factor 8,GDF8)作为microRNA-133a、microRNA-206 和microRNA-1的共同靶基因,能抑制Pax7表达;在肌卫星细胞增殖期间,microRNA-133a、microRNA-206 和 microRNA-1 通过抑制GDF8 的表达,实现对Pax7 的调控。microRNA-1 和microRNA-206 下调MyoD 的抑制因子MyoR,从而上调MyoD 表达,促进成肌分化[29-30]。Nakasa 等[31]发现,向胫骨前肌损伤模型大鼠局部肌肉注射microRNA-133a、microRNA-206 和microRNA-1 混合物,能有效诱导Pax7、MyoD 和MyoG表达,促进肌肉修复。刘泽远等[30]认为,被动运动通过促进microRNA-1 的表达,以促进MyoD 表达,进而促进成肌细胞分化,达到防止失神经肌萎缩的作用。何玉童等[32]在体外对小鼠C2C12 成肌细胞进行周期性机械牵拉,肌特异性microRNA 表达发生变化,引起MyoD和MyoG表达升高。
研究发现[33],失神经肌肉中肌特异性microRNA诱导会出现延迟:失神经早期肌肉还未萎缩,萎缩相关基因表达升高,而microRNA 表达受抑制;失神经中后期,肌肉萎缩并开始诱导microRNA 参与萎缩程序的调控。本团队前期研究也发现[11],失神经早期和终末期,肌肉中microRNA 表达不显著。故本研究仅检测21 d时microRNA。结果显示,推拿组microRNA表达上升,结合同时间点Pax7、MyoD 和MyoG 表达也显著增加,提示推拿可能通过促进肌特异性microRNA的表达,调控Pax7/MyoD/MyoG通路。
综上所述,推拿延缓失神经肌萎缩的可能机制之一是通过上调肌特异性microRNA 的表达,促进Pax7/MyoD/MyoG 通路转录,刺激肌卫星细胞增殖、分化,形成新生肌纤维参与肌肉修复,达到延缓失神经肌萎缩的目的。
利益冲突声明:所有作者声明不存在利益冲突。

