CRISPR-Cas9敲减鹅硬脂酰辅酶A去饱和酶基因的慢病毒质粒构建
袁鑫,李亮,何桦,胡深强,王继文
(四川农业大学,畜禽遗传资源发掘与创新利用四川省重点实验室,成都611130)
CRISPR-Cas系统可充当防御外源遗传物质的“基因武器”,能够对抗入侵的病毒及外源DNA,沉默外源基因的表达[1]。由于该系统精确的靶向功能性,目前已被开发成为高效的基因编辑工具,并成功在人[2]、小鼠[3]、斑马鱼[4]、鸡[5]等物种上实现对细胞、胚胎和组织中特异性基因的编辑修饰。CRISPR-Cas系统的基因座由以下3部分组成:5′端反式激活RNA(trans-activating CRISPR RNA,tracrRNA)基因,3′端CRISPR 序列元件,中间为一系列CRISPR 相关基因(CRISPR-associated gene,Cas gene),包 括Cas1~Cas10 等[6-7]。CRISPR-Cas系统可以分为3种类型(Ⅰ~Ⅲ)以及至少11种不同的亚型(Ⅰ-A~Ⅰ-F,Ⅱ-A~Ⅱ-C,Ⅲ-A~Ⅲ-B)[8]。其中,研究较深入、应用最成熟的是以Cas9 蛋白为主的Ⅱ型[9]。实现基因编辑功能只需要2个工具[10]:一是单链指导RNA(single-guide RNA,sgRNA),它是将crRNA(CRISPR-derived RNA)和tracrRNA 进行改装得到的体外人工合成的一小段单链核糖核苷酸。二是Cas9 蛋白,它包含2 个结构域,即类HNH(HNH-like)核酸酶结构域和类RuvC(RuvClike)结构域,其中:类HNH 核酸酶结构域能剪切与crRNA 互补的序列,而类RuvC 结构域则剪切非互补的序列。通过指导RNA 序列与靶序列进行碱基配对,引导Cas9蛋白结合到靶序列处并在特定位点上行使DNA 切割功能,使双链DNA 断点(doublestrand break,DSB),然后此断点通过非同源性末端连接(non-homologous end joining, NHEJ)或同源重组(homologous recombination,HR)修复机制进行插入/缺失、修复或替换[11]。
硬脂酰辅酶A 去饱和酶(stearoyl-coenzyme A desaturase, SCD)是一种内质网酶,催化饱和脂肪酸——硬脂酰辅酶A(C16:0)和棕榈酰辅酶A(C18:0)在第9和10碳原子间导入氢键,分别形成单不饱和脂肪酸——油酸(C16:1)和棕榈酸(C18:1)[12];它也是脂肪生成和脂类氧化的关键控制点,通过调节单不饱和脂肪酸的合成及比例,影响细胞膜的流动性和脂蛋白代谢,从而影响脂质代谢和引起多种代谢疾病及癌症[13-15]。此外,由于SCD 可调节机体脂肪沉积量及影响脂类的脂肪酸谱,从而影响畜禽产品的品质,因此,SCD基因也是改善动物肉产品、乳产品脂肪酸组成的重要候选基因[16-17]。
卵黄沉积是卵泡发育成熟的一个关键环节,涉及卵黄前体物质的运输、转化和沉积;普遍认为卵泡合成脂质的能力非常低下,几乎都来源于肝[18]。但在人和小鼠[19]、大鼠[20]、山羊[21]、牛[22]等哺乳动物中已经证实卵泡颗粒细胞中存在脂质代谢,然而其作用效果及机制仍知之甚少。本研究以天府肉鹅(Anas platyrhynchos)为研究对象,利用CRISPRCas9 系统成功构建了靶向鹅SCD基因的慢病毒敲减质粒,为后续研究鹅卵泡颗粒细胞内源性脂质代谢机制及分子调控通路奠定了基础。
1 材料与方法
1.1 细胞株和质粒
慢病毒:psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP,购自江苏百奥迈科生物技术有限公司。包装质粒:psPAX2 及pMD2.G,购自美国Addgene公司。人胚肾细胞(293T)和中国仓鼠卵巢(Chinese hamster ovary, CHO)细胞由本实验室保存。
1.2 主要试剂
质粒小提试剂盒,购自美国Omega 公司;高糖DME培养基(Dulbecco’s modified Eagle’s medium),购自美国Thermo公司;胎牛血清,购自美国Corning公司;DNA 标志物、胶纯化试剂盒,购自日本TaKaRa 公司;限制性内切酶,购自美国NEB 公司;琼脂糖、减血清培养基、脂质体转染试剂盒,购自美国Invitrogen 公司;sgRNA 体外合成试剂盒、一步纯化RNA转录产物试剂盒、SpCas9核酸酶切试剂盒,购自江苏百奥迈科生物技术有限公司。
1.3 引物合成及测序
所有寡核苷酸序列合成及测序均由生工生物工程(上海)股份有限公司完成。
1.4 方法
1.4.1 sgRNA 设计
根据鹅SCD基因核苷酸序列(GenBank 登录号:XM_013201691)以及鹅基因组序列(ftp://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/001/973/225/GCF_001973225.1_ASM197322v1),利用CasOT系统[23]进行全基因组脱靶位点、种子序列错配、潜在靶点及具体靶点分析,筛选最优sgRNA 靶点,并合成sgRNA 寡核苷酸序列以用于体外转录合成相应的sgRNA。
1.4.2 sgRNA 体外合成
根据sgRNA体外合成试剂盒说明书进行操作。首先,将sgRNA 序列替换到CRISPR_F 寡核苷酸(5′-GAAATTAATACGACTCACTATAGGN18-20G TTTTAGAGCTAGAAATAGC-3′,GGN18-20 为 替换序列)上,按照50 μL反应体系(ddH2O 40 μL、10×Pfu 缓冲液5 μL、10 mol/mL dNTPs 1 μL、Pfu DNA聚 合 酶2 μL、100 mol/µL CRISPR_F 引 物1 μL、100 mol/µL sgRNA-R 1 μL)混合,95 ℃加热5 min,然后置于冰上快速冷冻10 min,72 ℃孵育30 min后,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s(25个循环);最后,72 ℃再延伸10 min,4 ℃终止];其次,对PCR 产物进行纯化,获得带T7 启动子的sgRNA 的DNA 模板,按照20 μL 反应体系(去RNA 酶水7 μL、100 mol/mL rNTP 5 μL、300 ng/μL DNA 模板5 μL、10×反应缓冲液2 μL,T7 RNA聚合酶1 μL)混合,于37 ℃条件下孵育30 min 以进行体外转录;最后,使用一步纯化法RNA转录产物试剂盒进行产物纯化。
1.4.3 核酸内切酶裂解实验
根据SpCas9核酸酶切试剂盒操作说明,将4 μL 10×裂 解 缓 冲 液 与4 μL 指 导RNA(guide RNA,gRNA)混合,90 ℃退火10 min,然后缓慢冷却到室温,再加入2 μL Cas9蛋白,室温孵育60 min后,加入4 μL DNA 底物,37 ℃孵育60 min,最后通过1%琼脂糖凝胶电泳分析裂解效果。
1.4.4 psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 慢病毒包装
将慢病毒psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP、包 装 质 粒psPAX2 及pMD2.G组成三质粒系统。选择生长状态好的293T细胞铺在10 cm板上(数量为5×106),待细胞生长至90%~95%汇合度后,用减血清培养基洗涤细胞1次,然后加入5 mL减血清培养基,置于CO2培养箱中孵育30 min。按照脂质体转染试剂盒操作说明,分别将psPAX2、pMD2.G、psgRNA-mCherry-T2A-Puro和pLenti-Cas9-T2A-EGFP各7 μg与脂质体混合,室温孵育5 min后,再分别加入到细胞中,转染6 h后,移去含脂质体的培养基,更换无抗生素的高糖DME培养基,正常培养细胞,72 h 后收集病毒上清液,以3 000g离心10 min,去掉细胞残片,用0.45 μm 滤器过滤,超速离心浓缩后,分装,于-80 ℃条件下保存。
1.4.5 CHO 细胞感染
将生长状态良好的CHO 细胞接种到24 孔板上,接种数量为1×105,待细胞生长至60%~70%汇合度后进行病毒感染。感染前,吸去细胞原有培养基,加入1/2体积新鲜培养基,然后将病毒液加入到细胞中,轻轻按“8”字混匀,在37 ℃条件下小体积感染6~8 h后,补齐培养基至正常体积,感染72 h后,在荧光显微镜下观察荧光表达效率。
1.4.6 流式细胞分析与分选
用2%的胰蛋白酶消化贴壁的CHO 细胞,然后用磷酸盐缓冲液重悬成单个细胞,经50 μm 尼龙膜过滤到流式管中,在BD FACSAriaⅡ流式细胞分选仪器上分析细胞的荧光比例与强度,并将分选出的具有增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)与红色荧光蛋白(mCherry)的强双阳性细胞接种至24孔板中继续培养。
2 结果与分析
2.1 sgRNA 的设计与寡核苷酸链的合成
利用CasOT 系统,分析脱靶结果参数报告(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2020.02.151),筛选靶点完全匹配的基因组序列,即选择A00(sgRNA序列100%匹配对应基因组序列的个数)为1的靶点,若A00参数大于1表示该靶点完全匹配2个以上的基因组位点,即完全脱靶。共选择6 对特异性较好的sgRNA,其在鹅SCD基因组中的位置如图1 所示(sgRNA1~6),它们的靶向位点及寡核苷酸序列见表1,通过体外转录合成相应的sgRNA,用于下一步实验。
2.2 sgRNA体外线性化裂解和表达质粒测序结果
由图2 可见:在SpCas9/sgRNANC(阴性对照组)复合物的情况下,线性化质粒未被裂解;在SpCas9/sgRNA1~6 复合物的情况下,线性化质粒被裂解成2个条带,且不同的sgRNA裂解产物与裂解效率不同,其中sgRNA1 和sgRNA3 的剪切效果较好,且测序结果显示,sgRNA1 和sgRNA3 寡核苷酸链插入的方向、位置与预期相符(图3),证明质粒构建正确。
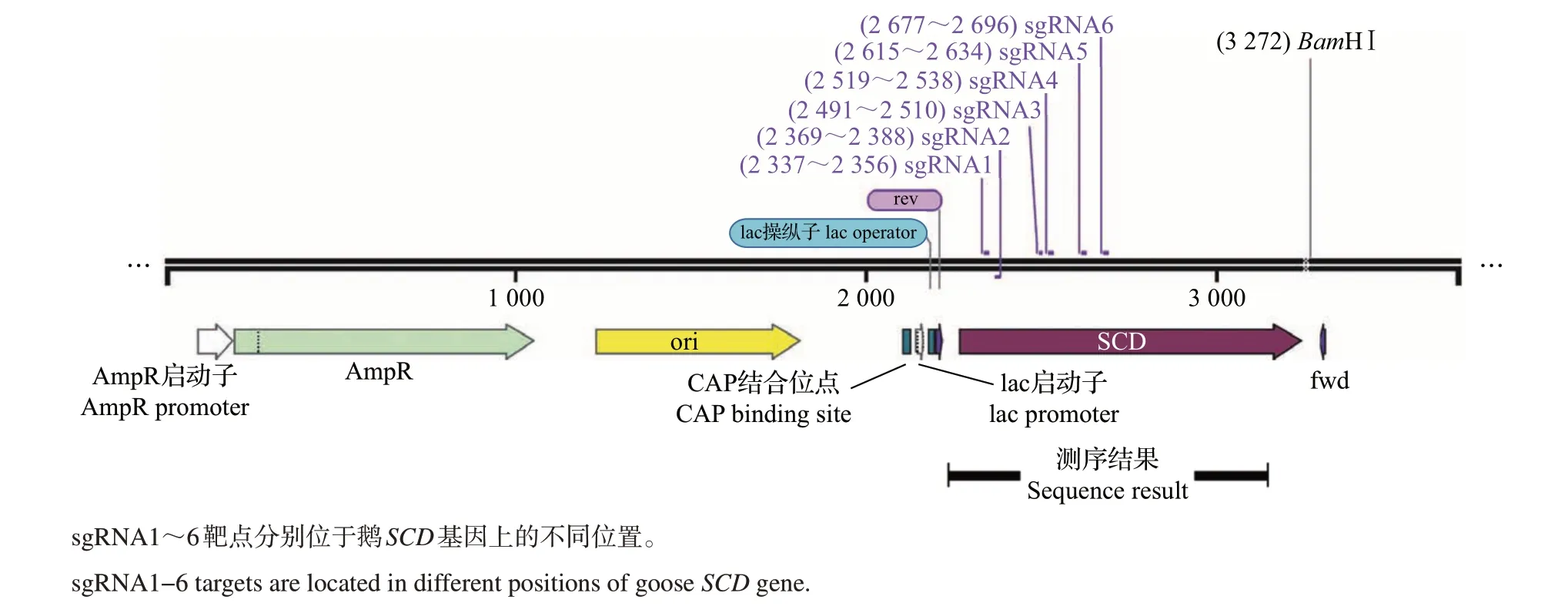
图1 鹅SCD基因sgRNA靶点设计示意图Fig.1 Schematic diagram of the sgRNA-targeting sites in goose SCD gene
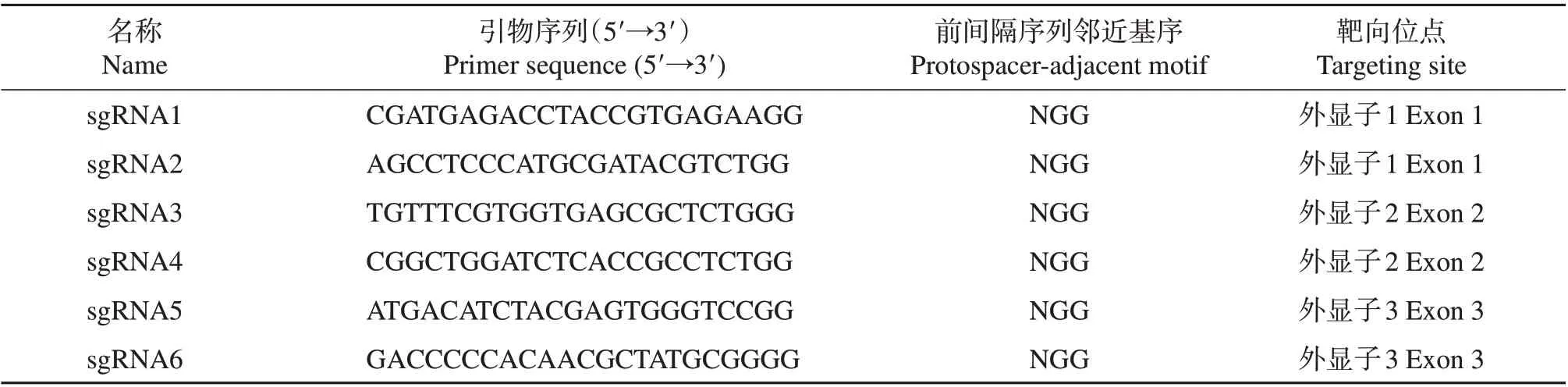
表1 靶向位点及sgRNA寡核苷酸序列Table 1 Targeting sites and sequences of sgRNA oligonucleotides
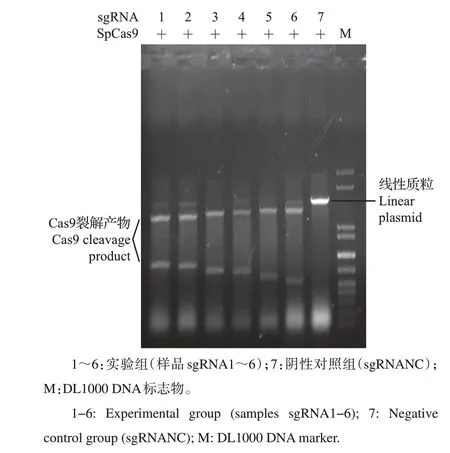
图2 sgRNA体外线性化裂解Fig.2 Linearization cleavage in vitro of sgRNA
2.3 psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 病毒感染CHO 细胞分析
正常培养CHO细胞至密度为60%~70%,将病毒液psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 共同感染细胞,以二者单独感染及空白作为阴性对照。在荧光显微镜下观察发现,与对照组相比,共同感染psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 的CHO 细胞可同时表达红色荧光蛋白(mCherry)和增强绿色荧光蛋白(EGFP),而二者单独感染细胞只表达其中的一种,空白细胞不表达荧光蛋白(图4),表明二者共同感染CHO细胞成功。
2.4 流式细胞分析与分选结果
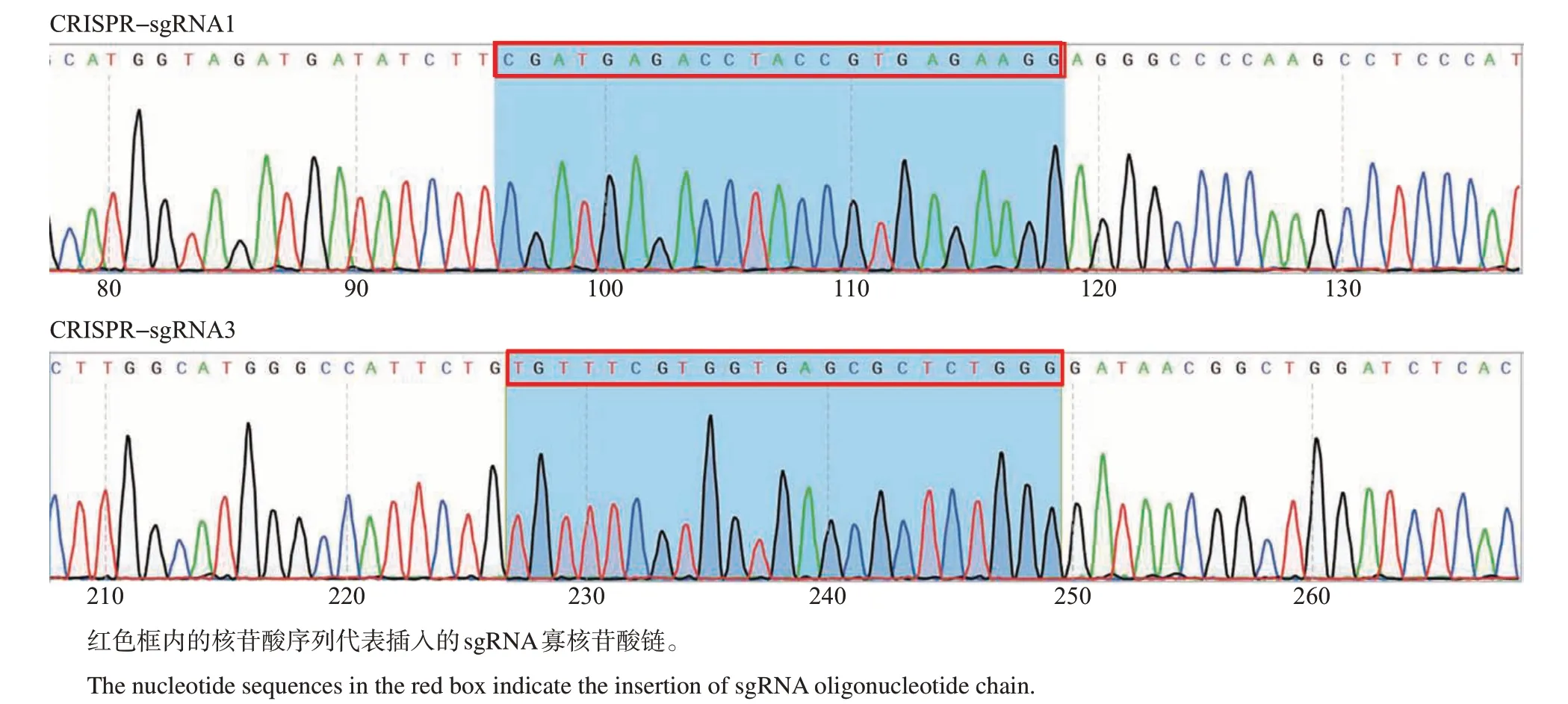
图3 插入sgRNA1和sgRNA3序列的测序图Fig.3 Sequencing diagrams of the inserted sgRNA1 and sgRNA3 sequences
将感染后的CHO 细胞扩繁消化,在BD FACSAriaⅡ流式细胞分析仪上分析细胞的荧光比例与强度。由图5 可知,psgRNA1-mCherry-T2APuro 和pLenti-Cas9-T2A-EGFP 共同感染效率为13.4%,psgRNA3-mCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 共同感染效率为11.2%,psgRNANCmCherry-T2A-Puro 和pLenti-Cas9-T2A-EGFP 共同感染效率为16.6%。利用分选仪器,分别筛选出强双阳性细胞群,并接种至24 孔板中继续培养,在荧光显微镜下观察发现,筛选后的细胞能同时表达红色荧光蛋白和增强绿色荧光蛋白(图6)。
3 讨论
研究表明,鹅卵泡颗粒细胞具有脂肪酸从头合成能力[24],卵泡发育过程的组学研究也证实了鹅卵泡颗粒细胞中存在大量脂质代谢相关差异基因,并构建了差异基因的表达网络[25],表明鹅颗粒细胞内源性脂肪酸对卵泡发育起着至关重要的作用;但目前有关研究大都集中于肝的转运机制上,而有关颗粒细胞内源性脂肪酸合成相关调控机制尚有待阐明。由于禽类在产蛋期需要合成大量中性脂肪(甘油三酯和胆固醇等),并转运到生长中的卵母细胞以形成卵黄,因此,其肝脏脂肪酸代谢水平显著提高[26];而研究表明,SCD基因在高产禽肝组织中的表达量极显著高于产蛋前期肝组织中的表达量,推测SCD基因参与了禽产蛋期肝脏脂肪酸代谢的生物学过程[27]。敲除SCD基因的小鼠模型也表明,SCD的缺失直接或间接地诱导了脂肪酸向氧化而非合成方向分化的信号表达,且减少体内单不饱和脂肪酸的合成可以造成癌细胞的死亡[28-29]。而SCD基因也是瘦素信号的靶基因,可被瘦素抑制[30-31]。在鹅卵泡颗粒细胞中,已确定瘦素可通过PI3K/Akt/mTOR 信号通路来调控颗粒细胞增殖、脂肪酸从头合成及类固醇激素合成[24],且证实其在“脂质代谢平衡-卵泡颗粒细胞凋亡-卵泡闭锁”之间发挥着重要作用[32]。因此,推测SCD基因可能在卵泡颗粒细胞内源性脂肪酸合成代谢机制中发挥着关键作用。
通过传统的同源重组方法获取基因打靶,不仅工作量大而且效率低,而CRISPR-Cas9基因编辑技术提高了基因定点修饰的效率和精确性。利用该技术对天府肉鹅SCD基因做精准遗传修饰,通过模型的建立,制造SCD基因缺陷型,可以更好地研究其在颗粒细胞的脂肪酸合成代谢过程中的相关功能。本实验首次报道利用CRISPR-Cas9 构建鹅SCD基因慢病毒敲减质粒,结果表明,该载体被成功构建并能感染CHO 细胞,且筛选出了具有mCherry 和EGFP 的双阳性细胞群并可继续培养。这一模型的建立,为探究鹅卵泡颗粒细胞内源性脂肪酸合成代谢的作用机制奠定了基础。
4 结论
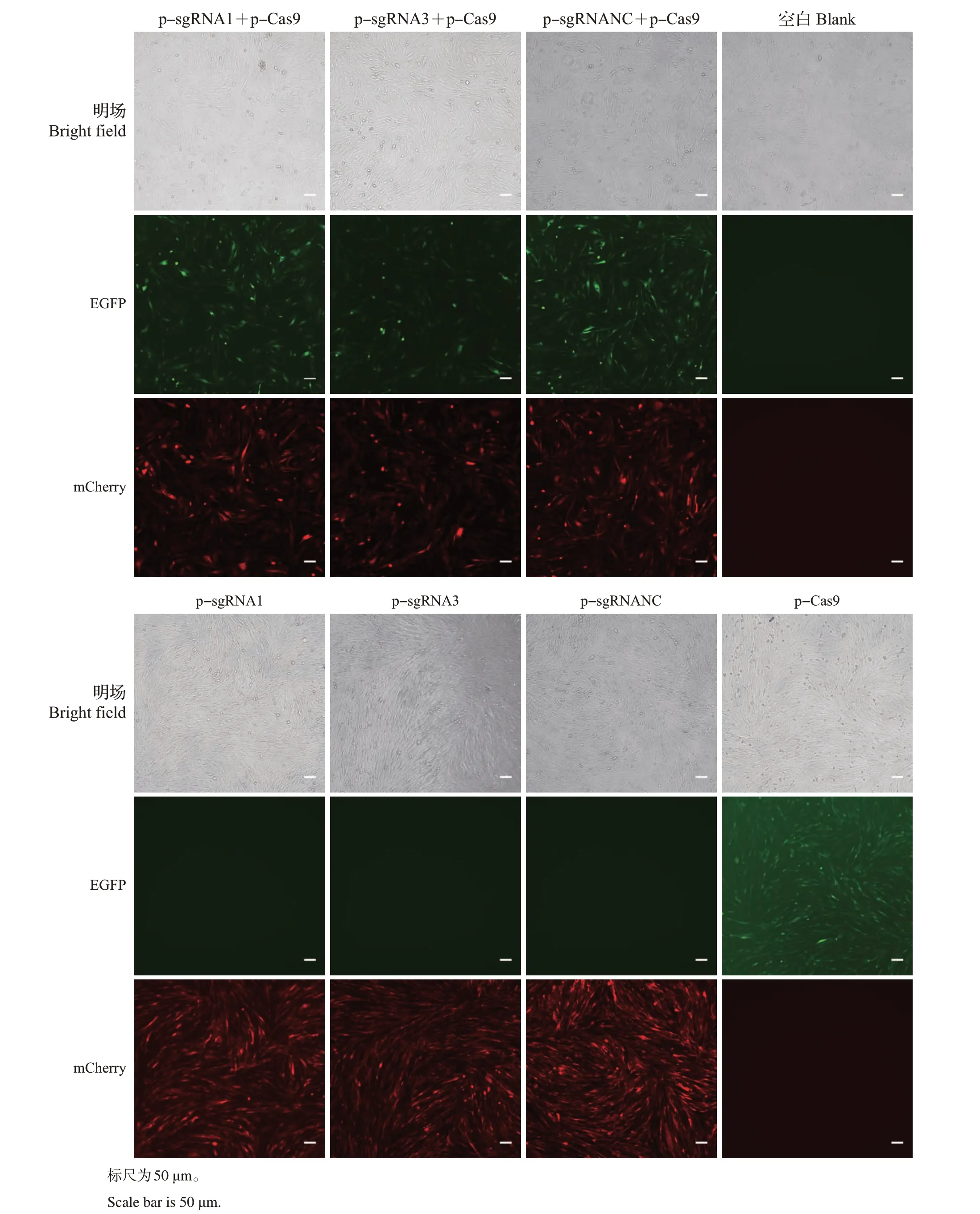
图4 共同感染psgRNA-mCherry-T2A-Puro和pLenti-Cas9-T2A-EGFP的CHO细胞的荧光显微镜观察Fig.4 Fluorescence microscope observation on CHO cells by co-transfection of psgRNA-mCherry-T2A-Puro and pLenti-Cas9-T2A-EGFP
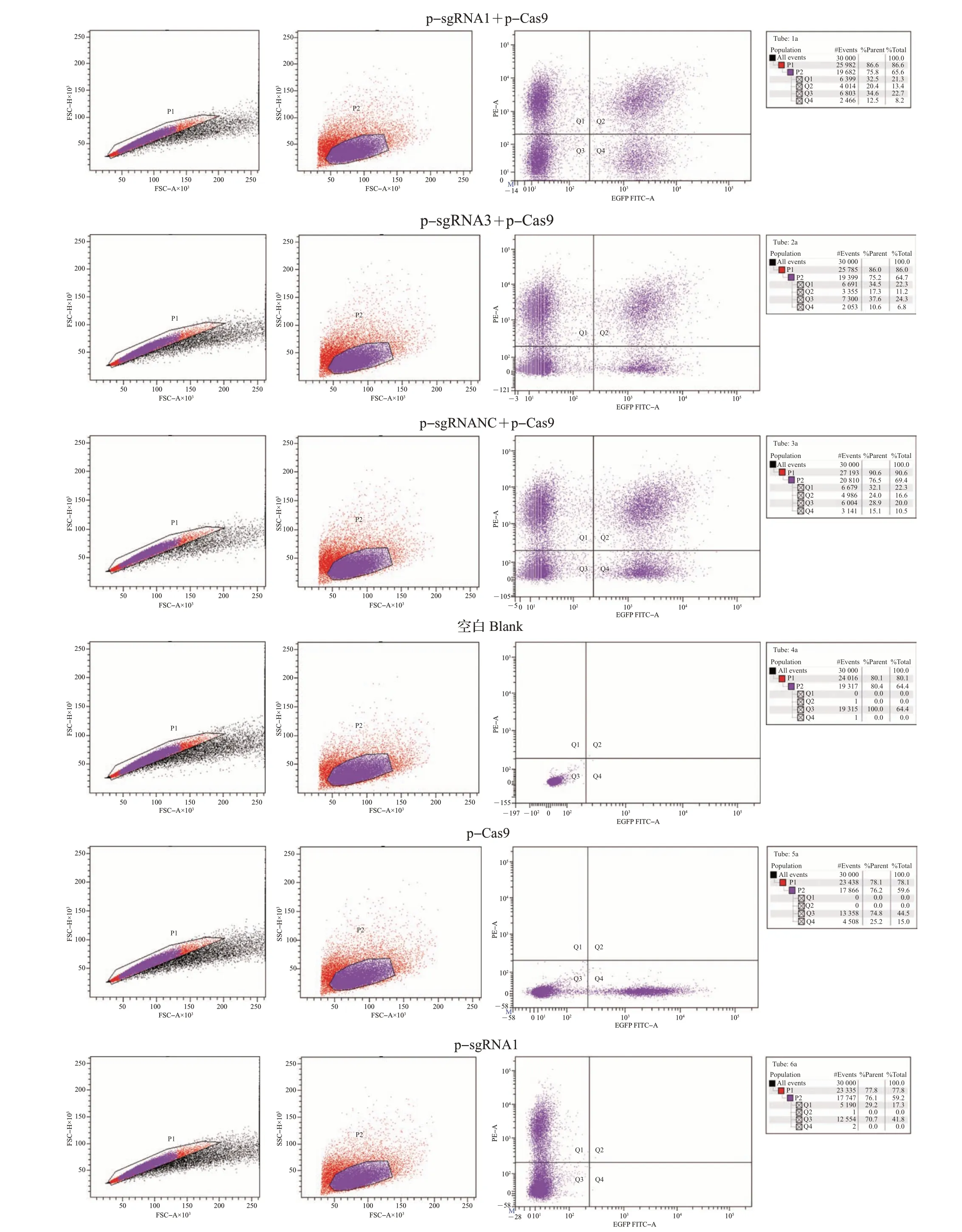
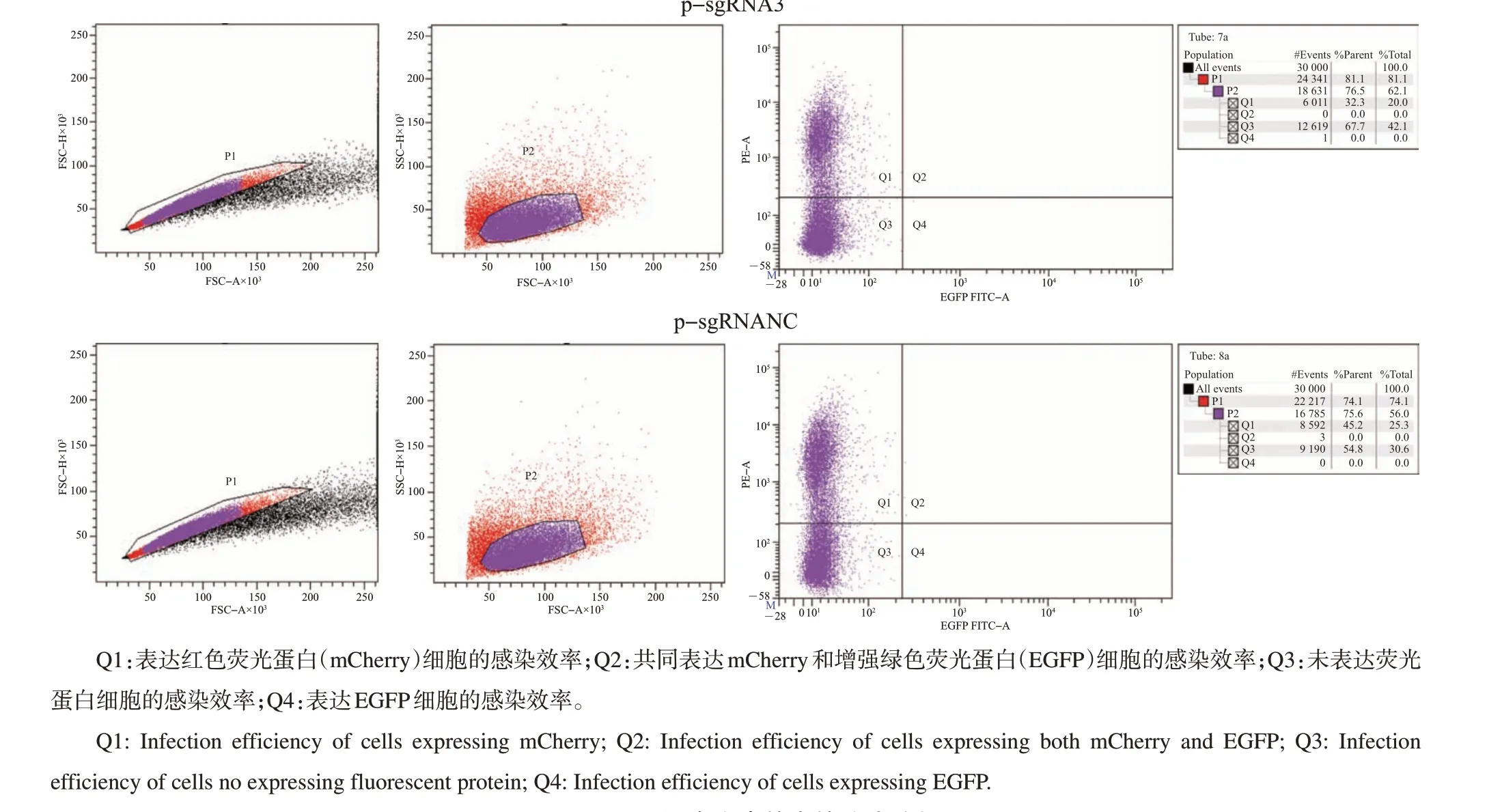
图5 CHO细胞感染效率的流式分析Fig.5 Analysis of infection efficiency of CHO cells by fluorescence activated cell sorting(FACs)
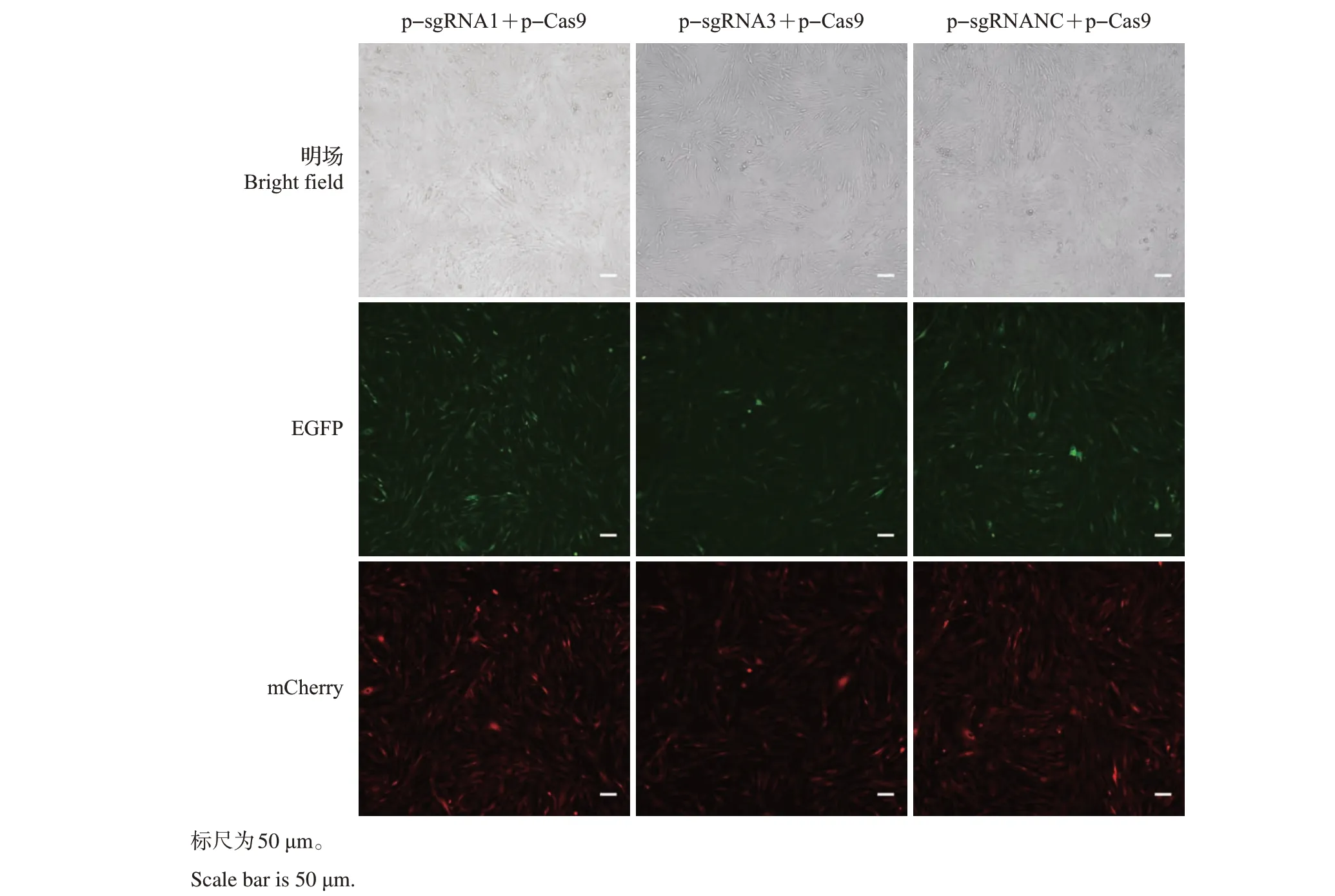
图6 流式分选出的强双阳性细胞群的荧光显微镜观察Fig.6 Fluorescence microscope observation on strong double positive cell groups sorted by the flow sorter
本研究以天府肉鹅为研究对象,首先设计鹅SCD基因的sgRNA序列,然后体外合成并验证其裂解效率,最后利用psPAX2和pMD2.G包装质粒制备psgRNA-mCherry-T2A-Puro 和pLenti-Cas9-T2AEGFP 病毒。结果表明,psgRNA-mCherry-T2APuro和pLenti-Cas9-T2A-EGFP病毒质粒能够感染CHO 细胞,并分选出了能同时表达mCherry 和EGFP的强双阳性细胞群。该研究为后续在鹅原代颗粒细胞中敲减SCD基因奠定了基础。
——一道江苏高考题的奥秘解读和拓展

